第四章 补体系统
学习目标
1.掌握补体系统的概念及组成、补体经典途径的激活过程、补体的生物学作用。
2.熟悉补体三条激活途径的异同。
3.了解补体活化的调节。
补体系统(complement system)是由30余种具有酶活性的糖蛋白组成,具有精密调控机制和自限性的酶解系统。补体可经抗原抗体复合物或其他途径激活,产生溶细胞、炎症反应以及调理吞噬等多种功能,是机体防御机能的重要组成成分。
第一节 补体系统的组成和理化性质
一、补体系统的组成
构成补体系统的各种成分按其生物学功能可以分为三类:
1.补体固有成分 指存在于体液中,参与补体激活级联反应的补体成分,包括:①经典激活途径的C1q、C1r、C1s、C4、C2等;②甘露聚糖结合凝集素(mannan-binding lectin,MBL)激活途径的MBL和丝氨酸蛋白酶(serine protease)等;③旁路激活途径的B因子、D因子等;④上述三条途径的共同末端通路的C3、C5、C6、C7、C8和C9等。
2.补体调节蛋白 是以可溶性或膜结合形式存在,参与调节补体活化和效应的一类蛋白质分子。包括备解素、C1抑制物、I因子、C4结合蛋白、H因子、S蛋白以及膜表面的促衰变因子、膜辅助蛋白、同种限制因子、膜反应溶解抑制因子等。
3.补体受体 是介导补体活性片段或调节蛋白生物效应的受体,包括CR1~CR5、C3aR、C2aR、C4aR等。
二、补体系统的命名
由于补体系统组成和功能的复杂性,其命名较为复杂,一般有以下规律可循:参与补体经典激活途径的固有成分,按其被发现的先后分别命名为C1(q、r、s)、C2、……、C9;补体系统的其他成分以英文大写字母表示,如B因子、D因子、P因子、H因子;补体调节蛋白多以其功能命名,如C1抑制物、C4结合蛋白、促衰变因子等;补体活化后的裂解片段,以该成分的符号后面附加小写英文字母表示,如C3a、C3b等;具有酶活性的成分或复合物,在其符号上画一横线表示,如  灭活的补体片段,在其符号前加英文字母i表示,如iC3b。
灭活的补体片段,在其符号前加英文字母i表示,如iC3b。
三、补体的理化特性
补体蛋白多为糖蛋白,占血清蛋白总量的10%左右。其含量相对稳定,不因免疫而增加,仅在某些疾病时有所变动。补体一般以无活性形式存在于血清中。在补体系统中,C3含量最高,D因子含量最低。补体主要在血液和肝脏中代谢,半衰期约1天。补体性质不稳定,56℃,30 min即失去活性。
第二节 补体系统的激活
补体系统各成分通常以非活性状态存在于血浆中,当其被激活物活化后才表现出各种生物学活性。补体的激活过程是一系列放大的级联反应,即前一组活化的成分是后一组分的催化酶。根据激活过程起始顺序的不同,补体的激活可分为三条途径:即从免疫复合物激活C1、C2、C4等开始的激活途径为经典途径;由MBL结合至细菌表面启动激活的途径为MBL途径;由病原微生物等提供接触表面,跃过C1、C2、C4,从C3开始的激活途径为旁路途径。
一、经典途径
经典途径(classical pathway)激活过程是从C1的活化开始,所以经典途径又称C1途径。
能激活补体经典途径的激活物主要是抗原与IgG、IgM类抗体形成的免疫复合物(IC),其次,具有Clq受体的某些RNA病毒、核酸、粘多糖、肝素和鱼精蛋白等,均可与Clq结合,产生激活补体效应。经典途径的激活过程可分为识别阶段、活化阶段和膜攻击阶段。
1.识别阶段 即经典途径的启动,是C1与抗原抗体复合物中免疫球蛋白的补体结合点相结合至C1活化的阶段(图4-1)。
C1是由三种亚单位(C1q,C1r,C1s)依赖于Ca2+结合成牢固的非活性大分子。其中C1q有6个Ig结合点。C1q与IC中的IgM或IgG分子结合后即可启动C1r活化,C1r进一步使C1s活化。C1s具有酯酶活性,可作用于后续成分C4和C2。

图4-1 C1分子结构模式图
2.活化阶段 即C1作用于后续的补体成分,至形成C3转化酶  和C5转化酶
和C5转化酶 的阶段(图4-2)。
的阶段(图4-2)。

图4-2 经典途径激活过程中识别与活化阶段模式图
C4是  的底物,在Mg2+的存在下,裂解为C4a,C4b两个片段。C2也是
的底物,在Mg2+的存在下,裂解为C4a,C4b两个片段。C2也是  的底物,在Mg2+的存在下裂解为C2a,C2b。C4b与C2b结合成
的底物,在Mg2+的存在下裂解为C2a,C2b。C4b与C2b结合成 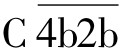 ,称为C3转化酶。C3在C3转化酶作用下,裂解成C3a和C3b。C3b与
,称为C3转化酶。C3在C3转化酶作用下,裂解成C3a和C3b。C3b与  相结合产生 C
相结合产生 C  ,为经典途径的C5转化酶。
,为经典途径的C5转化酶。
3.膜攻击阶段 是形成攻膜复合物(membrane attack complex,MAC)的阶段,即C5转化酶裂解C5后,作用于后续的其他补体成分,最终导致细胞膜受损、细胞裂解的阶段。
C5在 C  的作用下裂解为C5a、C5b。C5b不稳定,当与C6结合成C5b6时成为较为稳定的复合物。C5b6与C7结合成C5b67即可吸附于已致敏的细胞膜上,插入膜的磷脂双分子层中,为细胞膜受损伤的一个关键组分。C5b67虽无酶活性,但进一步同C8 和12~15个C9结合后形成C5b6789,即补体的膜攻击复合物,可使细胞膜穿孔受损(图4 -3,图4-4)。
的作用下裂解为C5a、C5b。C5b不稳定,当与C6结合成C5b6时成为较为稳定的复合物。C5b6与C7结合成C5b67即可吸附于已致敏的细胞膜上,插入膜的磷脂双分子层中,为细胞膜受损伤的一个关键组分。C5b67虽无酶活性,但进一步同C8 和12~15个C9结合后形成C5b6789,即补体的膜攻击复合物,可使细胞膜穿孔受损(图4 -3,图4-4)。

图4-3 膜攻击阶段模式图
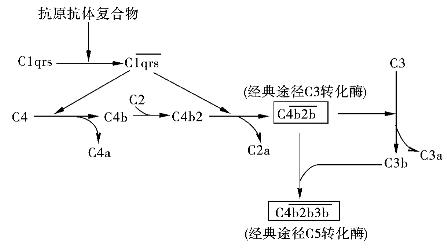
图4-4 经典途径的激活
二、MBL途径
MBL途径(mannan-binding lectin pathway),又称为凝集素途径(lectin pathway)是细菌和病毒表面的甘露糖残基与血清中的MBL结合,进而激活C4、C2、C3的活化途径。
MBL是一种钙依赖性糖结合蛋白,属于凝集素家族,可与细菌的甘露糖残基结合。正常血清中MBL水平极低,在急性期反应时,其水平明显升高。MBL首先与细菌的甘露糖残基结合,然后与丝氨酸蛋白酶结合,形成MBL相关的丝氨酸蛋白酶(MBL-associated serine protease,MASP-1、MASP-2)。MASP具有与活化的C1q同样的生物学活性,可水解C4和C2分子,继而形成C3转化酶,其后的反应过程与经典途径相同。此外,C反应蛋白也可与C1q结合并使之激活,然后依次激活补体其他成分(图4-5)。

图4-5 MBL的激活途径
三、替代途径
由病原微生物等提供接触表面,不经C1、C4、C2,而由C3、B因子开始的激活途径为补体激活的替代途径(alternative pathway),又称为旁路途径。
某些细菌的细胞壁成分(脂多糖、肽聚糖、磷壁酸)、凝聚的IgA和IgG4以及其他哺乳动物的细胞,可不通过C1q的活化,而直接激活旁路途径。这些成分实际上提供了使补体激活级联反应得以进行的接触表面,这种激活方式可不依赖于特异性抗体的形成,从而在感染早期即可为机体提供有效的抗感染作用。
1.生理情况下的准备阶段 在正常生理情况下,C3可自发裂解产生极少量的C3b(也可由经典途径获得),其可与B因子结合为C3bB,在血清D因子的作用下,可将B因子裂解为Ba和Bb,Ba释放到液相,Bb仍附着于C3b形成C3bBb,即旁路途径的C3转化酶,其可与血清中的备解素(properdin,P因子)结合而稳定,并可裂解C3生成C3a和C3b,后者沉积于颗粒表面并与 C  结合形成 C
结合形成 C  (或写成 C
(或写成 C  ),即替代途径的C5转化酶。
),即替代途径的C5转化酶。
但正常生理情况下,体液中的H因子和I因子可灭活C3b、C  ;自身细胞表面存在的调节蛋白也可很快灭活沉积于自身组织细胞表面的C3b,使以上反应不能顺利进行。只有当H因子和I因子的作用被阻挡之际,旁路途径方得以激活(图4-6)。
;自身细胞表面存在的调节蛋白也可很快灭活沉积于自身组织细胞表面的C3b,使以上反应不能顺利进行。只有当H因子和I因子的作用被阻挡之际,旁路途径方得以激活(图4-6)。
2.替代途径的激活 当细菌的脂多糖、肽聚糖、病毒、肿瘤细胞等物质出现时,H因子、I因子不能灭活C3b、C 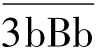 ,而且这些细胞表面一般缺乏灭活C3b的调节蛋白,此时旁路途径被激活(图4-6)。
,而且这些细胞表面一般缺乏灭活C3b的调节蛋白,此时旁路途径被激活(图4-6)。

图4-6 旁路途径的激活
3.激活效应的扩大 当C3被激活后,裂解为C3b,C3b又可在B因子和D因子的参与下合成新的  ,进一步促使C3裂解,血浆中有丰富的C3、B因子、Mg2+,这可在激活部位产生显著的扩大效应,有人称此为依赖C3b的正反馈途径,或称C3b的正反馈途径(图4-7)。
,进一步促使C3裂解,血浆中有丰富的C3、B因子、Mg2+,这可在激活部位产生显著的扩大效应,有人称此为依赖C3b的正反馈途径,或称C3b的正反馈途径(图4-7)。

图4-7 激活效应的扩大
四、补体活化的共同末端效应
三条途径最终均形成膜攻击复合物(membrane attack complex,MAC),即在胞膜上形成小孔。使得小的可溶性分子、离子以及水分子可以自由透过胞膜,但蛋白质之类的大分子却难以从胞浆中逸出,最终导致胞内渗透压降低,细胞溶解。此外,末端补体成分插入胞膜,可能使致死量钙离子被动地向胞内弥散,并最终导致细胞死亡(图4-8,表4-1)。

图4-8 补体三条激活途径全过程示图
表4-1 补体激活途径的比较

第三节 补体活化的调节与补体受体
一、补体活化的调节
补体激活是一种高度有序的级联反应,从而发挥广泛的生物学效应。但是,不受控制的补体激活也会对自身组织细胞造成损伤。正常情况下,补体激活及其末端效应均处于严密调控之下,包括补体自身调控以及补体调节因子的作用,从而有效地维持机体的自稳功能。
(一)自行衰变的调节
某些补体成分的裂解产物极不稳定,易于自行衰变,成为补体激活过程中的一种自控机制。例如:C4b2b复合物中的C2b自行衰变,使其不能持续激活C3,限制了后续补体成分的连锁反应。
(二)体液中灭活物质的调节
(1)C1抑制物(C1 inhibitor,C1INH)可与C1不可逆地结合,使后者失去酯酶活性,不再裂解C4和C2,不再形成  (C3转化酶),从而阻断或削减后续补体的反应。
(C3转化酶),从而阻断或削减后续补体的反应。
(2)C4结合蛋白(C4 binding protein,C4bp)能竞争性地抑制C4b与C2b结合,因此能抑制  的形成。
的形成。
(3) I因子(又称C3b灭活因子,C3b inactivator,C3bINA) 能裂解C3b,使其成为iC3b,因而使  及
及  均失去与C3b结合成C5转化酶的机会。
均失去与C3b结合成C5转化酶的机会。
(4)H因子(factor H) H因子不仅能加快I因子灭活C3b的速度,更能竞争性地抑制B因子与C3b的结合,还能使C3b从  中置换出来,加速其灭活。
中置换出来,加速其灭活。
(5)S蛋白(S protein) S蛋白能干扰C5b67与细胞膜的结合。
(6)C8结合蛋白(C8 binding protein,C8bp)(又称同源性限制因子,homologous restriction factor,HRF) C8bp可阻止C5b678中的C8与C9的结合,从而避免危及自身细胞膜的损伤作用。
二、补体受体
补体成分激活后产生的裂解片段,能与免疫细胞表面的特异性受体结合而发挥生物学效应。
现已发现的补体受体(complementruceptor,CR)有10多种,曾按其所结合的配体而命名,如C3bR、C3dR C3aR等。但经详细研究后发现,补体受体并非仅与C3裂解产物反应,因而按其发现先后命名,如CR1~CR5。此外,尚有其他补体成分的受体,如C5aR、C2aR及C4aR等。
第四节 补体的生物学意义
一、补体的生物功能
(一)溶菌、溶细胞作用
补体通过MBL途径和旁路途径的激活导致靶细胞的溶解。这种补体介导的溶菌、溶细胞作用是在感染早期无抗体存在的情况下,是机体抵抗病原微生物感染的重要防御手段。
(二)调理作用
血清调理素(opospnin)与细菌及其他颗粒结合,可促进吞噬细胞的吞噬作用。补体活化的过程中产生的C3b、C4b和iC3b均是重要的调理素,它们可结合中性粒细胞或巨噬细胞表面相应补体受体,促进微生物与吞噬细胞的黏附,并被吞噬杀伤,这种依赖C3b、C4b和iC3b的吞噬作用可能是机体抵御全身性细菌或真菌感染的主要防御机制。
(三)引起炎症反应
补体活化过程中可产生多种活性片段,可以炎症反应的方式调动机体各种防御因素,达到消灭病原微生物之目的。这些裂解片段主要表现为激肽作用、过敏毒素样作用和趋化作用,造成炎症局部毛细血管扩张和组织细胞的损伤。
1.激肽样作用 C2a、C3a具有激肽样作用,可增高血管通透性,引起炎性渗出、水肿,称为补体激肽。补体激肽的作用不为抗组胺药物所抑制。
2.过敏毒素作用 C3a、C4a、C5a可使肥大细胞、嗜碱性粒细胞释放组胺,引起血管扩张、毛细血管通透性增加、平滑肌收缩和支气管痉挛等过敏症状,故称其为过敏毒素。
3.趋化作用 C3a、C5a是一种趋化因子,能吸引吞噬细胞向炎症部位聚集。当补体激活产生的C3a、C5a,以及炎症部位蛋白酶直接裂解C3、C5产生的C3a、C5a,向炎症外组织扩散时,形成由浓到稀的梯度,吞噬细胞根据C3a、C5a浓度的不同,由稀向浓的方向游走而到达炎症部位。吞噬细胞的这种聚集能更好地发挥吞噬、处理病原微生物的作用。
上述由补体介导的急性炎症反应在正常情况下仅发生于外来抗原侵入的局部,某些情况下,也可能对自身组织成分造成损伤而引起超敏反应。
二、补体的病理生理学意义
(一)机体抗感染防御的主要机制
在抗感染防御机制中,补体是固有免疫和适应性免疫间的桥梁。在生物进化过程中,补体作为相对独立的固有免疫防御机制,其出现远早于适应性免疫。种系发生学研究已证实,无脊椎动物和低等脊椎动物体内已能检出补体活性,且三条补体激活途径各具特点:①旁路途径是最早出现的C3活化途径;②MBL途径将原始的、凝集素介导的防御功能与补体相联系,进一步显示补体作为固有免疫防御机制的重要性;③补体经典途径在种系发生上出现最晚,它将非特异的补体与特异的适应性免疫相联系,成为体液免疫应答的重要效应机制。
病原微生物侵入机体后,在特异性抗体出现前数天内,机体有赖于固有免疫机制发挥抗感染效应。补体旁路途径或MBL途径通过识别微生物表面或其糖链组分而触发级联反应,所产生的裂解片段和复合物通过调理吞噬、炎症反应和溶解细菌而发挥抗感染作用。在特异性抗体产生之后,可通过经典途径触发C3活化,与旁路途径中C3正反馈环路协同作用,形成更为有效的抗感染防御机制。
(二)参与适应性免疫应答
补体活化产物、补体受体及补体调节蛋白可通过不同机制参与适应性免疫应答。例如:①补体介导的调理作用可促进抗原提呈细胞摄取和提呈抗原,启动适应性免疫应答;②与抗原结合的C3d可介导BCR与CR2/CD19/CD81复合物交联,促进B细胞活化;③补体调节蛋白CD55、CD46和CD59能介导细胞活化信号,参与T细胞活化;④滤泡树突状细胞(FDC)表面的CR1和CR2可将免疫复合物固定于生发中心,从而诱导和维持记忆性B细胞;⑤感染灶的过敏毒素可招募炎症细胞,促进抗原的清除;⑥补体可抑制高分子量免疫复合物形成,并促进已沉淀的复合物溶解,从而在免疫复合物处理中发挥重要作用等。
(三)补体系统与血液中其他级联反应系统的相互作用
补体系统与体内凝血系统、纤溶系统和激肽系统存在密切关系:某些疾病状态下(如弥散性血管内凝血、急性呼吸窘迫综合征等),四个系统的伴行活化具有重要病理生理意义。
补体的生物学意义远超出单纯非特异性防御的范畴,而涉及包括免疫应答在内的广泛生理功能:补体系统既是固有免疫防御一部分,又是特异性体液免疫应答的重要效应机制;补体可调节适应性免疫应答,并与体内其他蛋白系统相互联系。
(靳 静)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














