(一)体温调节中枢
目前一般认为体温的调节中枢位于视前区-下丘脑前部(preoptic anterior hypothalamic area,POAH),该区含有温度敏感神经元,对来自外周和深部温度信息起整合作用。将致热原或发热介质微量注射于POAH,可引起明显的发热反应,在发热时该部位可测到显著升高的发热介质。而另外一些部位,如中杏仁核(medial amydaloid mucleus,MAN)、腹中膈(ventral septal area,VAS)和弓状核,则对发热时的体温产生负向影响,刺激这些部位可使体温上升超过正常难以逾越的热限。因此,当前倾向于认为发热时的体温调节涉及到中枢神经系统的多个部位。
(二)致热原的作用部位
血液循环中EP为大分子蛋白(15~30k D),难以通过血脑屏障。关于EP是通过何途径将信号传入体温调节中枢,目前有以下3种观点。
1.通过下丘脑终板血管器 下丘脑的终板血管器(organum vasculosum laminae terminalis OVLT)位于第三脑室壁的视上隐窝处,紧邻视前区-下丘脑前部(POAH)。OVLT区的毛细血管为有孔毛细血管,通透性较高。EP可以通过这种有孔毛细血管作用于血管壁间隙中的巨噬细胞,后者释放发热介质(如IL-1),作用于OVLT神经元而发挥作用;或发热介质弥散通过室管膜血脑屏障的紧密连接,而直接作用于POAH的神经元(图6-2)。目前认为,通过下丘脑终板血管器这条途径可能是EP将信息传入体温中枢的主要通路。
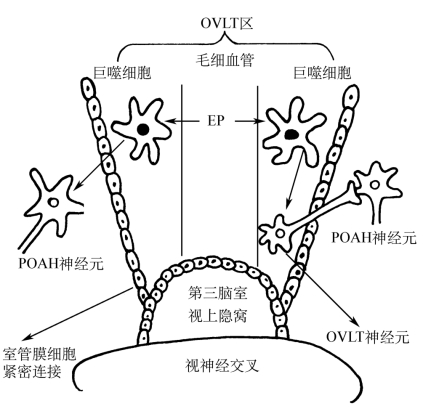
图6-2 OVLT在发热发病学中的作用
2.通过迷走神经 实验发现,向大鼠腹腔内注射内毒素,可引起发热。但是,如果先切断膈下迷走神经的传入纤维,再向大鼠腹腔内注入内毒素,则不再引起发热。提示发热信号可能通过迷走神经传入中枢。
3.通过血脑屏障 直接入脑,最近的研究表明,在血脑屏障的毛细血管床存在对某些EP的饱和转运机制。正常情况下,通过该机制转运的EP量很少,但在某些病理情况下,相应的EP可通过该途径入脑增多。
(三)发热的中枢调节介质
研究证明,无论EP是否通过血脑屏障或在给动物静脉内注射后,总要经过一段潜伏期才引起发热。因此很可能通过某种或多个中间环节,导致调定点上移,再通过调温反应而引起发热。与发热有关的中枢介质可分为两类:正调节介质和负调节介质。正调节介质为促进性介质,使调定点升高;而负调节介质为抑制性介质,使调定点不至于无限制升高。发热时体温上升的高度是体温正调节介质和负调节介质相互作用的结果。
1.正调节介质
(1)前列腺素E:前列腺素E(prostaglandin E,PGE)是EP引起发热的主要介质,该现行假说的最重要依据是①脑内(下丘脑)或ICV注射PGE引起发热;②LP静脉内注射或IFN的ICV注射引起发热时,脑脊液中PGE2明显增多;③下丘脑组织分别与LP、IFN或TNF在体外培育时,都使PGE2合成增多;④PGE合成抑制药如阿司匹林、布洛芬等对许多EP引起的发热有解热作用。
(2)环磷酸腺苷:脑内有较高浓度的环磷酸腺苷(cyclic adenosine monophosphate,c AMP),也有丰富的c AMP合成降解酶系。它又是脑内多种介质的信使和突触传递的重要介质,故当PGE作为发热介质有争议的同时,c AMP能否作为发热介质参与中枢机制,备受重视。十多年前,国外学者积累了一些资料,支持c AMP参与发热的中枢机制,主要是①把二丁酰c AMP给猫、兔、大鼠脑内注射,迅速引起发热;②内毒素引起发热时,检测到动物脑脊液中的c AMP明显升高,并与发热效应呈正相关;③家兔静脉内注射LP引起发热时,CSF中c AMP浓度明显增高,而环境高温引起的体温升高,不伴有脑脊液(CSF)中c AMP增多;④注射氨茶碱(磷酸二酯酶抑制物)在增高脑内c AMP浓度的同时,增强LP性发热;而注射烟酸(磷酸二酯酶激活物)则在降低c AMP浓度的同时,使LP性发热减弱。所以,许多学者认为c AMP可能是更接近于终末环节的发热介质。
(3)Na+/Ca2+比值:实验表明,用生理盐水替换人工脑脊液做动物脑室灌注时,引起了动物的体温明显上升,而加入CaCl2则可防止体温上升。用等渗蔗糖溶液灌注后下丘脑,体温无变化;若加入Na+,就引起体温上升;若加入Ca2+,则可降温。因此提出体温调定点受Na+/Ca2+比值所调控,强调Ca2+浓度是调定点的生理学基础,Na+/Ca2+比值上升可致调定点上移,并确定其敏感区位于后下丘脑。
(4)促肾上腺皮质激素释放激素:实验证明,给动物的脑内注入促肾上腺皮质激素释放激素(corticotrophin releasing hormone,CRH)可引起体温明显升高;IL-1和IL-6均能刺激下丘脑释放CRH;应用CRH受体拮抗药阻断或单克隆抗体中和CRH的作用,可完全抑制IL-1、IL-6的致热性。
(5)一氧化氮:研究显示,一氧化氮(nitric oxide,NO)与发热有关,其机制可能涉及三个方面①通过作用于POAH、OVLT等部位,介导发热时体温的上升;②通过刺激棕色脂肪组织的代谢活动导致产热增加;③可抑制发热时负调节介质的合成与释放。
2.负调节介质
(1)精氨酸加压素:精氨酸加压素(arginine vasopressin,AVP)是一种九肽神经递质,由下丘脑神经元合成,广泛分布于中枢神经系统,尤其是下丘脑的室上核、室旁核含量丰富。此外,在下丘脑终板血管器、体温负调节中枢的腹中膈(VSA)及中杏仁核(MAN)区域,AVP含量也比较丰富。动物实验发现,ET、IL-1等引起发热时,VSA及MAN内的AVP含量增多;如果把AVP注入VSA及MAN内,可抑制ET、IL-1及PGE性发热;预先用AVP抗血清灌注VSA,然后静脉注射ET,其发热程度明显高于单独注射ET。表明AVP为发热的负调节介质。
(2)α-促黑色素细胞激素:是由腺垂体分泌的13肽激素,在中枢神经系统分布广泛。研究发现,把α-促黑色素细胞激素(α-melanocyte-stimulating hormone,α-MSH)注入实验动物的脑室、VSA、POAH及静脉内,均可使内毒素性发热减弱,其中VSA是降热效应最强的部位;如脑内注入α-MSH抗血清后再注入IL-1,则后者的致热效应明显增强。α-MSH的解热效应极强,是迄今发现的解热效应最强的物质。
(3)脂皮质蛋白-1:是一种钙依赖性磷脂结合蛋白,主要分布于脑和肺等器官。研究发现,脂皮质蛋白-1(lipocortin-1)与发热的负调节有关。大鼠脑内注入脂皮质蛋白-1,可抑制IL-1β、IL-6等诱导的发热反应。
为了便于理解,用图6-3表示发热发生机制的基本环节。

图6-3 发热发病学基本环节
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















