细菌的毒力受遗传控制,是由毒力基因决定的。病原菌的毒力基因包括编码毒素、黏附因子、侵袭因子等一系列基因,存在于染色体、质粒、转座子或前噬菌体中。这些毒力基因常聚集成簇位于细菌基因组的某些特定区域,成为致病岛(pathogenicity islands,Pais)。
构成细菌毒力的物质主要包括侵袭力(invasiveness)和毒素(toxin)。
(一)侵袭力
致病菌突破宿主皮肤、黏膜生理屏障,进入机体并在体内定植、繁殖和扩散的能力,称为侵袭力。其物质基础包括与黏附、定植和侵袭性相关的物质,主要有黏附素、荚膜、侵袭性物质和生物被膜等。
1.黏附素(adhesin) 细菌进入宿主体内引起感染,通常首先需牢固黏附在宿主的呼吸道、消化道或泌尿生殖道等黏膜上皮细胞上,以免被呼吸道的纤毛运动、肠蠕动、尿液冲洗等生理活动所清除。黏附是绝大多数细菌感染过程的第一步。
细菌黏附至宿主细胞由黏附素介导,黏附素是细菌表面的蛋白质或多糖,具有使细菌黏附到宿主靶细胞的作用。黏附素有两类,即菌毛黏附素和非菌毛黏附素。菌毛黏附素是由细菌菌毛分泌并存在于菌毛顶端,如大肠埃希菌的菌毛黏附素等。非菌毛黏附素来自于细菌表面的其他组分,如革兰阴性菌的外膜蛋白、革兰阳性菌的膜磷壁酸等。细菌黏附素与宿主上皮细胞表面黏附素受体特异性结合,才能完成细菌的黏附作用。很多致病菌可表达多种黏附素,以识别不同的宿主细胞,并感染宿主的不同部位。
细菌的黏附作用与其致病性密切相关。实验证明,临床标本分离的肠产毒型大肠埃希菌大多具有菌毛,若口服肠产毒型大肠埃希菌的无菌毛菌株,则不引起腹泻。
2.荚膜 荚膜具有抗宿主吞噬细胞和抵抗体液中杀菌物质的作用,使致病菌能在宿主体内大量繁殖和扩散,产生病变。如将无荚膜的肺炎链球菌注射至小鼠腹腔,细菌易被小鼠吞噬细胞吞噬、杀灭,但若接种有荚膜的菌株,则细菌大量繁殖,小鼠常于注射后24h内死亡。另有A群链球菌的M蛋白、伤寒沙门菌的Vi抗原等微荚膜的功能与荚膜相同。
3.侵袭性物质
(1)侵袭素(invasin):少数定植在皮肤黏膜表面的致病菌仅引起局部感染,如白喉棒状杆菌、霍乱弧菌、幽门螺杆菌等,绝大多数致病菌常侵入宿主细胞组织内并扩散至其他的细胞、组织或全身而引起疾病。细菌的这种侵袭能力是由侵袭基因所编码产生的侵袭素所介导完成的。如志贺菌中140kD大质粒的inv基因编码的侵袭素,使其能侵入肠黏膜上皮细胞,以至进入黏膜固有层引起感染。
(2)侵袭性酶类:许多细菌可释放侵袭性胞外酶,有利于病原菌的抗吞噬作用并向周围组织扩散。如致病性葡萄球菌产生的凝固酶,能使血浆中的液态纤维蛋白原变成固态的纤维蛋白围绕在细菌表面,犹如荚膜可抵抗宿主吞噬细胞的吞噬作用。A群链球菌产生的透明质酸酶、链激酶和链道酶,能降解细胞间质透明质酸、溶解纤维蛋白、液化脓液中高黏度的DNA等,促进致病菌及毒性产物在组织中扩散。
4.细菌生物膜(bacterial biofilm,BBF) 是细菌在生长过程中附着于物体表面而形成的由细菌细胞及其分泌的胞外多聚物(主要为胞外多糖)等所组成的膜状多细菌复合体。细菌生物膜不是细菌的简单堆积,生物膜内不同种类细菌之间相互作用并借信号分子相互交流,根据周围环境的变化而调整菌群密度、代谢及生长速度等。生物膜是细菌适应生存环境而形成的一种保护性存在形式,生物膜能帮助细菌抵御宿主免疫系统的攻击,并能极大地提高细菌对抗生素的耐受能力(10~1 000倍)。约65%以上的细菌感染都与生物膜的形成有关,当细菌黏附在黏膜上皮细胞以及植入人体内的各种医疗材料(人工关节、气管插管、导尿管等)表面,都易形成生物膜,目前应用的抗菌药物不能彻底清除细菌生物膜,常在临床上形成难治性感染。
(二)毒素
细菌毒素按其来源、性质和作用等不同,可分为外毒素(exotoxin)和内毒素(endotoxin)两种。
1.外毒素
(1)来源:主要由革兰阳性菌和少数革兰阴性菌在代谢过程中合成及分泌的毒性物质。革兰阳性菌中的破伤风梭菌、肉毒梭菌、白喉棒状杆菌,以及革兰阴性菌中的痢疾志贺菌、霍乱弧菌等都能产生外毒素。大多数外毒素是在菌细胞内合成后分泌至细胞外,也有的外毒素存在于菌体内,待菌裂解后才释放出来,如痢疾志贺菌和肠产毒型大肠埃希菌。
(2)结构:多数外毒素的分子结构为A-B模式,即由A和B两种亚单位组成。A亚单位是外毒素活性部分,决定其毒性效应。B亚单位无毒,能与宿主靶细胞表面的特异受体结合,介导A亚单位进入靶细胞。A或B亚单位单独对宿主无致病作用,因而外毒素分子的完整性是致病的必要条件。
(3)化学组成及性质:外毒素的化学本质是蛋白质,易被蛋白酶分解破坏,绝大多数不耐热。如白喉毒素在58~60℃经1~2h、破伤风痉挛毒素在60℃经20min可被破坏,但葡萄球菌肠毒素是例外,能耐100℃30min。
大多外毒素具有较强的抗原性。经0.3%~0.4%甲醛处理后,可脱去毒性,但仍保留免疫原性而成为类毒素(toxoid)。类毒素注入机体后,可刺激机体产生具有中和游离外毒素毒性作用的抗毒素抗体。类毒素和抗毒素在防治外毒素性疾病中具有重要的应用价值,前者主要用于人工主动免疫,后者常用于治疗和紧急预防相应疾病。
(4)致病特点:外毒素的毒性作用强,极少量的外毒素即可使易感动物死亡。如1mg肉毒毒素能杀死2亿只小鼠,对人的最低致死量为0.1μg。不同细菌产生的外毒素对宿主组织器官具有选择性毒性作用,引起特殊的临床病变。外毒素一旦与组织细胞结合,很难解离,不能被抗毒素中和。外毒素按其作用机制和所致临床病理特征,可分为神经毒素、细胞毒素、肠毒素和溶细胞毒素四大类,见表6-2。
表6-2 外毒素常见种类及作用

2.内毒素
(1)来源:为革兰阴性菌细胞壁裂解后释放出来的脂多糖(lipopolysaccharids,LPS)。内毒素不能由活菌释放到菌体外,只有当细菌死亡裂解后才能释放出来。
(2)化学组成及性质:化学组成为脂多糖,位于革兰阴性菌细胞壁外层结构,由O特异性多糖、非特异核心多糖和脂质A三部分组成,见图6-1。内毒素耐热,需加热至160℃经2~4h或用强碱、强酸或强氧化剂加温煮沸30min才能灭活。内毒素抗原性很弱,不能用甲醛脱毒成类毒素。内毒素注射机体可产生相应抗体,但中和作用较弱。
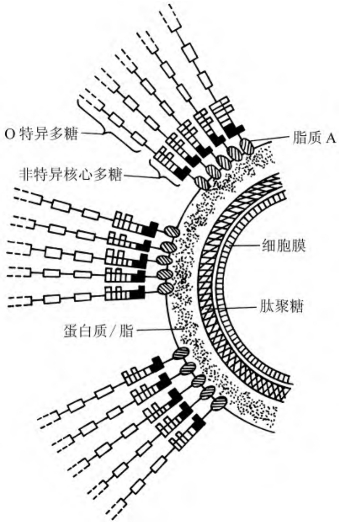
图6-1 内毒素结构
(3)致病特点:脂质A是内毒素的主要毒性成分。不同革兰阴性菌的脂质A结构虽有差异,但基本相似,因此,不同革兰阴性菌感染时,由内毒素引起的毒性作用大致相同。主要临床症状有①发热反应。极微量(1~5ng/kg)内毒素就能引起人体体温上升,持续约4h后恢复。其机制是内毒素作用于巨噬细胞等,使之产生具有内源性致热原的细胞因子IL-1、IL-6和TNF-α等,作用于宿主丘脑下部体温调节中枢,促使体温升高发热。②白细胞反应。LPS可大量损伤中性粒细胞,受损细胞黏附于毛细血管壁,而使血循环中的中性粒细胞数减少。1~ 2h后,LPS诱生的中性粒细胞释放因子刺激骨髓释放中性粒细胞进入血流,使外周血中性粒细胞数量骤增。但伤寒沙门菌内毒素例外,始终使患者外周血中性粒细胞数低于正常,其机制尚不清楚。③内毒素血症与内毒素休克。血液中或感染病灶内细菌释放的大量内毒素入血后,可作用于巨噬细胞、中性粒细胞、内皮细胞、补体系统、凝血系统等,诱生过量的TNF-α、IL-1、IL-6、组胺、5-羟色胺、激肽等生物活性物质,导致小血管收缩和舒张功能紊乱而造成微循环障碍,表现为微循环衰竭和低血压、组织器官的毛细血管灌注不足、缺氧、酸中毒等,进而发展为内毒素休克。④弥散性血管内凝血(DIC),是指微血栓广泛沉着于小血管中,是内毒素休克进一步发展的严重并发症,可见于多种疾病。发生机制是当发生严重的革兰阴性菌感染时,高浓度的内毒素可直接或间接活化凝血系统,大量消耗或减少凝血因子;亦可继发性活化纤溶系统,加剧凝血功能障碍,引起广泛出血和渗血,严重者可致死。
细菌外毒素与内毒素的主要区别见表6-3。
表6-3 外毒素与内毒素的主要区别

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














