近年来,细胞生物学发展十分迅速,尤其在与实际结合方面获得了可观的成就。用一般培养法获得细胞的产量是有限的,用新的超产培养技术,可获大量细胞。这种培养技术包括微载体培养法、微囊培养法和中空纤维培养法等。这些培养技术日益增多并受到普遍重视。
其中,微载体是指直径在60~250μm,适用于贴壁依赖型细胞在其表面贴壁生长的微珠。微载体培养技术具有显著的优点:①兼具单层培养和悬浮培养的优势,且是均相培养;②培养条件(温度、pH、CO2浓度、葡萄糖浓度等)容易控制,细胞所处环境均一;③增加了培养面积;④培养过程系统化、自动化,不易被污染。微载体材料的本体性能、表面特性及微载体粒径大小等是影响细胞黏附、生长的重要因素。微载体培养技术已广泛应用于动物疫苗及多种基因工程、生物活性医用蛋白的大规模生产。
一、微载体培养技术的基础
单层细胞可以在直径约150μm(90~300μm)的葡聚糖、塑料、玻璃、纤维素、明胶或胶原制备的微珠上生长。在微珠上培养的单层细胞可以提供最大的表面积与培养液量比率,根据微珠的大小和密度可达到90 000 cm2/L,并且还有一个优点,即细胞可以如同悬浮培养一样处理。最早使用的是以离子交换凝胶(DEAE-Sephadex A-50)作为载体,轻微搅动可悬浮在培养基中,可增加细胞附着的面积,达到大量培养细胞的目的。后来,根据细胞附着生长的特点,对微载体进行了改造,使其带有电荷或其他介质,更有利于细胞附着和生长。这一方法不仅可以用于大规模培养,亦可用于常规量培养。
(一)微载体材料
制备微载体的材料按其来源可分为两大类,即人工合成聚合物和天然聚合物及其衍生物,早期的微载体多采用人工合成聚合物,近年来,越来越多的研究者尝试天然聚合物及其衍生物来制备微载体,其功能适应性、组织相容性、理化性能、生物降解性、造价等方面均优于人工合成材料。Ven Wezel于1967年最先使用微载体系统进行动物细胞大规模培养,自其研制的DEAE(2-二氯乙氨基氯乙烷)-Sephadex微载体问世以来,贴壁依赖型动物细胞的微载体培养技术近年来得到迅速发展,国际市场已有十几种商品化的微载体出售,包括液体微载体、大孔明胶微载体、聚苯乙烯微载体、PHEMA微载体、甲壳质微载体、聚氨酯泡沫微载体、藻酸盐凝胶微载体及磁性微载体等(表31-1)。制作这些微载体所用材料大致有葡聚糖、塑料、明胶、玻璃、纤维素五大类。
1.纤维素 纤维素是以1,4-葡萄糖苷键连接的、由β-D-吡喃葡萄糖元组成的一种均聚多糖。它被作为制备细胞培养微载体的材料而得到广泛的研究。商品化的微载体,如大孔的Cellsnow和Cytopore,机械强度高,可回收使用。
2.明胶和胶原 胶原广泛存在于动物的各种器官中,约占蛋白质总量的1/4,是由动物骨骼、筋腱经浸煮、水解等多道工序提炼而来的。它是一类可用于引导组织再生的生物材料,具有无抗原性,生物相容性好,可参与组织愈合过程。在止血、促进伤口愈合、治疗烧伤创面、替代骨移植、诱导组织再生方面得到广泛应用。许多研究表明,变性胶原多肽一级结构的某些特定位点可与培养液中纤黏素结合,形成胶原-纤黏素的复合物,有助于细胞的黏附与生长。这也是胶原在制备微载体方面备受青睐的原因。在动物细胞培养中得到广泛应用的Cytodex3和多孔Microsphere就是以胶原为基材制备的,也有将胶原用于微载体表面包覆材料的报道,如Hillegas等将聚苯乙烯微球表面包覆一层胶原后表现出很好的效果。明胶是胶原蛋白经温和、不可逆降解的产物,生物相容性好,价格相对低廉。明胶中的角蛋白、弹性硬蛋白、黑素和软骨素等的存在是促进细胞黏附生长的一个重要因素。许多由其他基质制成的微载体,如Cytodex 3、CT23等,也常包裹一层明胶以提高载体的生物相容性。已经商品化的明胶微载体有Gelibead、Ventregel及大孔的Cultispher微载体。
3.微载体的改性 微载体必须具有易于细胞黏附的表面,因而在制作微载体时必须考虑其表面亲水性及表面电荷特性。借助于表面改性可制得合适的细胞培养微载体。文献中报道的微载体表面改性方法有化学改性法、等离子体法和表面修饰法等。
(1)化学改性法:材料的化学改性法是指通过共聚、接枝等方法来改变材料的组成,同时获得具有良好细胞亲和性表面的方法。如,PHEMA亲水性太强,而一般认为细胞与材料之间的黏附依赖于蛋白质的介导作用,细胞膜上的受体能特异性地识别材料上黏附的蛋白质,因而材料必须具有一定的疏水性以吸附蛋白质。Kiremitci等利用MMA的疏水性,使HEMA与适量MMA共聚,降低了最终微载体的表面可湿性。BHK细胞培养实验表明,共聚改性后的微载体更有利于细胞的黏附。
(2)等离子体改性法:与化学改性方法相比,等离子体法能更容易地在微载体表面引入特定的官能团或其他高分子链。Denkbas等用3-Aminopropyltriethoxysilane对PDMS-OH微球进行等离子体处理,增加了PDMS-OH的表面可湿性(降低了接触角)。BHK细胞培养实验发现,未经等离子体处理的微载体上没有细胞附着,而处理后的微载体上细胞的附着率达60%,与当时已经商品化的微载体上细胞的附着率相当。
(3)表面修饰法:一般生物材料因表面缺乏细胞识别位点而影响细胞的黏附,相容性好的聚合物微载体通过吸附培养介质中的细胞黏附分子而介导细胞的黏附。为提高微载体的生物相容性,人们往往在微载体表面固定一些贴壁因子、多聚赖氨酸、胶原蛋白等,以提高细胞的黏附性。徐涛等用环氧氯丙烷活化琼脂微载体,再用己二胺将其表面氨基化,从而得到表面修饰的琼脂微载体。通过在微载体上培养肝细胞发现,修饰的微载体比未修饰的微载体更易使肝细胞在其表面附着。Jacobson等通过使聚苯乙烯微载体磺酸化使微载体表面呈负电性,或和聚乙烯亚胺以共价键结合使微载体表面呈负电性,或者利用碳化二亚胺将胶原固定在聚苯乙烯微载体上,得到了一系列可以结合细胞黏附蛋白、适合培养不同类型细胞的微载体。通过细胞培养实验发现,Hela-S3细胞在带正电荷和包裹了胶原的聚苯乙烯微载体上生长得更好,而内皮细胞则在表面呈负电性的微载体上长得最好。
表31-1 可使用的商品微载体
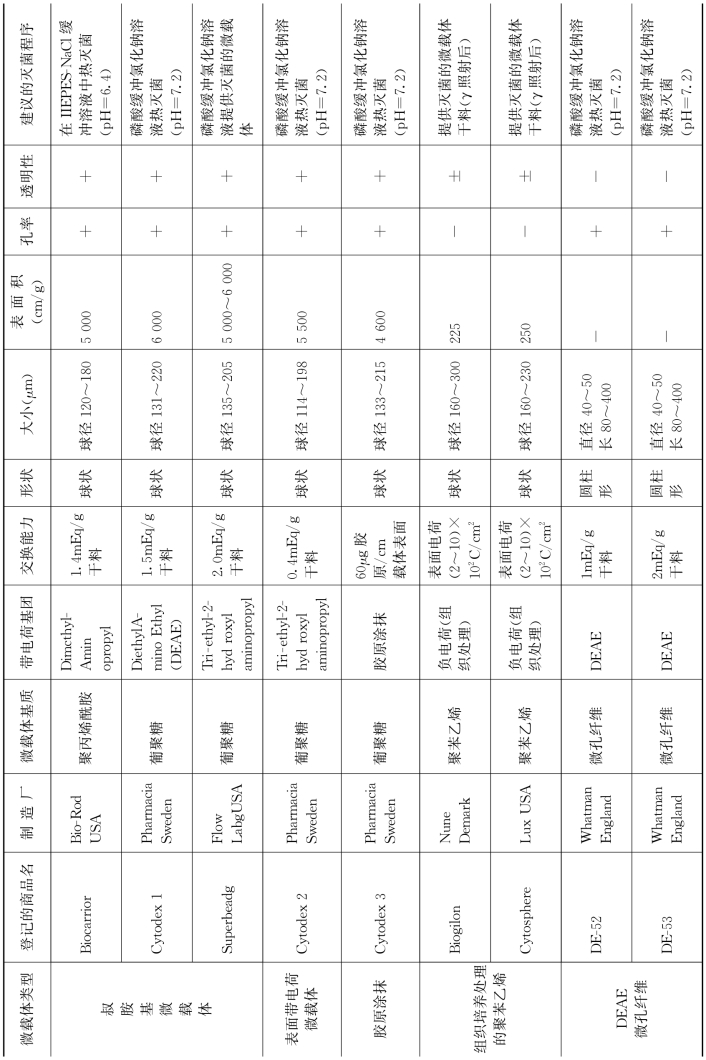
(二)细胞在微载体表面的黏附、铺展和生长
细胞在固体基质表面黏附后才能进一步的铺展和生长,黏附有2种模式,即“负电荷-桥-负电荷”和“正电荷-负电荷”。这两类相互作用模式存在于每一个载体,只是不同情况下,某一种占优势。在正常生理pH下,真核细胞表面带有不均匀的负电荷,而培养基质(塑料、玻璃)也带有负电荷,细胞显然无法黏附到微载体上,但是,在此过程中引入“负电荷-桥-负电荷”的模式后,就可行了,在细胞和微载体充当桥梁作用的主要有2种因素。一是二价阳离子;二是吸附糖蛋白。但是也有另一类微载体表面带有正电荷,可以有“正电荷-负电荷”的作用模式,不需要桥的介导。在细胞培养时,微载体应具有合适的电荷密度,电荷密度决定了细胞和微载体相互作用的强弱,如电荷密度过高,细胞可以黏附到微载体上,但不能生长,电荷密度过低则细胞很容易从微载体脱落。
细胞、微载体和环境是影响细胞在微载体表面生长三大因素。细胞的类型、形态,微载体的表面状态、吸附的分子和离子,培养的环境包括培养基、温度、pH及代谢物等。
(三)培养的操作步骤
微载体细胞培养的基本过程如下:①按照所需取最终培养液量的1/3,以2~3g/L悬浮微载体微珠。②用胰酶消化细胞并计数,以正常接种浓度的3~5倍将细胞接种到微珠悬浮液中。③以每分钟10~25转将培养物搅拌8h。④加入培养液以达到0.7~1g/L的微珠浓度指定的最终容量。⑤增加搅拌速度至每分钟60转。⑥如果pH下降,关闭搅拌器培养5min,使微珠沉降下来,然后更换1/2~2/3的培养液。⑦收集细胞时,先将培养液取出,再通过沉降法洗涤细胞,然后用胰蛋白酶EDTA消化微珠,离心后,洗出细胞。⑧在连续进行微载体培养时,可以不必把细胞从微载体上分离下来,可将带有细胞的微载体和新的微载体混合进行培养,细胞能移动到新载体上。如果进行其他实验或需要分离细胞进行传代培养时,与常规培养相同,先用EDTA+胰蛋白酶溶液作用使细胞脱离微载体表面。细胞脱离微载体后,可用自然沉降法,即在室温下静置5min,微载体先沉到底部,细胞大部分仍在上清,然后离心上清可得到细胞。⑨在微珠上进行细胞计数可能是困难的,因此,细胞的生长率需通过确定DNA或蛋白质进行检测,如果采用非蛋白醋酸微珠,或脱氢酶活化微珠,可用MTT分析微珠样本。
二、应用微载体技术规模化培养组织工程种子细胞
组织工程是应用工程科学和生命科学的原理,开发用于恢复、维持及提高受损伤组织和器官功能的生物学替代物。其基本方法是:将体外培养的高浓度的功能相关的活细胞种植于天然的或人工合成的具有良好生物相容性和可降解的聚合物支架上,形成细胞支架复合物,然后将这复合物移植到动物体内组织缺损部位,最后形成一个与机体本身在组织学和生化组成上完全相同的组织,从而完成组织缺损的修复与再造。组织工程治疗模式属于新兴的基于细胞的治疗模式。组织工程技术的产生源于早期的细胞培养工作,它不仅需要合适的种子细胞,还需要合适的载体来携带种子细胞。培养载体上的细胞在新的血管形成之前通过扩散作用交换营养物质,但由于营养物质和代谢废物的扩散限制,即使体积适中的载体也会产生中心细胞坏死的现象。而多孔细胞微载体与常用的三维支架材料相比,对营养物质和代谢废物的扩散限制较小,更利于新血管的形成。并且,这些微球载体可通过注射的方式进入机体受损部位,无需移植手术,操作更便捷,使患者减少痛苦和节省费用。
用于组织工程的微载体必须具有良好的生物相容性和完全可降解性,并且降解产物对细胞无毒。Fink等将软骨细胞培养在一种可降解的微载体上,待细胞生长一段时间开始团聚时,将微载体连同细胞直接注射入体内。Senuma等用聚乳酸制备了可注射的带孔微载体,实验结果预示了该微载体在组织工程上的应用潜力。Domb等将壳聚糖微载体培养细胞用于组织工程。目前关于组织工程用微载体的报道不多,但鉴于微载体在培养细胞方面的种种优越性,可以预见,随着材料科学和微载体制作工艺的不断发展及对材料-细胞相互作用研究的不断深入,微载体在组织工程的应用必将展示出喜人的前景。
应用微载体细胞培养技术既有利于细胞增殖,同时又能维持载体上细胞分泌物的合成。目前国内外科研人员在控制pH、氧和营养供应及机械转动的条件下,已经应用各种类型微载体包括玻璃微载体、带电荷的分子(右旋糖酐、琼脂糖、Ⅰ型胶原网),对80种以上的贴壁细胞成功进行了大规模扩增。近年来,针对组织工程种子细胞的大规模扩增研究进展较快,尤其在骨髓基质细胞、软骨细胞、肝细胞等研究领域已经取得阶段性成果,现简要回顾如下。
(一)骨髓基质细胞、骨肉瘤细胞
Tang等研究表明,应用cytodex 1微载体培养兔成骨细胞,微载体细胞悬浮系统有利于成骨细胞增生,并增加碱性磷酸酶和其他细胞外基质的分泌。Granet选择两种类型的微载体(cytodex3、biosilon)在旋转生物反应器内,进行了骨肉瘤细胞(ROS17/2.8)大规模培养研究。实验结果表明,旋转生物反应器能够为细胞体外培养提供适宜的环境条件,骨肉瘤细胞在微载体三维培养系统内既可以增殖,亦可以分化。而两种微载体细胞培养的分析结果显示,biosilon较cytodex 3微载体更有利于细胞大规模体外培养。为了提高骨髓基质细胞体外大规模培养的效率,Qiu研制了表面密度为(0.8~1.0)g/cm3、具有显著生物活性的陶瓷中空微载体。应用这种微载体分别将兔骨髓基质细胞和骨肉瘤细胞(ROS17/2.8)在旋转生物反应器内进行细胞大规模培养。研究结果表明,在旋转容器中这些细胞能够贴附到微载体上并形成三维聚集体,在三维聚集体内,可以观察到有细胞外基质形成。
(二)软骨细胞
软骨组织工程研究是组织工程最易取得突破的领域,由于常规单层软骨细胞培养存在细胞扩增数量有限及去分化等现象,因此,近年来科研人员对应用微载体技术规模化生产软骨细胞进行了深入研究。Freed等研究发现,牛和人软骨细胞种植到Ⅰ型胶原(cytodex 3)微载体上,能够快速增生,细胞数量增加一倍的时间较单层培养细胞明显缩短,表明微载体悬浮培养系统有利于增加软骨细胞增殖率,进而表明,应用微载体悬浮培养系统能够使有限的软骨细胞在较短的时间内获得大量扩增。Frondoza从膝关节手术中取患者关节软骨。通过酶消化法获取软骨细胞,进行3个月的软骨细胞单层系列传代培养后,将回收的5代细胞作为第6代细胞重新在微载体悬浮培养系统中进行体外大规模培养。在研究中,作者选择应用Ⅰ型胶原微载体等4种微载体,在搅拌式生物反应器内进行软骨细胞体外大规模培养实验。结果显示,在4种微载体中,Ⅰ型胶原微载体最有利于软骨细胞增殖和表型表达。应用Ⅰ型胶原微载体培养软骨细胞,细胞数量在2周内至少可以增加20倍,每2~3d细胞数量增加1倍。通过免疫细胞化学染色,发现在微载体上培养的软骨细胞逐渐改变了其“成纤维样细胞”外观,重新呈现软骨细胞原始表型的特征。进而表明,Ⅰ型胶原微载体细胞悬液培养系统具有支持细胞生长、提高软骨细胞表型表达的作用。军事医学科学院基础医学研究所应用旋转生物反应器、cytodex 3等微载体进行了软骨细胞体外大规模扩增研究,并取得了满意的实验结果,软骨细胞经过微载体培养后,其细胞数量可以增加到20倍以上。
(三)肝细胞
在组织工程研究领域,肝脏是所有脏器再造领域研究最早的脏器之一。自20世纪90年代初期,国外科研人员开展了大量的肝细胞大规模培养研究。1995年,Khaoustov在旋转生物反应器内应用微载体技术进行了肝细胞三维培养的初步研究,并获得了大量有益的实验数据。在此基础上,BorisYoffe从1998年开始进行了系统的肝细胞微载体大规模培养研究。在研究中,利用旋转生物反应器成功建立了小鼠肝细胞的三维培养模型,并正在开展将体外大规模培养的肝细胞向小鼠脾脏回植的实验研究,以观察外源性肝细胞在异体小鼠体内的生长、增殖状况,以及引起异体排斥的情况。王英杰在搅拌式反应器内开展了微载体规模化培养人肝细胞的实验研究,选用的微载体为cytodex 3。实验结果表明,通过微载体扩增而获得的肝细胞具有细胞数量多、密度大和活性好的特点,适宜作为体外生物人工肝支持系统、肝细胞移植等应用领域的可靠细胞来源。徐小平应用cytodex 3微载体成功在体外高密度培养了人肝细胞系CL-5。此外,朱薇应用cytodex 3培养大鼠肝细胞获得成功,并掌握了一种简单获取大量高活性肝细胞的培养方法。
(四)成纤维细胞
Tan等探讨了皮肤Fb在微载体生物反应器中批式和间歇换液培养的方法,将Fb接种到含有5mg/ml微载体浓度的1.5L CelliGen生物反应器中,发现该方法可明显提高细胞量,增加生长密度和扩增倍数,另外还能有效控制O2和pH,使细胞培养环境能维持均一和稳定,消除副产物的毒性反应。因此利用生物反应器培养Fb是制备组织工程皮肤种子细胞有效的方法,也是未来努力的方向。Lin等采用猪明胶微载体cultispher G 1g加入100ml培养基中在生物反应器cellspin中培养成纤维细胞,扩增量比传统的二维培养提高了5.3倍,采用同样的方法也成功扩增了角质形成细和黑素细胞。
除骨髓基质细胞、软骨细胞、肝细胞、成纤维细胞外,国内外研究人员还对诸多其他种类的种子细胞进行了微载体规模化培养研究,也相继取得了较好的实验结果。
三、微载体在生物反应器系统的应用
采用微载体技术进行种子细胞大规模培养,细胞扩增的效率受到诸多因素的影响和限制,其中主要的限制性因素包括:种子细胞对剪切力的敏感性、氧的传递及传代和扩大培养等。而研制的各种类型生物反应器系统可针对上述限制性因素,为微载体细胞培养与扩增提供低剪切力、高氧传递效率、易于细胞传代等适宜的外部环境。因此,应用生物反应器系统进行微载体细胞大规模扩增具有明显优势,目前国外相继研制了数种适合进行微载体大规模细胞培养的生物反应器系统,组织工程用生物反应器主要包括搅拌式生物反应器系统、旋转式生物反应器系统、灌注式生物反应器系统等。
(一)搅拌式生物反应器系统
生物反应器系统有利于微载体在培养液中均一分布并可精确控制换液频率。其中,最简单的生物反应器系统即为搅拌式生物反应器系统,该系统在旋转培养瓶的瓶底放置了磁力搅拌棒,通过磁力搅拌,使微载体在培养基内基本上达到均匀分布。搅拌式生物反应器系统在微载体细胞大规模扩增研究领域已有较长的研究历史,但因该细胞培养系统容易产生过大的剪切力,从而限制了其应用范围。尽管如此,由于该系统具有简单、实用及价格低廉等特点,国内外仍有不少应用该系统进行组织工程种子细胞大规模扩增成功的研究报道。Werner A成功地在该系统内进行了肝细胞大规模扩增的研究。
(二)灌注式生物反应器系统
尽管搅拌式生物反应器系统有很多优点,但机械搅拌会带来不必要的剪切力。为消除这种不利因素,国外常采用灌注式生物反应器系统来进行微载体大规模细胞培养研究。灌注培养是目前细胞工程领域研究热点之一。它的特点是不断地加入新鲜培养基,以及不断地抽走含细胞代谢物的消耗培养基,使细胞在一个相对稳定的生长环境内增殖,既省时省力,又减少了细胞被污染的机会,而且可以提高细胞密度10倍以上。目前,采用灌注培养的细胞密度已达到100× 106个/ml,而人体细胞密度是(2~3)×109个/ml,因而应用该系统进行微载体大规模扩增仍有巨大的开发潜力。以往灌注式生物反应器主要用于细胞工程领域的工程化细胞株的大规模培养。近年来,随着国内外组织工程研究的不断深入,已经有研究人员用该系统培养软骨细胞与支架材料的复合体。研究结果表明,软骨细胞与支架培养复合体在灌注培养系统内培养50d,再造软骨的组织学和力学特征均与天然软骨相似。尽管目前应用该系统进行组织工程种子细胞的大规模扩增研究尚少,但随着研究的不断深入,该系统在组织工程种子细胞微载体扩增研究领域具有广阔的应用前景。
(三)旋转生物反应器
近年来,旋转生物反应器系统(RCCS)已经成为应用微载体技术进行细胞大规模扩增的一种较常用的细胞培养系统。该系统是基于美国航空航天局为模拟空间微重力效应而设计的一种生物反应器。RCCS既可以用于微载体大规模细胞培养,又能在其内培育细胞与支架形成的三维空间复合体。将细胞种植到微载体上以后,将其移入RCCS圆柱状的培养容器内,并加满培养液。整个容器由电机驱动沿水平轴旋转。细胞微载体颗粒在水平轴内建立均质的液体悬浮轨道,并随容器一起旋转且不与容器壁和他物相撞。由于系统无推进器、空气升液器、气泡或搅拌器,使破坏性应力减到最小。在RCCS中的细胞通过膜式气体交换器来吸氧和排出CO2。其优点有剪切力小,可以模拟微重力,培养细胞量大,空间利用度高,可控性强。因该系统能够提供破坏性应力很低的细胞生存环境,因此,在近年来,已经广泛应用于微载体系统细胞大规模培养研究中,至今近百种组织细胞均在该系统内成功进行了大规模扩增。
四、展 望
在过去的30年里,微载体系统细胞大规模培养技术主要用于生产一些具有重要实用和商业价值的产品,如疫苗、基因工程产品等,而且已积累了大量实践经验和关键实验数据。从现有微载体的特点及其实际应用情况来看,开发生长性能优良的新型廉价微载体是今后细胞培养微载体的发展方向,大孔微载体因其具有支持细胞三维生长的独特优势将越来越发挥其独到作用,而用天然生物可降解材料制备的微载体有望在组织工程领域得到应用。近年来,在软骨细胞、Fb等组织工程种子大规模扩增研究领域已取得快速发展。预期在不远的将来,随着科研人员逐步完善组织工程种子细胞大规模扩增的关键技术,再造的各种组织工程化人体组织或器官将不断地应用到临床实践中去。
(雷 霞)
参 考 文 献
[1]过琴媛,王辉,沈心亮.微载体培养动物细胞技术的研究进展.微生物学免疫学进展,2007,35(1):73
[2]单建林,许建中.生物反应器在组织工程学中的应用及其前景.中国临床康复,2004,8(26):5620
[3]段小军,杨柳.生物反应器在组织工程中的应用.北京生物医学工程,2005,24(5):390
[4]R.I.弗雷谢尼.动物细胞培养―基本技术指南.章静波,徐存栓,等,译.第4版.北京:科学出版社,2004:480-511
[5]王常勇.采用微载体技术大规模培养组织工程种子细胞.生物医学工程与临床,2002,6(1):51-54
[6]张凤菊,刘超,成国祥.聚合物微载体及其在细胞培养方面的应用.北京生物医学工程,2003,22(3):223
[7]Prenosil JE,Kinooka M.Computer controlled bioreactor for large-scale p roduction of cultured skin grafts.Ann N Y Acad Sci,1999,875:386
[8]Jin Yu,Jing Hafner,Galya Dragiava et al.High yields of autologous living dermal equivalents using porcrine gelatim merobeads as microcarriers for autologous fibroblasts.Cell transplat,2006,15:445
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














