一、氟 尿 嘧 啶
氟尿嘧啶(5-FU)目前仍然是使用最广泛的抗肿瘤药物,用于多种实体肿瘤,如结直肠癌、乳腺癌等的药物治疗。5-FU可使部分患者得到显效治疗,但常伴随着严重的胃肠道毒性作用和血液毒性反应,甚至导致治疗失败。5-FU在体内大部分经过二氢嘧啶脱氢酶(DPD)代谢失活,少部分是经过胸苷磷酸化酶(TP)代谢成活性代谢产物2′-脱氧-氟尿嘧啶磷酸盐(2′-dFUMP)。5-FU药理作用主要依赖2′-dFUMP通过抑制嘧啶合成酶(TS)干扰叶酸代谢抑制DNA合成(图12-1)。有证据显示,5-FU自FU投入使用以来,有些肿瘤患者5-FU的疗效低于预期,而与此同时其毒性反应却很严重。遗传因素可能是导致这种个体差异的主要原因之一。这些遗传因素涉及包括代谢酶DPD和药物靶标蛋白TS以及叶酸代谢的关键酶亚甲基四氢叶酸还原酶(MTHFR)在内基因变异和酶表达量的改变等因素。除5-FU外,氟化嘧啶类药物如卡培他滨、替加氟、卡莫氟、氟尿苷、脱氧氟尿苷等,是5-FU的前药,需在体内转化成5-FU起抗肿瘤作用,因此上述遗传因素可能也涉及这类药物的疗效和毒性的改变。

图12-1 5-FU及其前药的代谢-效应通路 注.TP.胸苷磷酸化酶;5-FU.5-氟尿嘧啶;DHFU.二轻氟尿嘧啶;DPD.二轻嘧啶脱氢酶;FUDR.5-脱氧尿苷;TK.胸苷激酶;TS.胸苷酸合酶;dTMP.脱氧胸苷一磷酸;dTDP.脱氧胸苷二磷酸;dUMP.脱氧尿苷一磷酸;dUTP.脱氧胸苷三磷酸;DHFR.二氢叶酸还原酶;MTHFR.亚甲基四氢叶酸还原酶;SHMT.丝氨酸羟甲基转移酶;dUTPase.脱氧尿苷焦磷酸酶;MTHF.亚甲基四氢叶酸;THF.四氢叶酸;DHF.二氢叶酸;SHMT.丝氨酸羟甲基转移酶。
DPD是5-FU催化代谢限速酶,85%的5-FU经其代谢成非活性代谢产物。因此,遗传导致的酶活性不足,可导致代谢改变和严重药物毒性反应(图12-2)。DPD编码基因是DPYD,在人1p22染色体上,长950bp,有23个外显子。至今已发现超过30种SNPs和缺失突变,大多数对DPD酶功能无影响,少部分使酶活性降低,甚至导致酶功能缺失。最常见的可导致严重毒性反应的突变是14外显子1986位A→G改变(DPYD*2A等位基因),其编码的产物为无活性的酶。酶活性严重降低,导致氟尿嘧啶在体内蓄积,引起严重黏膜炎、粒细胞减少症、神经系统症状甚至死亡。3%的个体中存在这种变异。此外,还有VS11 + 1G>T、731A>C(E244V)、1651G>A、1601G>A(DPYD*4)、1679T>G(DPYD*13)、2846A>T等突变。这些突变均可导致DPD酶活性降低。DPD酶活性降低的发生率人种之间存在差异。与白种人比较,东方人DPD酶活性降低发生率较高,非洲人发生率较低。大量研究表明,DPD酶活性降低的患者中有40%携带DPYD*2A基因突变,其中有60%的患者5-FU治疗后发生4级严重的粒细胞减少血液毒性。DPD酶活性正常患者经5-FU治疗后只有10%发生严重毒性反应。研究表明,并不是所有DPD酶活性低的患者都携带上述SNP或缺失突变。极少数患者酶活性降低可能与DPYD启动子部分序列超甲基化相关。在健康人群中没有发现超甲基化现象,这种超甲基化可能参与DPD酶活性的调控。因此,DPD基因分型可能是一种预测5-FU治疗导致致命毒性反应发生概率的有效遗传分析手段,为临床医生制定药物治疗方案提供参考。
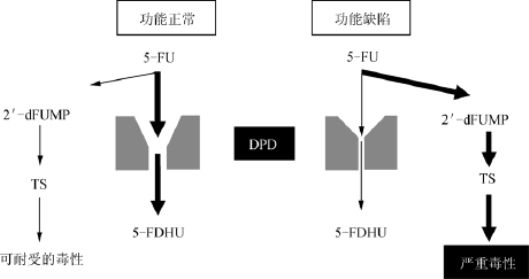
图12-2 5-FU 毒性机制依赖于DPD缺陷 注.在DPD正常的表现(左边),稳定剂量的5-FU被代谢为无活性的5-FDHU,小部分代谢为2′-dFUMP,它可以抑制TS。如果代谢通路DPD损伤,大部分5-FU转化成2′-dFUMP,导致TS抑制物增多,严重损伤正常组织(右边)。DPD.二氢嘧啶脱氧酶;5-FDHU.5-氟脱氧尿苷;2′-dFUMP.2’-脱氧-5-氟脲糖苷磷酸盐;TS.嘧啶合成酶
由于胃肠道和肝脏DPD活性高,5-FU的口服生物利用度较低。因此,5-FU与DPD抑制药(如乙炔尿嘧啶)或5-FU前药(如卡培他滨、替加氟、卡莫氟、氟尿苷、脱氧氟尿苷等)同服是提高其药效的有效手段。卡培他滨是一种很有前途的肿瘤特异性敏感药,在体内经胞苷脱氨酶、胸苷磷酸化酶(TP)代谢激活为5-FU。TP为血小板衍生细胞生长因子,与细胞增殖、血管增生和抑制细胞凋亡密切相关。由于骨髓等组织中胞苷脱氨酶、TP表达低,卡培他滨在肠黏膜、血液和骨髓中代谢成5-FU的量较少,从而肠道和血液毒性较轻。与之相反,多数肿瘤细胞内TP 含量显著多于血浆和正常组织,因此在肿瘤组织内更多将卡培他滨中间代谢产物5′-脱氧-5-氟尿嘧啶(5′-dFU)代谢为5-FU,肿瘤组织内5-FU浓度较血浆和正常组织高数倍至数十倍。因此,卡培他滨较5-FU毒性作用小,肿瘤靶向性高。研究表明,参与卡培他滨代谢的TP、DPD酶的基因突变或酶表达量的高低以及药物靶标TS表达高低与卡培他滨疗效相关。临床研究证实直肠癌患者中TP 高表达而TS、DPD基因低表达者生存率较高,而且TP/DPD基因表达率在敏感和耐药的肿瘤患者之间存在显著性差异相。因此,预测卡培他滨的疗效应检测患者的TP、TS和DPD基因表达水平。
在5-FU代谢和效应途径中,除了DPD外,TS是另一种重要的酶,其催化胸腺嘧啶合成,是5-FU的作用靶点。5-FU通过抑制TS,干扰DNA合成而起到抗肿瘤作用。体内体外研究证实TS蛋白的过表达可引起5-FU耐药。TS蛋白的编码基因是TYMS。对TYMS基因调控区域分析发现启动子5'-非翻译区(TSER)存在多态性变异。该区域存在28bp的重复序列,可重复2~9次,重复的次数与基因表达水平相关。最常见的是2拷贝和3拷贝重复。3拷贝的纯合子型(3R/3R)属于蛋白高表达类型,非3拷贝的野生型杂合子和纯合子(2R/3R,2R/2R)属于蛋白低表达类型。3R/3R群体5-FU化疗疗效差,不良反应发生率高。以4年存活率为指标,3R/3R的患者5-FU化疗效果差。在结肠癌病人中,高表达组为2R/3RG,3RC/3RG,3RG/3RG;低表达组为2R/2R,2R/3RC,3RC/3RC。只有在低表达者中,5-FU治疗效果好;而高表达者,5-FU效果差,治疗失败的比例大。因此,检测TYMS基因型或直接检测靶标TS蛋白表达可作为预测5-FU疗效的方法之一。
亚甲基四氢叶酸还原酶(MTHFR)是叶酸代谢过程中的关键酶,它将5,10-MTHF转变成5-甲基四氢叶酸(5-MTHF)。叶酸抑制药(氟尿嘧啶、培美曲塞、卡培他滨、替加氟等)的抗癌活性与肿瘤细胞内5,10-亚甲基四氢叶酸浓度呈正相关。因此,MTHFR的活性将直接影响体内5,10-MTHF的浓度,从而影响叶酸抑制药的抗癌作用。MTHFR基因位于l号染色体,具有多态性,最常见的突变是位于4号外显子的677C>T和1298A>C。677C>T发生频率较高,普通人群TT突变纯合子发生率为25%。少数乳腺癌患者使用CMF方案化疗后更易产生骨髓毒性,这是与MTHFR基因中667位C>T的点突变相关。因为具有TT型突变等位基因的患者,MTHFR酶活性的下降使得细胞内亚甲基四氢叶酸积聚,增强了5-FU活性代谢产物5-FdUMP对胸苷酸合成酶的抑制作用,导致了严重的骨髓抑制不良反应。有一项研究表明,5-FU治疗后,TT型患者77%产生了3~4级毒性反应,CT和CC型患者出现这种毒性反应的只有6%和8%,突变纯合子产生毒性反应的概率是其他基因型的9~12倍。另一突变1298A>C对MTHFR酶活性影响不显著。其他叶酸抑制药,如培美曲塞、卡培他滨、替加氟等与5-FU的情况类似。另一方面,MTHFR C677T突变,导致4号外显子上222位丙氨酸突变为缬氨酸,使酶活性显著降低,纯合子个体酶活性为野生型的30%,杂合子个体约为野生型的60%。突变使细胞内5,10-MTHF水平升高,从而增强叶酸抑制药(包括5′-FU和培美曲塞等)的抗肿瘤作用。突变纯合子对叶酸抑制药(包括5′-FU和培美曲塞等)比杂合子和野生型纯合子更敏感。72例晚期胃癌患者的治疗效果研究发现CC(32%)+CT(44%)基因型患者对化疗有效的可能性为TT(24%)基因型患者的0.0l7倍。因此,MTHFR也是预测5-FU疗效的因子。
回顾性研究表明,Ⅱ级或Ⅲ级结肠癌给予辅助化疗药5-FU治疗能取得较好疗效。这与患者微卫星不稳定性(MSI)相关。在没有给予辅助化疗药物治疗的患者中,肿瘤表现高频率MSI(H-MSI)的患者5年期生存率高于较低频率MSI(L-MSI)或微卫星稳定(MSS)的患者。但与之相反的是,5-FU辅助化疗可提高肿瘤为MSS或L-MSI的患者的总生存时间,而那些具有H-MSI肿瘤的患者不能从这种辅助化疗中受益。目前,这种遗传标记(包括TP53)的预测5-FU化疗效果的价值还未得到充分的研究证实。采用肿瘤cDNA基因芯片分析肿瘤的基因表达谱可能提供更为精确的5-FU敏感性预测分析。
二、硫 唑 嘌 呤
硫唑嘌呤是6-巯基嘌呤咪唑衍生物,为具有免疫抑制作用的抗代谢药。可产生烷基化作用抑制核酸的生物合成,防止细胞增生,并可引起DNA损伤。通过抑制T淋巴细胞而影响免疫,可抑制迟发过敏反应。用于急慢性白血病和器官移植。巯嘌呤甲基转移酶(TPMT)是硫唑嘌呤、6-巯基嘌呤、6-硫鸟嘌呤等嘌呤类药物代谢过程中的重要代谢酶。TPMT具有遗传多态性,其活性由单个位点上的两个等位基因决定,TPMT活性在人群中呈多态分布。TPMT的活性在患者间个体差异明显,人群中86.6%的TPMT活性较高,而11.1%具有中等活性,有0.3%活性缺失。TPMT活性高的为野生型TPMT*1,而突变型[TPMT*2(G238C),*3A(A719G)和*3C(G460A)]占中等和低活性状况的80%~95%。TPMT*3A的患者TPMT活性完全丧失,TPMT*3B和TPMT*3C患者的TPMT催化活性分别降低9和1.4倍。TPMT*1/*3个体为中等代谢者,TPMT*3B/*3C个体为低代谢者。研究表明,TPMT中等活性和较低活性的患者只能接受10%~50%的平均巯嘌呤化疗剂量。人群中约0.3%的TPMT活性缺失,11%的人群活性中等,都面临着患骨髓抑制增加的风险。TPMT基因的遗传变异对于预测急性淋巴细胞性白血病化疗反应的疗效和毒性作用具有重要意义。TPMT活性与上述嘌呤类药物的治疗效果及毒性作用密切相关,临床上一些医疗机构对使用嘌呤类药物的患者进行TPMT活性及基因型检测,提高药物治疗效果,避免严重不良反应。硫唑嘌呤是目前FDA批准修改药物说明书增加基因遗传变异警示的药物之一,临床医生在结合TPMT基因型慎重使用嘌呤类药物。
三、甲 氨 蝶 呤
甲氨蝶呤(MTX)是广谱抗代谢物,对实体瘤和血液恶肿瘤均有一定疗效。甲氨蝶呤通过还原型叶酸转运体(RFC)进入细胞并且被多聚γ谷氨酸合成酶(FPGS)激活。在体外培养的肿瘤细胞药敏实验中,发现有些肿瘤细胞对甲氨蝶呤具有抗性,这可能是由于FPGS基因3’非翻译区829C>T导致FPGS活性下降,多聚谷氨酸缺乏和RCF的表达量降低,同时导致二氢叶酸还原酶的表达量升高。与之相反,叶酸还原酶基因的突变很少发生,这似乎表明他们在获得甲氨蝶呤抗性中发挥主要作用的可能性不大。研究发现,RFC基因至少存在7个SNPs位点,大多为无意突变。虽然其中一个在 27号外显子发生了氨基酸改变(Arg>His),但人们认为这与叶酸吸收无关。相反,CATGA框移码突变编码无功能转运体,导致肿瘤细胞中MTX转运效率降低,细胞内MTX浓度低,这可能是肿瘤细胞对MTX耐药的原因。甲氨蝶呤作用靶标是MTHFR,能阻断二氢叶酸转变为四氢叶酸,从而抑制胸腺嘧啶核苷酸合成。MTHFR最主要SNP位点是C667T和 A1298C。通常MTHFR C667T位点多态性使酶活降低。MTHFR C677T突变可使同型半胱氨酸转化为甲硫氨酸减少,使血中同型半胱氨酸水平升高,细胞内叶酸循环紊乱,导致MTX的反应性和毒性均升高(主要是毒性升高)。与C667C野生型纯合子患者比较,T667T突变型纯合子患者MTHFR酶活降低70%,但TT 型患者血浆叶酸浓度比CC和CT型患者低。TT基因型与由MTX引起的严重口腔黏膜炎以及其他严重血液毒性反应有关。MTX治疗卵巢癌TT型突变纯合子患者发生3/4级血液毒性比率为CT/CC型的42倍。MTX治疗白血病时,TT型个体容易发生黏膜炎和血小板减少更显著。在一项263名荷兰人参加的随机双盲安慰药对照的临床实验研究中,发现TT和TC基因型个体MTX毒性强,停药率高,且造血系统毒性和肝毒性的发生率TT高于CT/CC型。因此检测MTHFR基因型有利于临床医生权衡MTX的疗效和严重毒性反应,有利于医生作出正确的剂量选择。
四、吉西他滨
吉西他滨是临床上用于治疗胰腺癌、肺癌、乳腺癌和膀胱癌等肿瘤的一种抗代谢药物(图12-3)。吉西他滨系胞嘧啶核苷衍生物,通过人平衡型核苷载体1(hENTl)进入细胞内。在胞质内,吉西他滨被脱氧胞苷激酶(dCK)磷酸化为双氟脱氧胞苷一磷酸(dFdCMP)。后者继续活化为双氟脱氧胞苷二磷酸(dFdCDP)和双氟脱氧胞苷三磷酸(dFdCTP)活性产物。dFdCDP抑制核苷酸还原酶(RR)的活性,使细胞内DNA合成与修复所必需的原料脱氧二磷酸核苷减少,从而进一步抑制DNA的合成。dFdCTP具有DNA多聚酶抑制活性,抑制DNA链的延长,使DNA复制提前终止。它的浓度增加还将抑制dCMP脱氨酶,减少dFdCMP代谢,使药物活化增加,自我强化其细胞毒的作用。所以,吉西他滨是通过细胞内多靶位作用而抑制DNA合成的(图12-3)。胞苷脱氨酶(CDA)是吉西他滨主要代谢酶,使吉西他滨发生不可逆的脱氨基反应,生成相对无活性的代谢产物双氟脱氧尿苷(dFdU)而排出细胞外;吉西他滨另一次要代谢途径是中间产物,dFdCMP在dCMP脱氮酶的作用下生成双氟一磷酸脱氧尿苷,进而生成双氟脱氧尿苷而失活。肿瘤组织中CDA高表达,吉西他滨耐药的原因之一,而CDA酶活性降低,则有可能使吉西他滨体内浓度增高,毒性反应增加。CDA 2号外显子区存在208G>A(CDA*3,Ala70Thr)突变,该突变位于CDA活性区域附近,可影响蛋白结构中a螺旋的形成,进而影响CDA的活性,导致CDA对吉西他滨的脱氨基作用大大降低。CDA*3携带者约占人群的8%~10%。突变纯合子CDA*3/*3和突变杂合子CDA*1/*3体内CDA的脱氨基活性分别为CDA*1/*1野生型纯合子的12%和25%。CDA*3/*3突变型纯合子肿瘤病人体内吉西他滨的血药浓度为CDA*1/*1野生型纯合子的5倍。携带CDA*3/*3的胰腺癌患者对吉西他滨的药物毒性反应明显加重,如发生粒细胞减少、血小板减少、口腔炎、皮疹等。进一步的研究发现,CDA*3可导致胰腺癌患者吉西他滨在体内清除减少,血清吉西他滨浓度升高,血清CDA活性下降,代谢产物dFdU浓度降低,体内吉西他滨的清除率降低。当CDA*3/*3和CDA *1/*3突变携带者联合铂类化疗时,几乎肯定将发生骨髓抑制、3级或3级以上粒细胞减少症,需严密关注血相。

图12-3 吉西他滨化疗敏感和耐药机制 注.dFdCMP/DP/TP.吉西他滨1/2/3磷酸代谢产物;dCK.脱氧胞苷激酶;RR.核苷酸还原酶;dCyd.脱氧胞苷
五、伊 立 替 康
伊立替康系喜树碱类前药,在体内可经羧酸酯酶代谢成活性成分7-乙基-10-羟基喜树碱(SN-38)。SN-38作用靶于DNA拓扑异构酶I,干扰DNA复制和转录,抑制DNA合成,具有较强杀伤肿瘤活性。伊立替康广泛应用于胃癌、结直肠癌、肺癌等实体瘤治疗,可显著提高患者总生存期。但伊立替康治疗时,严重毒性反应发生率较高,特别是可导致严重的延迟性腹泻和粒细胞缺乏,这使其临床应用受到影响。临床研究表明,40%以上接受伊立替康治疗的患者出现3~4级迟发性腹泻,约10%患者出现嗜中性白细胞减少症,导致化疗提前中止。SN-38经肝脏尿苷二磷酸葡萄糖醛酸转移酶(UGT1A1)葡萄糖醛酸化灭活,生成葡萄糖醛酸化SN-38(SN-38G),保护健康细胞免受伊立替康毒性的影响。UGT1A1基因呈多态性,最常见的是启动子区域的UGT1A1*28。野生型有6个AT重复,突变型为7个AT重复。含有较高数目的TA重复序列即TA7患者,与野生型TA6比较,UGTIAI基因表达量降低且 活性下降。此外在UGT1A1基因1号、4号和5号外显子上核苷酸改变也可产生一系列活性降低的突变型(UGT1A1*6、UGT1A1*7、UGT1A1*27、UGT1A1*29)(图12-4)。突变型UGT1A1*28杂合子比野生型对SN-38的葡萄糖醛苷化活性稍低,而UGT1A1*28突变纯合子对SN-38的葡萄糖醛苷化活性则仅为野生型的35%,更容易产生毒性作用。野生型UGT1A1(6/6)在接受伊立替康治疗时产生毒性作用风险较低,UGT1A1*28突变型杂合子(6/7)产生毒性作用的概率为12.5%,突变型纯合子(7/7)则有50%产生毒性作用的可能性。该突变的影响与剂量相关。在使用低剂量伊立替康治疗时,UGT1A1突变与否对毒性发生的风险影响不大。在针对118名服用依立替康的日本癌症患者的病例对照研究中,118人中有26人发生了严重不良反应(发生频率为22%),包括4级粒细胞减少,4级血样便腹泻或脱水,3级水样便腹泻。在出现严重不良反应的26人中,发生UGT1A1*28突变的有12人(46%,其中纯合子4人,杂合子8人),另外没有发生不良反应的92人中有13人是UGT1A1*28突变的个体(14%)。研究者发现UGT1A1*28突变纯合子严重腹泻发生率为70%,*28突变杂合子和野生型纯合子中的发生率分别为33%和17%;另有研究证实4级粒细胞减少症的发生率在突变型纯合子、突变型杂合子和野生型纯合子个体中的发生率分别为50%,12.5%和0。美国FDA提示UGT1A1*28突变纯合子和杂合子的个体发生严重不良反应的风险极大地增加(约7倍),应当严加监控。在中国人中,野生型纯合子(6/6)、杂合子(6/7)和突变型纯合子(7/7)的发生频率分别为70.2%、27.7%和2.1%。UGT1A1*6(G71R,211G>A)发生率为13%是东方人特有的突变型。有研究显示UGT1A1*6突变使UGT1A1葡萄糖醛酸化能力下降70%,使伊立替康毒性作用风险显著增加。参与伊立替康代谢的其他UGT1A亚型也存在 UTG活性中等或急剧降低的错意突变,包括UGT1A9的 MET33Thr、UGT1A7 的Asp256Asn、Trp208Arg、Asn129Lys和Arg131Lys等,但其临床意义尚待大样本临床研究证实。
此外伊立替康的作用靶标拓扑异构酶I的基因改变可能影响伊立替康的药物反应性。拓扑异构酶I同样存在基因多态性,在外显子12、13、15和20上存在一些非同义突变,很多发生在DNA结合区域,导致了氨基酸改变如Gly717Val、Ile721Arg、Asn 722Ser、Asn722ALA、HR729Ile,和Thr729Ala,有可能和伊立替康耐药有关。
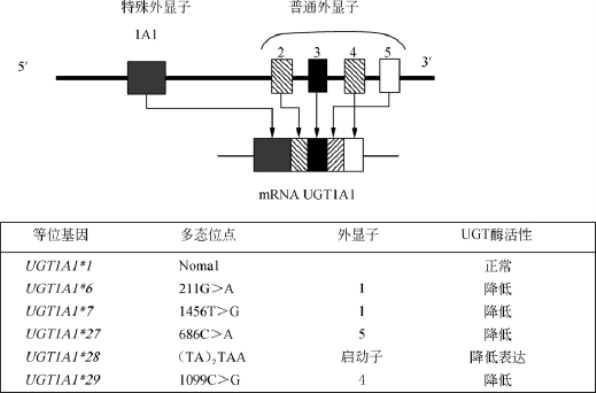
图12-4 UGT1A1基因结构和影响基因表和UGT活性的主要基因突变
六、烷 化 剂
烷化剂环磷酰胺(CTX)和异环磷酰胺(IFX)是前体药物,在体内经P450酶羟化代谢成活性4-羟化代谢产物,如4-羟-CTX/IFX和异磷酰胺氮芥。两药在体内的另一条代谢途径是氯乙基侧链氧化,其代谢产物为氯乙醛和单氯乙基(异)环磷酰胺,没有药理活性但具有神经毒性、肾毒性和膀胱毒性。
在体外试验中,采用分别表达各种CYP酶的重组细胞株研究CTX和IFX代谢途径。研究表明对于CTX,药理活性产物代谢最主要由CYP2B6介导,CYP3A4介导极少部分;对于IFX,正好相反,最主要由CYP3A4介导,CYP2B6介导极少部分。CTX和IFX代谢成具有神经毒性的代谢产物主要是CYP3A4介导,但CYP2B6也参与了IFX极少部分的代谢。醛脱氢酶(ALDH1)能氧化CTX的中间代谢产物醛磷酰胺,形成无毒的羧基磷酰胺,发挥对CTX的解毒作用。ALDH1的过表达可能与CTX和IFX的耐药有关。研究表明在可转移的肿瘤细胞中ALDH1 A1的水平很高,这些肿瘤细胞已对CTX产生抗性,往往导致随后不会采取以CTX为基础的化疗。在77%的病例中,以CTX为基础的化疗疗效与ALDH1A1的表达水平相一致,但当ALDH1A1表达水平较低时,以CTX为基础的化疗时,患者取得一定程度缓解的病例是ALDH1A1水平较高的患者的2.3倍。理论上,CYP2B6酶活性的改变,可使毒性代谢产物氯乙醛和单氯乙基-IFX过量产生,导致严重的神经毒性,但是目前并没有得到临床研究证实。
谷胱甘肽S-转移酶(GST)为一组多功能药物代谢酶,可催化还原型谷胱甘肽和许多亲电子性致癌性物质的结合反应,许多临床广泛应用的抗癌药如顺铂(DDP)、CXT和IFX等均是GST催化的底物。GST位于染色体11q13上,编码的A、P、M、和T同工酶。GSTP基因拷贝数与化疗药物反应性有关。研究表明具有GSTP正常拷贝数的头颈肿瘤患者对基于顺铂的新化疗方案(含CTX)均有反应,而GSTP非正常拷贝数携带患者通常对此化疗方案无反应,且在9个月的治疗后死亡。GSTP1具有基因多态性,主要有Ile104Val。在一回顾性研究中,对采用5-FU/奥沙利铂/CTX治疗大肠癌晚期患者的GSTP1进行基因分型,结果表明不同的基因型生存时间不同,GSTP突变纯合子105 Val/105Val为24.9个月,杂合子Ile/105Val 13.3个月,野生型纯合子Ile/105Ile为7.9个月。在苯丁酸氮芥治疗疗效与GSTP1基因型关系的研究中,另一种GSTP1突变(Ala113Val)较其他突变(Ile104/Val113、Val104/Ala113和Val104/Val113)更有活性,生存时间分别高2.5~15倍。此外,GST启动子的多态性GSTA1*B与GST表达有关,与野生型比较,GST表达下调。乳腺癌患者给予环磷酰胺化疗结果表明,GSTA1野生型和GSTA1*B杂合子基因携带者5年存活率为66%,而突变型纯合子GSTA1*B/B患者存活率为86%,GSTA1*B/B基因型携带患者在第一个5年内死亡的风险明显降低。
七、紫杉烷类药物
哺乳动物细胞中,微管蛋白是一种由6个同型α微管蛋白及7个β微管蛋白形成100kD异源二聚体。抗有丝分裂类化疗药物,包括紫杉烷类和长春花生物碱等,均是通过作用于β-Ⅰ微管蛋白起抗肿瘤作用。紫杉醇是紫杉烷类的原型药物,同其类似的还有多西紫杉醇。正常情况下,微管和微管蛋白二聚体之间存在动态平衡。紫杉醇是第一种被发现在细胞中能诱导微管束形成的天然产物,可造成细胞有丝分裂异常或细胞处于多核G1期。微管的损坏可诱导TP53表达,抑制细胞周期蛋白合成酶,可导致细胞留在G2-M期,引起自身凋亡或者直接跳过G2-M期继续分裂,这取决于肿瘤细胞的类型。目前紫杉醇如何诱导半胱氨酸酶的活性和细胞凋亡的机制并没有定论。这可能是由于紫杉醇诱导Bcl-XL/Bcl-2成员的磷酸化,从而使他们抗细胞凋亡的能力降低而且对p53和p21/WAF-1起上调作用。紫杉烷类药物耐药的主要原因是特定的微管蛋白亚型过表达或突变。微管蛋白β-Ⅲ亚型表达量的升高是紫杉烷类药物耐药的重要表征。体外研究表明,MCF-7乳腺癌细胞对紫杉醇敏感性的降低与细胞ɑ微管蛋白浓度增高相关。最近,人们发现在超表达HER2/neu原癌蛋白的重组NIH3T2细胞株中与对照组细胞比较,β-Ⅳa亚型微管蛋白的表达量增加了3倍,细胞对紫杉烷类药物的敏感性显著下降。微管蛋白的突变是影响紫杉醇敏感性的重要因素。微管蛋白氨基酸序列中,1-31 和217-233 两段氨基酸是紫杉醇的结合位点,位于这些位置的突变可能与耐药有关,如Thr274 Il e和 Arg282Gln。因此对微管蛋白表达分析和基因突变分析可用于评估癌细胞对紫杉烷类药物敏感程度。
紫杉醇主要由细胞色素氧化酶CYP1B1和CYP2C8代谢失活;多西紫杉醇主要由CYP3A4/5代谢失活;紫杉烷类药物主要是通过转运体OATP1B3转运进入细胞内。因此,药物代谢酶CYP1B1、CYP2C8、和CYP3A5以及转运体的基因改变可导致紫杉烷类药物药动学改变,进而可能影响这类药物的疗效或敏感性。CYP1B1最主要的突变是CYP1B1*3(Val432Leu),可导致紫杉醇清除下降。有人对接受紫杉醇和环磷酰胺联合治疗三级或4级乳腺癌患者回顾性研究发现,CYP1B1*3/*3突变纯合子携带者无进展生存时间明显长于野生型纯合子或突变杂合子。如果这一结论能得到后续临床试验证实,CYP1B1*3有可能成为鉴别患者紫杉醇耐药与否的预测因子。然而,CYP1B1*3和紫杉醇治疗预后之间关系的机制仍然不清楚。几项研究表明CYP1B1基因型与紫杉醇化疗的肿瘤进展不相关,且CYP1B1基因状况本身并不会改变紫杉醇抵抗。另外,CYP1B1高表达于乳腺癌组织,CYP1B1*3可使CYP1B1的mRNA及蛋白表达及其催化活性升高,导致对雌激素的羟化代谢增强,CYP1B1*3位突变携带者的5~10年存活率显著低于野生型纯合子。
CYP2C8基因呈多态性,最主要突变是CYP2C8*3。研究表明,CYP2C8*3可降低紫杉醇的清除率。在118名接受紫杉醇治疗的西班牙肿瘤患者中,研究发现CYP2C8*3与神经毒性反应相关。CYP2C8*3/*3突变纯合子携带者出现3级神经毒性的概率明显高于其他基因型。但CYP2C8*3基因型是否与紫杉烷类药物耐药相关有待临床研究证实。
同样,OATP等转运体可能影响紫杉烷类药动学,但与耐药之间的关系尚缺证据。此外,ABCB1即MDR1是细胞的外排泵,ABCB1 G2677T/A突变与紫杉醇的疗效有关。紫杉醇进入肿瘤细胞后,由ABCB1泵出细胞。2 677例突变使ABCB1转运能力下降,使药物在肿瘤细胞内积蓄,达到好的治疗效果。28例对紫杉醇反应好的卵巢癌患者中有9例为突变纯合子,而对紫杉醇治疗效果不佳的25例患者中仅2例为突变纯合子;在弱反应者中2 677例突变频率(36%,18/50)低于对紫杉醇反应好的患者中频率(57%,32/56)。
八、他 莫 昔 芬
他莫西芬(TAM),是一种非固醇类抗雌激素药物,目前广泛用于雌激素受体阳性的乳腺癌患者的预防和治疗。在体内TAM的代谢有多种药物代谢酶参与,大约10%TAM由CYP2D6代谢成活性代谢产物4-羟基-N-去甲基TAM(endoxifen)。在中国人群中,CYP2D6常见功能减弱的突变型等位基因为CYP2D6*3(约占1%)、CYP2D6*4(约占1%)、CYP2D6*5(约占6%)、CYP2D6*10(约占53%)。此外,基因重复突变(Gene Duplication,约占2%)能使CYP2D6功能增强。在一项200名乳腺癌患者接受TAM作为辅剂的临床研究中,CYP2D6慢代谢者无瘤生存率较低,这与活性代谢产物endoxifen生成减慢从而导致疗效下降相一致。在另一项293例接受治疗的乳腺癌患者中,携带CYP2D6*10等位基因的T/T型患者与C/T型或C/C型患者相比,血中4-羟-TAM(另一活性代谢产物)较低,且临床效果较差。接受他莫昔芬治疗的乳腺癌患者的CYP2D6基因型与血液中活性代谢产物的浓度密切相关,并因此显著影响患者的复发率和生存期。因此,美国FDA已于2006年建议患者在接受他莫昔芬治疗前首先对CYP2D6基因型进行检测。
他莫昔芬经CYP2D6代谢为活性代谢产物4-OH他莫昔芬后结合雌激素受体的能力大大增强,该4-OH代谢产物由SULT1A1硫酸盐化作用代谢失活,因此SULT1A1基因多态性和酶活性对于他莫昔芬的疗效具有重要影响。SULT1A1*2造成酶活性降低2倍,且蛋白稳定性降低,造成4-OH代谢产物难以代谢为活性硫酸盐-他莫昔芬。据推测该次级代谢产物的药理活性更高。因此,如果该产物不能形成,化疗效果及存活率将大大降低。
九、生长因子受体洛氨酸激酶的抑制药(RTK)
表皮生长因子受体(EGFR)主要位于细胞膜上,属受体酪氨酸激酶家族。EGFR被配体激活后启动胞内该通路上的信号传导,经过细胞质中衔接蛋白、酶的级联反应,调节转录因子激活基因的转录,导致细胞迁移、黏附、增殖、分化和凋亡。研究表明,在许多实体肿瘤中EGFR信号转导通路上的基因发生体细胞突变及表达异常,导致肿瘤细胞无限制地扩增和迁移。自从拮抗EGFR的靶向药吉非替尼问世以来,目前已有一系列针对肿瘤的发生、增殖、迁移分化和血管增生等分子机制的靶向药物陆续投入临床应用(表12-1)。应用最广泛和最成熟的是EGFR类靶向性治疗药物。因此,近年以EGFR和EGFR信号通路中关键的组分为靶标的分子靶标检测及靶向治疗成为国际肿瘤界个体化药物治疗关注的焦点。
表皮生长因子受体erbB家族中,理想的药物靶标是erbB1(EGFR或HER1)、erbB2(HER2/neu)和erbB3。另外一种与之类似的受体是c-kit/干细胞因子受体(SCFR)。erbB1是170KD跨膜糖蛋白,可形成同源二聚体(erbB1/erbB1)或异源二聚体(erbB1/erbB2、erbB1/erbB3),其主要配体是表皮生长因子(EGF)以及其他配体如转化生长因子-α(TGF-α)等。erbB2是一个锚接到细胞膜上185kd蛋白,虽然其的配体未被鉴定出来,但这个蛋白可以与家族其他成员形成异源二聚体。许多研究表明,在胶质母细胞瘤、乳腺癌、肺癌、结肠癌、膀胱癌和头颈恶性肿瘤组织中,可见到erbB基因拷贝数扩增、突变和表达增加等情况。络氨酸激酶受体(RTK)抑制药,如吉非替尼和埃罗替尼,可阻断由RTK、erbB1激活的信号传导通路。而单克隆抗体,如西妥昔单抗和曲妥珠单抗,可分别特异性阻断erbB1和erbB2。临床上,吉非替尼和埃罗替尼主要用于非小细胞肺癌患者的治疗,西妥昔单抗和曲妥珠单抗的适应证分别是大肠癌和乳腺癌。曲妥珠单抗的药效取决于基因erbB2的过表达和基因拷贝数,但是否与erbB1的过表达以及其信号传导通路的激活相关目前尚不清楚。EGF-RTK抑制药和erbB1单克隆抗体的耐药可能与EGFR常见的突变相关。这种突变命名为EGFRvIII,是由于剪切方式的改变或基因重排导致2~7号外显子缺失形成的,导致编码的细胞膜外EGF结合区缩短,可能会对RTK抑制药和erbB1单克隆抗体出现抗性。
表12-1 目前临床上应用的肿瘤靶向性治疗药物

EGFR抑制药有两类,第一类是酪氨酸激酶抑制药(EDFR TKI),主要包括吉非替尼和埃罗替尼;第二类是EGFR单克隆抗体,如西妥昔和帕尼。吉非替尼属酪氨酸激酶抑制药,通过抑制EGFR的酪氨酸激酶而达到抑制肿瘤生长的作用,主要用于治疗非小细胞肺癌。绝大多数非小细胞肺癌病人对吉非替尼无反应,但约10%的病人对吉非替尼表现出快速,且非常显著的临床疗效。研究发现,EGFR基因18~21号外显子编码酪氨酸激酶区,此段基因序列发生突变后会使EGFR被配体激活后磷酸化程度升高,从而使TKI抑制药吉非替尼的疗效更好。突变更常见于亚洲,女性,年轻,不吸烟的腺癌型非小细胞肺癌患者。吉非替尼在此类人群中疗效最好。在整个非小细胞肺癌人群中,EGFR发生突变的频率约为24%。在14例吉非替尼敏感的患者中,有11例受试者EGFR有突变;而对吉非替尼不反应的患者六名中无一人有突变存在。突变集中在18~21个外显子,以18、19和21常见,又以19号外显子的缺失突变(Glu746Ala750)和21号外显子的Leu858Arg最常见。突变均为杂合突变,现仍未见有同一受试者发生两处突变的报道。突变者1年和18个月存活率为90%和80%,而野生型分别为60%和40%。19号外显子的缺失突变平均存活时间为34个月,大大长于Leu858Arg突变者的8个月,后者的存活时间也比野生型长。
然而,大部分对EGFR-TKI 治疗有效的患者最终都会对EGFR-TKI产生耐药性。进一步临床研究还表明,EGFR基因外显子20的体细胞突变是EGFR-TKI继发耐药的主要机制之一。外显子20的突变类型主要是第790位密码子出现C>T的转换,引起EGFR蛋白中该位点的氨基酸由苏氨酸转变为甲硫氨酸(T790M)。这一突变仅见于药物治疗后复发者,突变使得非小细胞肺癌患者对吉非替尼和埃罗替尼产生抗性。由此可见,对EGFR基因18、19、20和21外显子进行分型检测可预测患者对吉非替尼和埃罗替尼的反应性,为临床医生非小细胞肺癌初次治疗制定药物治疗方案提供依据,也可以根据20号基因型判断患者是否产生继发性耐药。
K-ras蛋白是EGFR信号传导通路中的一个关键的下游调节因子,是ras原癌基因家族中的重要成员。K-ras蛋白位于细胞膜内表面,具有GTP酶活性,参于传导细胞增值、分化和迁移等细胞调控信号。其激活状态为GTP结合状态,失活状态为GDP解离状态,其转变为活动性致癌基因的主要部位是第2号外显子第12、13 和61 密码子的突变,其中以第12 和13密码子点突变最常见。12号密码子 GGT和13号密码子GGC原本编码均为Gly氨基酸,突变导致这2个密码子分别变成6种和4种其他氨基酸。该基因的体细胞突变常见于多种恶性肿瘤。在肺癌患者中的突变率为15%~30%,在结直肠癌患者中为20%~45%。在研究EGFR突变与吉非替尼治疗进展期NSCLC患者的疗效间的关系的过程中也发现了K-ras基因点突变,而且研究表明,K-ras基因突变与NSCLC对吉非替尼、厄罗替尼等靶向治疗药物的原发性耐药有关。同时研究还发现这K-ras基因的突变使结直肠癌患者对西妥昔单抗和帕尼单抗的治疗产生耐药性。因此检测K-ras基因的突变可作为EGFR靶向治疗耐药性产生的重要预测指标。
正因为如此,美国国家癌症综合网络(NCCN)2009年版的临床指南以及美国FDA均建议根据EGFR和K-ras基因检测的结果决定是否使用EGFR靶向药物作为非小细胞肺癌或结直肠癌临床治疗药物。
伊马替尼是一种有效的c-kit/SCFR和血小板衍生因子受体A(PDGFRA)的抑制药。在特定的恶性肿瘤中,特别是在胃肠间质瘤(GIST)中,c-kit常发生突变。c-kit基因突变主要发生在外显子9和11上。92%的GIST患者中存在此突变,这说明c-kit基因突变有可能在肿瘤的形成中起着关键作用。在外显子11上存在的c-kit突变的GIST 病患者服用伊马替尼反应率达到83.5%,在外显子9存在突变位点或没有检测到c-kit或PDGFRA突变的肿瘤患者的反应率较低(分别为47.8%和0)。此外c-kit激酶结合区域存在的Asp816Phe、Asp816Tyr、和Asp816Val的突变,这些SNPs可导致伊马替尼的耐药,但与之相反,Val560Gly 突变可提高c-kit蛋白与药物的亲和力而提高疗效。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















