正常情况下,体液中的补体成分多以非活化形式存在,受到某些激活因子作用后,补体按一定顺序依次被活化,形成一系列补体级联酶促反应,产生具有生物学活性的产物。已发现补体激活途径有经典途径(classical pathway)、甘露聚糖结合凝集素(mannan-binding lectin,MBL)途径和旁路途径(alternative pathway)三条。
(一)经典激活途径
经典激活途径(classic pathway,CP),指激活物与C1q结合,顺序活化
 、C2、C4、C3,形成C3转化酶
、C2、C4、C3,形成C3转化酶 )与C5转化酶
)与C5转化酶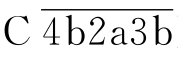 )的级联酶促反应过程。经典途径又称传统途径。
)的级联酶促反应过程。经典途径又称传统途径。
1.激活物 经典激活途径的激活物主要是与抗原结合的IgG、IgM分子。另外,C反应蛋白、细菌脂多糖(LPS)、髓鞘脂和某些病毒蛋白(如HIV的gp120)等也可作为激活物。不同的人IgG亚类活化C1q的能力由高到低依次为IgG3>IgG1>IgG2。IgG4无激活经典途径的能力。
2.活化过程 可人为地分为识别阶段、活化阶段和共同的末端通路三个阶段。
(1)识别阶段:抗原抗体结合后,抗体构象发生改变,使Ig Fc段的补体结合位点暴露出来,C1q与2个以上Fc段结合可发生构型改变,使与C1q结合的C1r活化,活化的 激活C1s的丝氨酸蛋白酶(serine protease,SP)活性。在经典途径中,一旦形成
激活C1s的丝氨酸蛋白酶(serine protease,SP)活性。在经典途径中,一旦形成 ,即完成识别阶段,并进入活化阶段。每一个C1q分子必须同时结合两个以上Ig Fc段的补体结合位点才能活化。由于IgG为单体,其
,即完成识别阶段,并进入活化阶段。每一个C1q分子必须同时结合两个以上Ig Fc段的补体结合位点才能活化。由于IgG为单体,其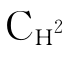 区共有2个C1q结合点,与抗原结合后需要相邻的两个IgG分子共同与C1q分子桥联,才能活化C1;而IgM为五聚体,其
区共有2个C1q结合点,与抗原结合后需要相邻的两个IgG分子共同与C1q分子桥联,才能活化C1;而IgM为五聚体,其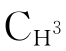 区共有10个C1q结合点,易与C1q分子桥联,故一个IgM分子与抗原结合后即可活化经典途径。
区共有10个C1q结合点,易与C1q分子桥联,故一个IgM分子与抗原结合后即可活化经典途径。
(2)活化阶段: 作用于后续的补体成分,至形成C3转化酶(
作用于后续的补体成分,至形成C3转化酶( )和C5转化酶(C
)和C5转化酶(C  )的阶段即为活化阶段。C4是C
)的阶段即为活化阶段。C4是C 的第一个底物。在Mg2+存在下
的第一个底物。在Mg2+存在下 使C4裂解为C4a和C4b,大部分新生的C4b与H2O反应而失活,仅5%C4b结合至紧邻抗原抗体结合处的细胞或颗粒表面。
使C4裂解为C4a和C4b,大部分新生的C4b与H2O反应而失活,仅5%C4b结合至紧邻抗原抗体结合处的细胞或颗粒表面。 的第二个底物是C2分子,C2在Mg2+存在下被
的第二个底物是C2分子,C2在Mg2+存在下被 裂解为C2a和C2b。C2a可与C4b结合成
裂解为C2a和C2b。C2a可与C4b结合成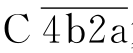 复合物即为经典途径的C3转化酶。C3被
复合物即为经典途径的C3转化酶。C3被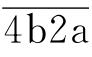 裂解为C3a和C3b,新生的C3b与
裂解为C3a和C3b,新生的C3b与 中的C4b结合,形成
中的C4b结合,形成 复合物即为经典途径的C5转化酶。至此完成活化阶段,汇合到补体三条激活途径的共同末端通路(图3-1)。补体裂解过程中生成的小分子C4a、C2b、C3a释放到液相中,发挥各自的生物学活性。另外,C3b还可进一步被裂解为C3c、C3dg、C3d等小片段,其中C3d可参与适应免疫应答。
复合物即为经典途径的C5转化酶。至此完成活化阶段,汇合到补体三条激活途径的共同末端通路(图3-1)。补体裂解过程中生成的小分子C4a、C2b、C3a释放到液相中,发挥各自的生物学活性。另外,C3b还可进一步被裂解为C3c、C3dg、C3d等小片段,其中C3d可参与适应免疫应答。

图3-1 补体激活的经典途径
(二)旁路激活途径
旁路激活途径(alternative pathway,AP),又称替代激活途径。此途径的激活不依赖于抗体,而由微生物或外源异物直接激活C3,由B因子、D因子和备解素(P因子)参与,形成C3转化酶与C5转化酶的级联酶促反应过程。在种系发生上,旁路途径是最早出现的补体活化途径,是抵御微生物感染的非特异性防线。
1.激活物 旁路途径的“激活物”,实际上是为补体激活提供保护性环境和接触表面的成分,如某些细菌、内毒素、酵母多糖、葡聚糖等。
2.活化过程 此途径从C3开始。生理条件下,C3与水分子形成C3(H2O),在Mg2+存在下,C3(H2O)与B因子结合,B因子被D因子裂解为Ba和Bb,Bb与C3(H2O)结合为C  Bb(即旁路途径的起始C3转化酶),其中Bb片段具丝氨酸蛋白酶活性,可以作用于C3分子,缓慢、持续地产生少量的C3b。C3(H2O)Bb极不稳定,易被血清中H因子和I因子灭活。当有旁路途径的激活物存在时,结合于“激活物”表面的C3b不易被有效灭活,并与B因子结合,结合的B因子被D因子裂解为Ba和Bb,Bb与C3b结合,形成
Bb(即旁路途径的起始C3转化酶),其中Bb片段具丝氨酸蛋白酶活性,可以作用于C3分子,缓慢、持续地产生少量的C3b。C3(H2O)Bb极不稳定,易被血清中H因子和I因子灭活。当有旁路途径的激活物存在时,结合于“激活物”表面的C3b不易被有效灭活,并与B因子结合,结合的B因子被D因子裂解为Ba和Bb,Bb与C3b结合,形成 ,此即旁路途径C3转化酶;而结合于自身组织细胞表面的C3b,可被多种调节蛋白(如H因子、I因子、DAF、MCP、CR1等)降解、灭活,以保护自身细胞不被损伤。参与旁路激活途径的备解素(P)与
,此即旁路途径C3转化酶;而结合于自身组织细胞表面的C3b,可被多种调节蛋白(如H因子、I因子、DAF、MCP、CR1等)降解、灭活,以保护自身细胞不被损伤。参与旁路激活途径的备解素(P)与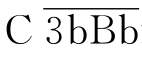 结合可使其稳定,防止其被降解。结合于激活物表面的
结合可使其稳定,防止其被降解。结合于激活物表面的 可裂解更多C3分子,新生的C3b其中一部分与
可裂解更多C3分子,新生的C3b其中一部分与 复合物结合为
复合物结合为 ,此即旁路途径C5转化酶,其后即进入共同末端通路与经典途径完全相同;还可有部分C3b又与Bb结合为新的
,此即旁路途径C5转化酶,其后即进入共同末端通路与经典途径完全相同;还可有部分C3b又与Bb结合为新的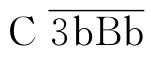 ,形成旁路激活的正反馈放大效应(图3-2)。
,形成旁路激活的正反馈放大效应(图3-2)。
(三)MBL激活途径
MBL激活途径(MBL pathway),又称凝集素途径(lectin pathway),指由血浆中MBL直接识别多种病原微生物表面的N-氨基半乳糖或甘露糖,进而依次活化MASP1、MASP2、C4、C2、C3,形成与经典途径中相同的C3转化酶与C5转化酶的级联酶促反应过程。

图3-2 补体激活的旁路途径及C3放大效应
MBL激活途径激活物主要为含N-氨基半乳糖或甘露糖基的病原微生物。MBL分子结构类似于C1q分子。在Ca2+存在条件下,MBL可与病原微生物表面的N-氨基半乳糖或甘露糖结合,并发生构型改变,导致MASP活化。MASP有两类。
(1)活化的MASP2类似于 ,能裂解C4和C2,生成与经典途径相同的C3转化酶C
,能裂解C4和C2,生成与经典途径相同的C3转化酶C  裂解C3生成与经典途径相同的C5转化酶
裂解C3生成与经典途径相同的C5转化酶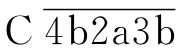 ,继而进入共同末端通路。
,继而进入共同末端通路。
(2)活化的MASP1能直接裂解C3生成C3b,形成旁路途径C3转化酶 ,参与并加强旁路途径正反馈环路(图3-3)。因此,MBL途径对补体经典途径和旁路途径活化具有交叉促进作用。
,参与并加强旁路途径正反馈环路(图3-3)。因此,MBL途径对补体经典途径和旁路途径活化具有交叉促进作用。

图3-3 补体激活的MBL途径
上述三条途径在激活C3这一环节汇合,形成C5转化酶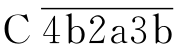 或
或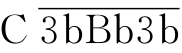 )进入共同的末端通路,其过程为:将C5裂解为C5a、C5b;C5a游离于液相,是重要的炎症介质,C5b可与C6稳定结合为C5b6;C5b6自发与C7结合成C5b67,暴露膜结合位点,与附近的细胞膜非特异性结合;结合于膜上的C5b67可与C8结合,形成的C5b678可促进C9聚合,形成C5b6789n巨分子复合物,即攻膜复合物(membrane attack complex,MAC)。插入细胞膜的MAC通过破坏局部磷脂双层而形成“渗漏斑”,或形成穿膜的亲水性孔道,补体激活的共同末端通路的终末效应为细胞溶解。
)进入共同的末端通路,其过程为:将C5裂解为C5a、C5b;C5a游离于液相,是重要的炎症介质,C5b可与C6稳定结合为C5b6;C5b6自发与C7结合成C5b67,暴露膜结合位点,与附近的细胞膜非特异性结合;结合于膜上的C5b67可与C8结合,形成的C5b678可促进C9聚合,形成C5b6789n巨分子复合物,即攻膜复合物(membrane attack complex,MAC)。插入细胞膜的MAC通过破坏局部磷脂双层而形成“渗漏斑”,或形成穿膜的亲水性孔道,补体激活的共同末端通路的终末效应为细胞溶解。
(四)三条补体激活途径的比较
补体是一种相对独立的固有免疫防御机制,上述三条激活途径在种系进化中出现的先后顺序为旁路途径、MBL途径和经典途径。三条途径起点各异,但相互交叉,并具有共同的末端通路(图3-4,表3-1)。

图3-4 三条补体激活途径的比较
表3-1 三条补体激活途径的比较

1.经典途径的主要特点
(1)激活物主要是由IgG或IgM与抗原结合形成的免疫复合物(IC)。
(2)C1q识别IC是CP的起始步骤。
(3)C3转化酶和C5转化酶分别是 和
和 。
。
(4)有赖于特异性抗体产生后才能激活此途径,是体液免疫的效应机制之一,在感染后期(或恢复期)才能发挥作用,或参与抵御相同病原体再次感染机体。
2.旁路途径的主要特点
(1)激活物是细菌、真菌或病毒感染细胞等。
(2)绕过C1、C4和C2,直接激活C3。
(3)C3转化酶和C5转化酶分别是 和
和 。
。
(4)存在正反馈放大环路。
(5)无需抗体存在即可激活补体,故在感染早期或初次感染即可发挥防御作用,从而为未免疫个体提供抵抗病原体感染的能力。
3.凝集素途径的主要特点
(1)激活物广泛,主要是病原微生物表面的特殊糖结构如N-氨基半乳糖或甘露糖。
(2)MBL识别这些特殊糖结构是该途径的起始步骤。
(3)除C1外,所有补体固有成分均参与该途径。
(4)除识别机制有别于经典途径外,后续过程与经典途径基本相同。
(5)对经典途径和旁路途径具有交叉促进作用。
(6)无需抗体参与即可激活补体,可在感染早期或未免疫个体发挥抗感染效应。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















