审化学题五法
审好题是解好题的基础,题目未审清,必然抓不住关键所在。在解题中如何疏通渠道,越思维障碍正确审题?
一、关键词句法
认真阅读试题,抓住关键词句。审题首先要认真仔细地阅读试题,准确完整地理解题意。阅读时应紧紧抓住试题中关键的词句反复推敲,如“最”、“是”、“不是”、“正确”、“不正确”等,要防止粗枝大叶,一掠而过而误解题意。如有的学生在做选择题时,对题目中的“最”字重视不够,在选择了一个正确答案后,又从“似真性”答案中选择第二个,造成了“画蛇添足”,待考试以后,他们才后悔不已。
示例1:用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是( )
A.所消耗的硝酸的量:①>②>③
B.对环境造成的危害③最小
C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是①
D.三种途径所消耗的铜的质量相等
答案:C
解析:制取相同质量的硝酸铜,所消耗的铜的质量相等,但消耗的硝酸的量不同,①、②、③中起酸性作用的硝酸相同,起氧化作用的硝酸不同,起氧化作用的硝酸①>②,而③中的硝酸只起酸性作用,不产生污染性的气体。
二、收缩法
此法特别适用于一些推理题。
示例2:一种常温下为气体单质A及其他的化合物在一定条件下的转化过程如图。试写出A、B、C、D、E各物质的分子式?
解析:此题粗看起来着无边际,难以下手。关键在于找到突破口,攻破了突破口,其他问题就迎刃而解了。收缩法审题步骤如下:
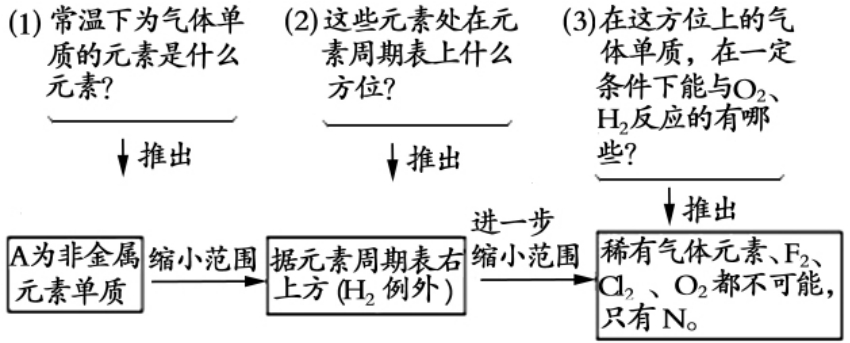
所以A为N2,B为NH3C为NO,D为NO2,E为HNO3。
三、规律法
此法是解决一些有规律可循的题目。
示例3:某金属原子最外层电子排布是6S26P1,关于该金属及其他的化合物描述错误的是( )
(A)金属性比铝强;
(B)能形成+3价;
(C)氢氧化物呈两性;
(D)该金属在一定条件下能与盐酸反应;
(E)该金属是导体。
解析:由金属原子最外层电子排布6S26P1可知①该元素处于元素周期表中第6周期第ⅢA族;②该元素同金属铝属于同一主旋。
根据元素周期表中元素性质的递变规律推出,该金属的金属性比铝强得多,就很快选出答案(C)。
四、分解法
此法在有关溶解、结晶、溶解度、百分比浓度等方面计算比较直观,较易被学生接受。
示例4:15℃时,某2价金属硫酸盐的饱和溶液的百分比浓度为25%,取足量此溶液,加入1克上述硫酸盐的无水物,则析出3.15克t水合硫酸盐晶体。试确定2价金属的原子量。
解析:设2价金属为R,原子量为x。
用思考题和图示双重分解(要求:边思考边图示)。
(1)思考题:
①2价无水金属硫酸盐和它的t水合硫酸盐晶体化学式如何写?(RSO4、RSO4·7H2O)
②1克无水硫酸盐投入饱和溶液后有多少克晶体析出?(3.15克)
③从析出的晶体质量看,原溶液的质量减少了几克?(2.15克)
④减少的那一份溶液与剩下的溶液在浓度上有什么关系?(相同)
(2)图示:
题给质量(克):3.15=1+2.15×25%=1.5375
2.15×75%=1.6125
化学式:eq x(RSO4·7H2O)~eqx(RSO4)~eq x(7H2O)
摩尔质量(克/摩):222+96x+126x
即有3.15∶1.6125=(222+x)∶126或
1.5375∶1.6125=(96+x)∶126
解得x=24.14(克/摩)
∴2价金属的原子量为24.12。
五、整体法
对一些关系比较复杂的题目,应从整体、全面的观点去看问题。所以,此法特别适用于综合性强的题目。
例:将一块生锈的铁片置于稀硝酸中,反应结束后收集到1.12升一氧化氮气体(标准状况下),溶液中还剩下3克单质铁。取出铁后,向溶液中通入10.65克氧气,恰好使溶液中的FeZ2+全部被氧化(假设Cl2只与Fe2+反应)。求这块生锈的铁片总质量(铁锈成分以Fe2O3·H2O计算)。
解析:此题看起来数据不多,但存在较为复杂的关系。有些同学原先做与这道题同类型的题目,感到较困难或束手无策。有的虽能理出一些,但结果却与题不符。因此,碰到这些较为复杂的题目,可采取以下做法:
①理:数据对应的物质或物质的关系要理好;
②找:物质之间有何反应关系要找好;
③挖:题目中的隐含条件要挖出;
④串:量——物质——反应的关系要串接好。
解题路线(逆推)
从③通Cl2知道溶液(Ⅱ)中Fe2+的物质的量(2Fe2++Cl2。2Fe3++2Cl-)∶10.65/71×2=0.3mol
从②中知道溶液(Ⅰ)中Fe3+的物质的量及消耗在与Fe3+反应的Fe的物质的量(Fe+2Fe3+=3Fe2+)
Fe3+的物质的量=2/3×0.3=0.2molFe的物质的量=1/3×0.3=0.1mol
从①中知道Fe2O3·H2O的物质的量和消耗在与HNO3反应的Fe的物质的量:
Fe的物质的量=1.12/22.4=0.05mol
[∴Fe的物质的量:NO的物质的量=1∶1]
Fe2O3·H2O的物质的量=(0.2-0.05)×1/2=0.075 mol,所以,铁片的总质量为:
3+(0.1+0.05)×56+0.075×178=24.75(克)
最后,需要指出的是,审题与解题一样没有固定的方法,采用何种方法审题,则要看具体的题目来定。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















