溶液在自然界中普遍存在,生活中的果汁液、白醋、洗发水,人体内的血液及各种分泌液都是溶液。溶液与生命活动和工农业生产密切联系,动植物摄取的养分,必须经过转化变成溶液后才能吸收;农业生产中使用的化学肥料,医疗上用的葡萄糖、生理盐水和注射液,都要在配成溶液后才能使用;工业生产上的化学反应通常在溶液里进行才比较快,所以溶液无论是对动植物的生理活动,还是对工农业生产都有其重大意义。
2.1.1 分散体系
溶液是一种分散体系。分散体系简称分散系,就是将一种或几种物质分散到另一种物质中而形成的混合体系,它是由分散质和分散剂组成的。通常将被分散的物质称为分散质,另一种容纳分散质的物质称为分散剂。如泥水、豆浆、糖水都是分散系,泥土、豆质、糖是分散质,水是分散剂;碘分散在酒精溶液中形成的碘酒,碘是分散质,酒精是分散剂。分散质和分散剂均可以为气体、液体和固体。常见的分散系类型见表2.1。
表2.1 常见的分散系的类型

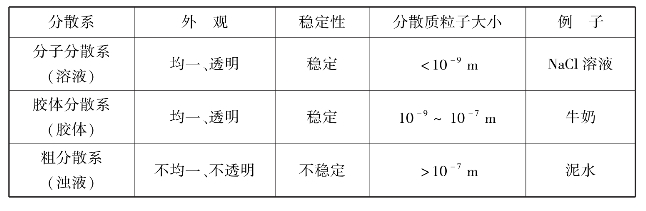
通常按分散质的分散程度不同把分散体系分为3类:粗分散体系,胶体分散体系和分子分散体系。分散质颗粒直径大小>10-7 m的是粗分散体系(悬浊液、乳浊液),它的特性表现为粒子不能通过滤纸,不扩散,不能渗透,在普通显微镜下可以看见。分散质颗粒直径大小为10-9~10-7 m的是胶体分散体系(胶体),它的特性表现为粒子能通过滤纸,扩散极慢,不能渗透,在普通显微镜下看不见,在超显微镜下可以看见。分散质颗粒直径大小<10-9 m的是分子分散体系(溶液),它的特性表现为粒子能通过滤纸,扩散很快,能渗透,在超显微镜下也看不见。粗分散系、胶体分散系和分子分散系的区别见表2.2。
表2.2 粗分散系、胶体分散系和分子分散系的区别
2.1.2 溶液概念
溶液也就是分子分散系,它是由一种或几种物质以分子或离子形式分散于另一种物质中形成的均一、稳定的混合物。溶液中的分散质和分散剂分别称为溶质和溶剂,其中,被溶解的物质是溶质,能溶解其他物质的物质是溶剂。例如:用盐和水配制的生理盐水,盐就是溶质,水就是溶剂。溶液中的溶质是分子或离子,并具有透明、均匀、稳定的宏观特征。溶质与溶剂可以是气体、液体和固体,当固体或气体溶于液体形成溶液时,通常把固体或气体称为溶质,液体称为溶剂;两种溶液互溶时,若其中一种是水,一般将水称为溶剂;两种溶液互溶时,两种液体都不为水,一般把量多的一种称为溶剂,量少的一种称为溶质。
溶液可根据颜色分为有色溶液和无色溶液;根据酸碱性分为酸性溶液、中性溶液和碱性溶液;根据导电性分为电解质溶液和非电解质溶液;根据溶质含量分为浓溶液和稀溶液;根据溶解程度分为饱和溶液和不饱和溶液等。
如向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液就是饱和溶液。饱和溶液是指一定温度下,一定量的溶剂里,不能再溶解某种物质的溶液。在一定温度下,一定量的溶剂里,还能再溶解某种物质的溶液称为不饱和溶液。饱和溶液反映了溶剂的最大溶解能力,表明溶质达到了最大的溶解限度,最大的溶解限度与外界温度,压力(气体受此影响)和溶质、溶剂的比例有关,饱和溶液增加溶剂、改变温度、减小压力(气体受此影响)可能变为不饱和溶液;同样不饱和溶液增加溶质、改变温度、增大压力(气体受此影响)也可能变为饱和溶液。溶液的饱和程度可用溶解度来描述,固体物质的溶解度是指在一定温度下,固态物质在100g溶剂中达到饱和状态时所溶解的质量。大部分固体物质的溶解度随温度升高而增大,如硝酸钾;少部分固体溶解度受温度影响不大,如氯化钠;极少数物质溶解度随温度升高反而减小,如氢氧化钙。气体物质的溶解度是指一定温度、压强为1标准大气压时,溶解在1体积水里达到饱和状态时的气体的体积。气体的溶解度随温度的升高而减小,随压强的增大而增大。
饱和溶液不一定是浓溶液,浓溶液也有可能是不饱和溶液。如饱和氢氧化钙水溶液,因为水中的氢氧化钙溶解度较小它是稀溶液,98%的硫酸是浓溶液,但还能吸收SO3说明是不饱和溶液。浓溶液、稀溶液与饱和溶液、不饱和溶液是从不同角度对溶液进行的描述,它们之间并没有必然联系。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















