谁是酸中的“强者”
醋酸是我们最熟悉也是人类最早知道的酸,是从酒精发酵以后得到的。15世纪时欧洲人用绿矾(FeSO4·7H2O)和食盐共热制得盐酸。16—17世纪制得硫酸,再后制得的硝酸以及能溶解金的王水。
1667年玻义耳(1627—1691)将酸碱分类,根据酸的共同特点归纳出酸的通性是:有酸味,能使植物色素(紫罗兰花)变红,能溶解碱性物质,和某些金属反应生成盐。那时候还不能分析酸的组成。100年以后,拉瓦锡(1743—1794)提出了酸的“含氧学说”。他根据硫、磷在氧气中燃烧之后溶于水生成酸的实验事实,认为氧气是酸的共同成分,呈酸性的关键元素是氧。酸的含氧说法导致当时的化学进入了一个误区。对酸的认识的第二个误区是将“金属与酸反应释放出本身所含的氢,误以为金属与酸反应产生的氢来自金属”。两个误区束缚了化学家们的头脑长达半个多世纪,以致1789年当贝托雷(1748—1822)发现HCN(氢氰酸)并指出这个酸中不含氧时,很多人非但不能接受酸中含氢的观点,反而认为HCN不是酸。1811年英国人戴维(1778—1829)指出,盐酸中不含氧而含氢,后来又发现了氢碘酸(HI),戴维认为氢是成酸要素。在此前后,盖·吕萨克试图测定金属钾中钾和氢的质量比以及钠中钠和氢的质量比.但实验结果发现钠和钾都是单质,并不含氢,氢存在于酸中。这时候人们把酸分成两种:含氧酸,像硫酸(H2SO4)、硝酸(HNO3);含氢酸,像盐酸(HCl)、氢碘酸(HI)、氢硫酸(H2S)等。
到了19世纪30年代,人们研究磷酸时发现有正、偏、焦磷酸之分(H3PO4、HPO3、H4P2O7),它们的差别仅在于含水量不同,这些酸能与不同量的碱中和。由此才认识到酸中所含的水的成分不是独立的,而是酸的组成部分,能被置换出的氢是与含氢酸中的氢所处的位置等同。1838年德国人李比希(1803—1873)往事重提,复兴了戴维的含氢学说,赋予酸一个明确的定义:“酸是具有能被置换出氢的化合物”。根据酸中可以被置换出的氢原子的个数决定是一元酸或是多元酸。看似如此简单的一句话,却需要历经百年迷茫,几代科学家的不懈努力,足见攀登科学高峰的艰辛。
现在我们可以理直气壮地说:不论是含氧酸还是无氧酸都含有氢,氢才是显酸性的关键元素。酸的强度由一定浓度的酸的水溶液达到电离平衡时,电离出的氢离子(H+)浓度的大小来决定的。以一元酸HA为例:
HA+H2←↑OH3O++A-(注:H3O+为水合氢离子)
也就是说相同浓度的酸溶液中,氢离子浓度大比氢离子浓度小的酸性要强。
下面我们谈谈周期表中各主族元素的无氧酸(氢化物)的酸性强度的变化规律。
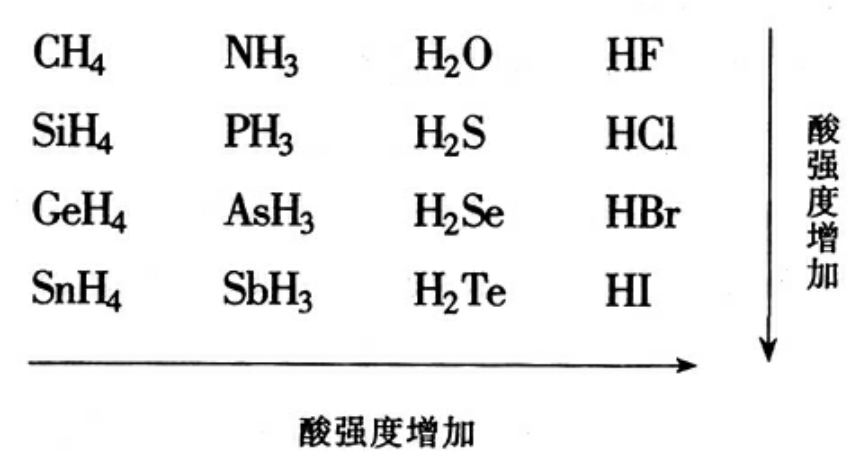
酸的强度取决于HA中A的性质,A元素的负化合价越高,原子半径越小,电负性越大,则A对H+质子吸引力越强,H+越不易电离,酸性越弱。这里有一个陌生的概念——“电负性”。电负性是衡量原子对电子吸引能力大小的一个很重要也很实用的概念,它的定义是:“电负性是元素的原子在分子中吸引电子的能力的一种相对标度”。一些学者根据各自的理论,计算出周期表中各元素的电负性数值,化学手册中可以查到。依据这些数据再配合其他性质可以比较、判断,或说明许多化合物的性质。
我们可以根据以上的原则比较卤族氢化物水溶液的酸性强度:
F Cl Br I
负化合价 -1 -1 -1 -1 相同
原子半径(皮米) 64 99 114.2 133.5 增加
电负性(鲍林标度) 3.98 3.16 2.96 2.46 减少
根据列出的数据,即可一目了然。F的原子半径最小,电负性最大,HF分子中F对共用电子的吸引能力最强,F的周围布满了电子,当然对荷正电的质子H+吸引力很大,使H+不易电离出来,故HF酸性最弱;反之,I的原子半径大,电负性小,对H+的吸引力也小,H+容易电离,酸性最强。其他主族非金属元素形成的非含氧酸(氢化物)的酸性强度也是自上而下依次加强。
同周期的非金属元素氢化物谁的酸性强呢?在CH4、NH3、H2O、HF系列中,按常识判断便可知是HF酸性强,这又为什么呢?也可依照上面的原则进行比较。
C N O F
负化合价 -4 -3 -2 -1减小(按绝对值)
原子半径(皮米) 77 70 66 64减小
电负性(鲍林标度) 2.55 3.04 3.44 3.98增加
因为它们处于同一周期,原子核外电子层数相同,原子半径变化幅度很小,对H+吸引力影响不大。主要是负化合价与电负性两种互相矛盾的因素的“较量”。F原子的电负性大,但其负化合价仅为1,F原子对H+的吸引力不如电负性较小负化合价却为4的C原子,所以HF中H+较易电离,酸性较强。较量的结果是负化合价的因素起了决定作用。
含氧酸可以用通式ROH来表示,R-O之间是共价键,酸的强度决定于R带的正化合价,电负性及原子半径。如果R的正化合价高,电负性大,原子半径小,则R对O周围的电子吸引力强,O周围的电子偏向R,使O对H+的吸引力变弱,酸性增强。
同周期元素的最高价含氧酸从左至右酸性加强:H4SiO4<H3PO4<H2SO2<HClO4
Si P S Cl
正化合价 +4 +5 +6 +7 增加
原子半径(皮米) 117 110 104 99 减少
电负性(鲍林标度) 1.9 2.19 2.58 3.16 增加
按照正化合价、原子半径和电负性的变化趋势,都有利于从左至右酸性的加强。(注:此处不可能有Cl+7、S+6、P+5、si+4存在,只能以酸根的形式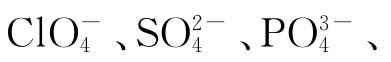
 存在)。
存在)。
同主族、同价态含氧酸自上而下酸性减弱:H2SO4>H2SeO4>H2TeO4
S Se Te
正化合价 +6 +6 +6 相同
原子半径(皮米) 109 117 137 增加
电负性(鲍林标度) 2.58 2.55 2.1 减少
R的原子半径增加,电负性减小,都有利O对H+的吸引,使其酸性减弱。
同一元素不同价态的含氧酸,价态越高,酸性越强:HClO<HClO2<HClO3<HClO4
同一元素同价态,含水量不同的含氧酸,含水量少的酸性强:H3PO4<HPO3,磷酸和偏磷酸的区别在于: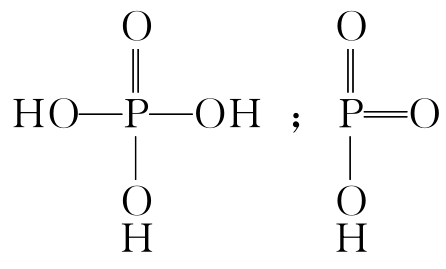 以双键与磷相连的氧原子叫做“非羟基氧原子”,酸分子中非羟基氧原子的数目越多,则酸性越强。因为非羟基氧原子的电负性高,对磷、氧共用电子对有强烈的吸引,使磷周围的电子减少,它就要吸引羟基氧原子的电子,从而减弱了羟基氧对H+的吸引,使酸性加强。非羟基氧原子越多、酸性越强这个原则也适用于前面的几个系列含氧酸强度的比较,这里你自己不妨试着从非羟基氧数目的角度去加以解释。
以双键与磷相连的氧原子叫做“非羟基氧原子”,酸分子中非羟基氧原子的数目越多,则酸性越强。因为非羟基氧原子的电负性高,对磷、氧共用电子对有强烈的吸引,使磷周围的电子减少,它就要吸引羟基氧原子的电子,从而减弱了羟基氧对H+的吸引,使酸性加强。非羟基氧原子越多、酸性越强这个原则也适用于前面的几个系列含氧酸强度的比较,这里你自己不妨试着从非羟基氧数目的角度去加以解释。
掌握了以上这些原则,你能判断出下面这几对含氧酸的酸性强弱吗?
H2SO4和H2SO3
HNO3和H2CO3
H2CO3和H2SiO3希望读者能有一个正确的判断。
将含氧酸的通式写成ROH,看上去更像是碱的通式。的确,如果ROH中是从R-O之间断裂 OH-电离出来,不就是碱嘛!ROH到底是酸式电离(R
OH-电离出来,不就是碱嘛!ROH到底是酸式电离(R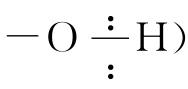 ,还是碱式电离呢
,还是碱式电离呢 这决定于R的正化合价和半径的大小也就是R阳离子的电荷和离子半径。
这决定于R的正化合价和半径的大小也就是R阳离子的电荷和离子半径。
ROH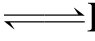 RO-+H+酸式电离
RO-+H+酸式电离
 碱式电离阳离子的电荷越高,阳离子半径越小,R对O的吸引力越强。O对H的吸引力越弱,酸式电离趋势越大;反之,则碱式电离趋势越大。如果把两个因素结合在一起考虑,可用阳离子电荷和阳离子半径的比值作为判断酸或碱的依据。阳离子电荷/阳离子半径=φ(阳离子半径以为纳米单位)
碱式电离阳离子的电荷越高,阳离子半径越小,R对O的吸引力越强。O对H的吸引力越弱,酸式电离趋势越大;反之,则碱式电离趋势越大。如果把两个因素结合在一起考虑,可用阳离子电荷和阳离子半径的比值作为判断酸或碱的依据。阳离子电荷/阳离子半径=φ(阳离子半径以为纳米单位)
当  >10时 ROH显酸性
>10时 ROH显酸性
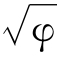 <7 ROH显碱性
<7 ROH显碱性
7<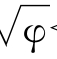 <10 ROH显两性
<10 ROH显两性
第三周期元素

碱或者酸都是金属或非金属氧化物的水合物,同周期元素是从金属性向非金属性的逐步过渡,它们的氧化物水合物的碱性或酸性过渡也类似。那么,同主族的情况如伺呢?你可以第四五主族为例尝试着作出判断。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















