Ⅰ 硫酸铜的制备
实验步骤
1.Cu粉的制备
用台秤称取2.0g铁丝,放入50mL小烧杯中,加入10mL 10%Na2CO3溶液,缓缓加热约10min,去除铁丝表面的油污,然后倒出碱液,用水将铁丝洗干净。用量筒量取30mL烂板液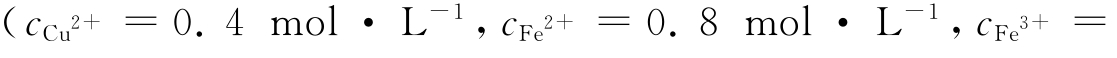
 ,加入上述已去油污的铁丝中,小火加热,搅拌。反应完全后,用夹子取出铁丝,并用蒸馏水洗脱附着在上面的铜粉,然后抽滤,吸干,用台秤称取铜粉的质量。
,加入上述已去油污的铁丝中,小火加热,搅拌。反应完全后,用夹子取出铁丝,并用蒸馏水洗脱附着在上面的铜粉,然后抽滤,吸干,用台秤称取铜粉的质量。
2.氧化铜的制备
将铜粉置于坩埚中,先用小火烘干,防止结块,再用大火灼烧20min左右,并不断搅拌,使Cu充分氧化为CuO。反应完全后,放置冷却。
3.粗CnSO4溶液的制备
根据Cu粉的量计算所需加1mol·L-1 H2SO4溶液的体积,用量筒量取一定体积的1mol·L-1 H2SO4溶液于干净的小烧杯中。边搅拌边将CuO粉慢慢倒入其中,将小烧杯放在石棉网上小火加热,并不断搅拌,得到蓝色的CuSO4溶液。
4.CuSO4溶液的精制
在粗CuSO4溶液中,滴加2mL 3%H2O2溶液,加热,检验溶液中是否还存在Fe2+(如何检验?)。当Fe2+完全氧化后,慢慢加入CuCO3粉末,同时不断搅拌直到溶液pH=3。在此过程中,要不断用pH试纸测试溶液的pH值,直到pH=3。再加热至沸,趁热减压过滤,将滤液转移至洁净的小烧杯中。
5.CuSO4·5H2O晶体的制备
在精制后的CuSO4溶液中,滴加3mol·L-1 H2SO4溶液酸化,调节溶液至pH =l后,转移至洁净的蒸发皿中,水浴加热蒸发至液面出现晶膜时停止。在室温下冷却至晶体析出,然后减压过滤,晶体用滤纸吸干后称重,计算产率。
思考题
(1)在粗CuSO4溶液中Fe2+杂质为什么要氧化为Fe3+后再除去?为什么要调节溶液的pH=3,pH值太大或太小有何影响?
(2)为什么要在精制后的CuSO4溶液中调节pH=l,使溶液呈强酸性?
(3)蒸发、结晶制备CuSO4·5H2O时,为什么刚出现晶膜即停止加热而不能将溶液蒸干?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















