烷烃分子中所有的键都是σ键,所以烷烃的化学性质稳定,在常温下一般不与强酸、强碱、强氧化剂、强还原剂作用。因此,液态烷烃是常用的有机溶剂、润滑剂和化妆品等的基质,固态烷烃常用作金属防腐剂和建筑、铺路的材料。
在适当条件下,如高温、光照(hν)等,烷烃也可以发生氧化、裂化、卤代等反应。
1.氧化与燃烧
烷烃性质比较稳定,很难被常规的氧化剂氧化,即使是酸性的高锰酸钾溶液。但是烷烃在空气中或氧气中易燃烧,生成二氧化碳和水,同时放出大量的热量。
内燃机使用汽油、煤油、柴油作燃料,家庭用天然气作燃料,正是利用了这个反应放出的热量。如果燃烧不充分,则有一氧化碳和炭黑生成,从而造成能源浪费和环境污染。
低级烷烃(C1~C6)蒸气与空气混合至一定的比例时,遇到明火或火花便燃烧而放出大量的热,从而使生成的CO2及H2O急剧膨胀而发生爆炸,这是煤矿中发生爆炸事故的主要原因之一。甲烷的爆炸极限是5.53%~14%,也就是说,甲烷在空气中的比例在此范围内时遇到火花则爆炸;而低于5.53%或高于14%时遇到火花只是燃烧而不爆炸。
2.裂化反应
烷烃在隔绝空气的条件下可裂解生成小分子烃,也可脱氢转变为烯烃和氢气,这种反应叫裂化反应。例如:
工业上一般利用催化裂化把高沸点的重油转变为低沸点的汽油,从而提高石油的利用率,增加汽油的产量,提高汽油的质量。
3.卤代反应
烷烃分子中的氢原子被其他原子或基团取代的反应称为取代反应,被卤素所取代的反应称为卤代反应。
甲烷与氯气在黑暗中不发生反应,但在加热或光照下,甲烷分子中的氢原子会被氯原子取代,生成一氯甲烷和氯化氢,同时有热量放出。
在氯气过量情况下,该反应并不能停止在这一步,生成的一氯甲烷继续与氯气作用,进一步生成二氯甲烷、三氯甲烷(氯仿)和四氯甲烷(四氯化碳)。
CH3Cl+Cl2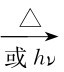 CH2Cl2+HCl
CH2Cl2+HCl
CH2Cl2+Cl2 CHCl3+HCl
CHCl3+HCl
CHCl3+Cl2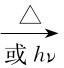 CCl4+HCl
CCl4+HCl
所得产物一般为混合物,但控制反应条件可以使其主要产物为某一种氯代烃。例如,将反应控制在400℃~450℃,CH4和Cl2之比为10∶1时,则主要产物为CH3Cl;若控制CH4与Cl2之比为0.263∶1,则主要产物为CCl4。
其他烷烃的氯代反应与甲烷的氯代反应一样,但对不同烷烃,由于结构的差异,产物较甲烷复杂。例如,丙烷的氯代反应,由于丙烷分子中存在两种氢——伯氢和仲氢,因此可得到1-氯丙烷和2-氯丙烷两种不同的氯代产物。
丙烷分子中有6个伯氢原子和2个仲氢原子,理论上伯氢被取代的机会应是仲氢被取代的3倍,但2-氯丙烷含量反而比1-氯丙烷的含量高,说明仲氢更容易被取代,即活性更强,经计算发现,伯氢和仲氢反应的相对活性比为1∶3.8。
伯氢与叔氢在这种活性上也存在差异,例如异丁烷与氯气反应生成两种氯代产物过程中,伯氢与叔氢的相对活性比为1∶5。
因此,烷烃中各种氢的活性顺序为:叔(3°)氢>仲(2°)氢>伯(1°)氢。上述结论可用键的离解能或自由基的稳定性加以解释。
不同类型氢的离解能不同,3°氢的离解能最小,故反应时这个键最易断裂,所以3°氢在反应中活性最高。
键的离解能/(k J·mol-1)
1°氢 CH3CH2CH2—H410
2°氢 (CH3)2CH—H397
3°氢 (CH3)3C—H380
高级烷烃的氯代反应在工业上具有重要应用。如石蜡、聚乙烯(可以看成相对分子质量很大的烷烃)经氯代反应可以得到氯含量不同的氯化石蜡和氯化聚乙烯,用于高分子材料的阻燃增塑剂以及耐腐蚀、耐磨性涂料。
思考题1-8 已知烷烃分子式为C5H12,根据氯代反应产物的不同,试推测各烷烃的结构并写出结构式。
(1)一元氯代产物只有一种; (2)一元氯代产物可以有三种;
(3)一元氯代产物可以有四种; (4)二元氯代产物只可能有两种。
溴代反应与氯代反应相似,也要在高温或光照下才能进行,并生成相应的溴代产物。但是烷烃的溴代反应比氯代反应转化速率慢。不同卤素与烷烃进行卤代反应的相对活性通常有如下的顺序:F2>Cl2>Br2>I2。
氟代反应是强放热反应,难以控制,会引起爆炸,实际工作中应用不多。
碘代反应是吸热反应,不利于反应进行,同时,生成的碘化氢是还原剂,可使碘代烷再还原成原来的烷烃。因此烷烃的卤代反应通常是指氯代和溴代。
4.烷烃的卤代反应历程
描述化学反应所经历的途径或过程,称为反应历程或反应机理。有机反应历程是根据大量实验事实和逻辑推理得出的。了解反应历程可以正确地分析化合物结构与性能的关系,帮助理解反应,甚至寻找控制反应、提高产率的途径。反应历程已成为有机化学结构理论的重要组成部分。
(1)卤代反应历程 烷烃与氯在暗处不发生反应,但经紫外线照射,反应即开始进行,而且只要吸收一个光子,即可引起数千个烷烃分子进行氯代。此外,如果在反应物中有少量氧存在,则延缓反应进行。基于这些事实,人们认为烷烃卤代反应的历程属于自由基取代反应历程。它的反应历程包括链的引发、链的增长和链的终止三个阶段。现以甲烷氯代反应为例:
①链的引发 在紫外线照射或高温条件下,氯分子形成高能量氯自由基,这个过程称为链的引发阶段:
ClCl 2Cl·
2Cl·
②链的增长 氯自由基不稳定,极易与周围甲烷分子发生反应,生成甲基自由基:
CH4+· →Cl ·CH3+HCl
甲基自由基也很活泼,立刻与周围的氯气作用,生成氯甲烷和氯自由基:
·CH3+Cl →2 CH3Cl+Cl·
氯自由基又与甲烷重复反应,生成甲基自由基,甲基自由基再与氯反应生成氯甲烷和氯自由基,反应多次反复,这个过程称为链增长阶段。
③链的终止 当反应体系中氯与甲烷的浓度很低时,下列某种或某几种自由基间的碰撞机会增加,自由基消失,结束整个反应。这个过程称为链的终止阶段。
·Cl+· →Cl Cl2
·CH3+·CH →3CH3CH3
·CH3+· →Cl CH3Cl
(2)甲烷的卤代反应中的能量变化 化学反应是一个反应物逐渐变为产物的连续过程。在此过程中,反应体系的能量是不断变化的。甲烷的氯化反应是放热的反应,如甲烷生成一氯甲烷的三步反应中,每一步的反应热和活化能数据如下所示:
Cl— →Cl 2Cl· ΔH=+242.4k J/mol ①
CH3—H+Cl →· H—Cl+·CH3ΔH=+7.5k J/mol ②
Ea1=+16.7k J/mol
·CH3+Cl— →Cl CH3—Cl+Cl· ΔH=-112.9k J/mol ③
Ea2=+8.3k J/mol
在链引发阶段只有Cl—Cl键断裂,是一个强吸热(242.4k J/mol)反应,因此需在光照或高温下才能进行。甲烷的氯化反应的反应热可以从②和③的ΔH算出,结果为ΔH=-105.4k J/mol,该反应为放热反应,因此反应是可以自发进行的。但是单纯用反应热来讨论反应活性是不全面的,还必须考虑反应活化能的大小。
化学反应是由反应物逐渐变成生成物的连续过程,这一过程中间需要经历一个过渡态。从反应物到过渡态是能量逐渐升高的过程,达到过渡态时体系的能量最高,此后体系的能量下降。反应物和过渡态之间的能量差称为活化能。
在甲烷的氯代反应中,氯自由基与甲烷分子接近时,H与Cl之间逐渐开始成键,而CH3—H开始伸长,体系能量逐渐上升,到达过渡态时达到最大值。随着H—Cl键的逐渐形成,体系能量不断降低,最后形成平面型的甲基自由基和氯化氢。
甲基自由基与氯分子的反应过程与上述反应过程类似。甲烷的氯代反应过程能量变化如图1-6所示。
图1-6 甲烷的氯代反应过程能量变化曲线图
从图1-6可以看出,第一步的活化能比第二步的大得多,因此第一步反应速率最慢,是甲烷氯化反应中决定反应速率的一步。
活化能的高低决定过渡态的能量。由于过渡态是不稳定的,因此不能分离进行测定。但过渡态的稳定性与形成的中间体自由基的稳定性是一致的,即生成的自由基稳定,过渡态也稳定,反应的活化能就低,化学反应速率就大。而自由基稳定性次序为
叔自由基>仲自由基>伯自由基>甲基自由基
因此,在烷烃取代反应中,优先生成稳定性较高的(叔或仲)自由基。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















