(一)cAMP-蛋白激酶途径
该途径的信息传递过程主要包括:激素与特异膜受体结合,受体变构而被激活,活化的受体激活细胞膜胞浆面的G蛋白,后者进一步激活胞膜中的腺苷酸环化酶(adenylate cyclase,AC),AC催化细胞内ATP生成cAMP,cAMP激活蛋白激酶A(protein kinase A,PKA),PKA直接或间接使多种蛋白质或酶磷酸化,发挥生物学效应。
1.cAMP的生成与分解 信息分子如肾上腺素、胰高血糖素、促肾上腺皮质激素等与特异受体结合,受体活化并使G蛋白由αβγ-GDP活化为α-GTP,α-GTP激活腺苷酸环化酶,激活的腺苷酸环化酶进一步催化ATP生成cAMP。腺苷酸环化酶分布广泛,除成熟红细胞外,几乎存在于所有组织细胞膜上。
cAMP是细胞内最重要的第二信使,正常细胞内cAMP的浓度除与腺苷酸环化酶活性有关外,还与磷酸二酯酶活性有关,磷酸二酯酶催化cAMP降解为5′-腺苷酸。
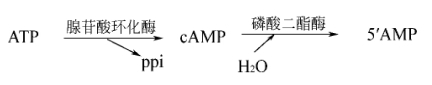
此外,还有少数作用于此途径的激素如生长激素抑制激素等可导致AC活性下降,细胞内cAMP浓度降低。
2.cAMP激活蛋白激酶A cAMP对细胞的调节作用是通过激活cAMP依赖性蛋白激酶(蛋白激酶A,PKA)系统来实现的。PKA是一种别构酶,由两个催化亚基C和两个调节亚基R组成四聚体(C2R2)。每个调节亚基上有两个cAMP结合位点,催化亚基具有催化底物蛋白质某些特定丝氨酸/苏氨酸残基磷酸化的功能。调节亚基与催化亚基相结合时,PKA呈无活性状态。当4分子cAMP分别与两个调节亚基结合后,调节亚基脱落,游离的催化亚基具有蛋白激酶活性(图12-5)。
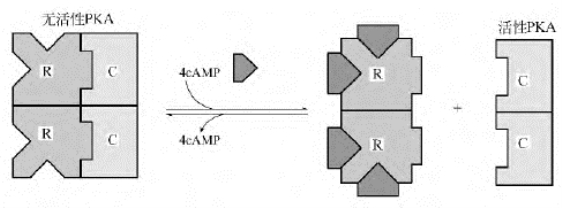
图12-5 蛋白激酶A的激活
3.PKA的作用 PKA被cAMP激活后,能在ATP存在的情况下使许多蛋白质或酶分子特定的丝氨酸/苏氨酸残基磷酸化,从而调节细胞的物质代谢和基因表达。
(1)PKA对代谢的调节:PKA通过对效应蛋白的磷酸化作用调节代谢。如肾上腺素与质膜上的受体结合后,通过激动型G蛋白使AC激活,AC催化ATP生成cAMP,后者进一步激活PKA。PKA能使无活性的磷酸化酶b激酶磷酸化转变成有活性的磷酸化酶b激酶,后者催化磷酸化酶b修饰带上磷酸根,成为有活性的磷酸化酶a,磷酸化酶a催化糖原磷酸解释放1-磷酸葡萄糖,促进糖原分解,使血糖升高(图12-6)。
(2)对基因表达的调节:在基因的转录调控区中有一类cAMP应答元件(cAMP response element,CRE),cAMP可与cAMP应答元件结合蛋白(CREB)相互作用而调节此基因的转录。当PKA的催化亚基进入细胞核后,可催化CREB中特定的丝氨酸/苏氨酸残基磷酸化,磷酸化的CREB与DNA上的CRE结合,从而激活受CRE调控的基因转录。
此外,PKA还可使细胞核内的组蛋白、酸性蛋白及细胞质中的核蛋白、膜蛋白、微管蛋白及受体蛋白等磷酸化修饰,从而影响这些蛋白质的功能。

图12-6 cAMP-蛋白激酶途径信息传递机制
(二)Ca2+-依赖性蛋白激酶途径
Ca2+作为细胞内的第二信使,参与肌肉收缩、运动、分泌、分裂等复杂的生命活动。细胞浆中Ca2+浓度远低于细胞外液和内质网、肌浆网及线粒体等亚细胞器,若某种因素导致胞浆Ca2+浓度急剧升高,可引起某些酶活性和蛋白质功能的改变,从而调节各种生命活动。
1.Ca2+-磷脂依赖性蛋白激酶途径 此途径通过调节细胞内蛋白激酶C(protein kinase C,PKC)活性而进一步调节细胞内的代谢,故又称为蛋白激酶C通路,此通路以生成第二信使二酰甘油(DG)和三磷酸肌醇(IP3)双信号为特征。
(1)DG和IP3的生成与生理功能:涉及此途径的信号分子主要有促甲状腺激素释放激素、去甲肾上腺素、抗利尿激素等,它们能与靶细胞膜特异受体(Gp蛋白偶联型受体)结合。当激素与受体结合后,通过活化磷脂酶C型G蛋白(Gp)激活膜上的磷脂酶C(PLC),PLC能特异性地催化膜组分磷脂酰肌醇-4,5-二磷酸(PIP2)水解为DG和IP3。IP3进入胞浆即与内质网和肌浆网上的IP3受体结合,促使Ca2+通道开放,Ca2+自内质网释放到细胞浆,然后在Ca2+和细胞膜上的磷脂酰丝氨酸的协同作用下,DG与蛋白激酶C结合,激活蛋白激酶C(PKC)。激活的PKC引起一系列蛋白质或酶的磷酸化反应而产生调节作用(图12-7)。
(2)PKC的生理功能:PKC在调控细胞生长分化及其他多种细胞功能上具有重要作用。PKC可催化多种靶蛋白及酶的丝氨酸/苏氨酸残基磷酸化,改变其活性,引起一系列生理、生化反应。PKC还可调节基因表达,影响细胞增殖和分化。
2.Ca2+-钙调蛋白依赖性蛋白激酶途径 钙调蛋白(CaM)为钙结合蛋白,由一条多肽链组成,分子中有4个Ca2+结合位点,当胞浆Ca2+浓度增高时,Ca2+与CaM结合,激活Ca2+-CaM依赖性蛋白激酶,进一步使许多蛋白质的丝氨酸/苏氨酸残基磷酸化,使之活性发生改变(图12-7)。例如Ca2+-CaM激酶既能通过激活腺苷酸环化酶和cAMP磷酸二酯酶,调节PKA的活性,还能激活胰岛素受体酪氨酸蛋白激酶活性。可见Ca2+-CaM在细胞信息传递中起重要作用。
(三)cGMP-蛋白激酶途径
该途径是以鸟苷酸环化酶催化GTP生成第二信使cGMP为特征,故又称为鸟苷酸环化酶的信号转导途径。

图12-7 Ca2+-依赖性蛋白激酶信号转导途径
1.鸟苷酸环化酶与cGMP 鸟苷酸环化酶(guanylate cyclase,GC)广泛分布于人体的各种组织细胞中。按其亚细胞定位和分子结构的不同,可分为两类:一类是存在于细胞膜上的具有鸟苷酸环化酶活性的受体(胞膜受体酶),如心钠素受体,其细胞外区有特异信号分子的结构域,细胞内区有GC结构域。当信号分子特异地与此类受体结合时,受体构象改变激活GC,催化GTP生成cGMP。另一类是存在于细胞质中的可溶性的GC(胞内受体酶),如一氧化氮受体,此类受体可与一些容易穿过细胞膜的非极性小分子物质结合而被特异激活,使胞浆cGMP浓度升高,发挥生理效应。cGMP由磷酸二酯酶催化降解。
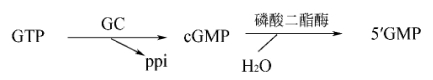
cGMP通过激活cGMP依赖性蛋白激酶,也称蛋白激酶G(protein kinase G,PKG)引发级联反应,产生相应的生物学效应。PKG为单体酶,有一个cGMP结合位点。
2.PKG的生理作用 PKG可引起蛋白质丝氨酸/苏氨酸残基的磷酸化,使特异的蛋白质和酶活性改变,产生生物学效应。PKG在脑和平滑肌中含量较丰富,在神经系统的信号传递过程中具有重要作用。
当心脏血流负载过大时,心房细胞分泌心钠素,心钠素与靶细胞膜上特异的具有鸟苷酸环化酶活性的受体结合,激活GC,GC催化cGMP生成,cGMP再激活PKG,催化蛋白质或酶磷酸化,能进一步产生松弛血管平滑肌和增加尿钠排泄的作用,降低血压。
一氧化氮可与平滑肌细胞内可溶性的具有鸟苷酸环化酶活性的受体结合,激活可溶性的GC,使cGMP生成增加,再通过激活蛋白激酶G,导致血管平滑肌舒张。硝酸甘油等药物在临床上作为血管扩张剂的作用机制就是因为它们能自发地产生NO,升高细胞内cGMP水平,激活PKG,产生松弛血管平滑肌、降低血压的作用。
(四)酪氨酸蛋白激酶途径
该信号转导途径的特征是通过信号分子激活酪氨酸蛋白激酶(tyrosine protein kinase,TPK),进而触发一系列级联反应。该途径与细胞的增殖、分化、凋亡、分裂及癌变有关。
TPK分为两大类:①受体型TPK:即催化型受体,位于细胞膜上,如胰岛素受体、表皮生长因子(EGF)受体、血小板衍生生长因子(PDGF)受体、某些原癌基因编码的受体等。受体型TPK为跨膜蛋白,属于单跨膜α-螺旋受体,其胞外部分为配体结合区,中间有跨膜区,胞内部分含有酪氨酸蛋白激酶的催化结构域。②非受体型TPK:位于细胞质,常与非催化型受体偶联发挥作用,如底物酶JAK(janus kinase)和某些原癌基因编码的TPK。
当配体与受体型TPK结合后,受体的构象发生改变,激活胞内侧的酪氨酸蛋白激酶活性,受体自身的酪氨酸残基发生磷酸化;而非催化型受体的某些酪氨酸残基则被细胞质中的非受体型TPK催化发生磷酸化。酪氨酸磷酸化在细胞的生长与分化过程中,具有重要调节作用。
受体型TPK和非受体型TPK的信息传递途径有所不同,下面分别介绍。
1.受体型TPK-Ras-MAPK途径 该途径的组成成分有:信号分子→受体型TPK→含有SH2和SH3结构域的连接蛋白→鸟苷酸释放因子(如SOS)→Ras蛋白→Raf蛋白→MAPKKK→MAPKK→MAPK→转录因子→调控基因表达,产生生理效应。
当配体与受体结合后,酪氨酸蛋白激酶型受体大多数发生二聚化,受体构象改变,使其中的TPK被激活,受体自身的某些酪氨酸残基发生磷酸化。磷酸化的受体便形成了与含SH2结构域的连接蛋白结合的位点,导致连接蛋白与受体的结合。连接蛋白中有两个SH3结构域,该部位与一种称为SOS的鸟苷酸交换因子结合,使之活性改变,SOS则进一步激活其他一些蛋白和酶:Ras蛋白,有丝分裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)系统,最后将信息传递到细胞核内,导致某些转录因子的活性改变,从而调节基因表达。
Ras蛋白(又名p21蛋白或小G蛋白)是由原癌基因ras编码的膜结合型单体蛋白,性质与G蛋白的α亚基类似。SOS可使Ras活化,活化的Ras蛋白进一步活化Raf,Raf蛋白具有丝氨酸/苏氨酸蛋白激酶活性,可激活MAPK系统。
MAPK系统是一个由蛋白激酶构成的逐级激活系统,包括MAPKKK(MAP kinase kinase kinase)、MAPKK(MAP kinase kinase)和MAPK(MAP kinase),其中以MAPK最为重要。MAPK属于丝氨酸/苏氨酸蛋白激酶,MAPK被激活以后,转移至细胞核内,进一步使一些转录因子发生磷酸化修饰,从而调控基因表达。另外,它也可以使一些其他的酶发生磷酸化而改变活性,调节细胞的功能。
2.JAKs-STAT途径 非酪氨酸蛋白激酶型受体与配体结合后,可与胞内的酪氨酸蛋白激酶偶联,激活JAKs及信号转导子和转录激动子(signal transductors and activator of transcription,STAT),调节基因转录。经此途径作用的信号分子包括生长激素、干扰素、促红细胞生成素等。
此途径最早是在干扰素信号传递途径中发现的。γ-干扰素与受体结合以后,可以导致受体二聚化,二聚化的受体激活JAKs-STAT系统,后者将信号传入核内。JAKs为一种存在于胞浆中的酪氨酸蛋白激酶,它活化后可使受体磷酸化。STAT可以通过其SH2结构域识别磷酸化的受体并与之结合。然后STAT分子亦发生酪氨酸的磷酸化,磷酸化的STAT进入胞核形成有活性的转录因子,调控基因表达。
上述各途径中均有细胞内相应的蛋白激酶催化蛋白质磷酸化。与之相对应,细胞内同时还有蛋白磷酸酶的存在,共同构成了磷酸化与去磷酸化这一重要的蛋白质活性的开关系统。
通过膜受体介导的细胞信号转导除了上述比较重要的四条途径外,还有核因子κB途径、TGF-β途径等,在此不再一一详述。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















