三疣梭子蟹是典型的广盐性蟹类,通过适应和驯化,可以在半咸水和淡水中正常生长。这一特性表明它们具有特殊的渗透压调节能力,从而适应不同盐度的外部环境。因此,三疣梭子蟹的渗透压调节机理是一个很值得研究的基础问题。
盐度胁迫转录组实验中所用三疣梭子蟹取自“黄选1号”核心群体,饲养于昌邑海丰水产有限公司。实验设置3个盐度组,分别为高盐组(HC,盐度50)、低盐组(LC,盐度5)及正常组(NC,盐度33),每组90只。10天后每组选活力正常个体各9只,分别解剖取鳃组织。所取组织迅速浸入RNAlater(Ambion)中于4 ℃冰箱中过夜,之后冻存于220 ℃冰箱。
通过Illumina高通量测序和生物信息学分析共获得1 705个差异表达的基因(qvalue , 0.0.5 & |log2(foldchange)| .1),表明通过新一代测序技术发掘差异表达基因具有较高的效率。其中NC vs LC中发现615个差异表达基因(158上调表达,457个下调表达),NC vs HC中发现1516个差异表达基因(895个上调表达,457个下调表达)。高盐胁迫下差异表达基因显著多于低盐胁迫下差异表达基因,且高盐胁迫下差异表达基因主要为上调表达基因;而低盐胁迫下情况恰恰相反,主要为下调表达基因。另外发现426个基因在低盐和高盐环境中均显著差异表达。为验证转录组差异基因分析结果,挑选12个差异表达基因通过实时定量PCR法进行验证(表2)。结果发现10个基因的表达情况与转录组差异基因分析数据相符,另外两个基因的表达虽然未达到显著差异的程度,但表达趋势与转录组数据相符,表明转录组差异基因分析数据精确度较高。
表2 差异基因验证
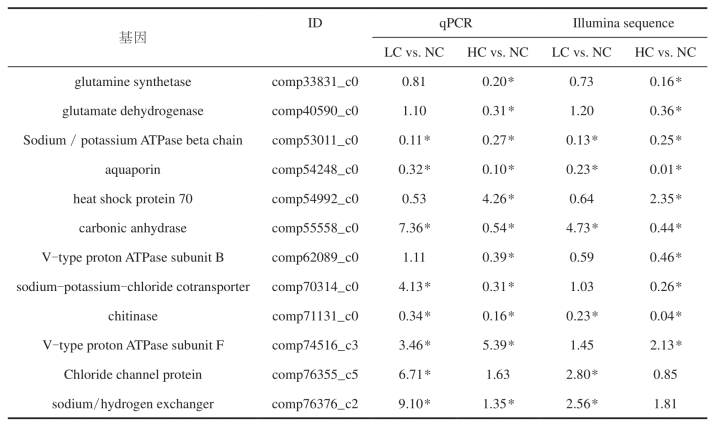
研究表明,甲壳动物的鳃是渗透压和离子调节的主要器官(A. Freire et al,2008;John Campbell Mcnamara et al,2012)。渗透压调节主要通过“限制进程”(limiting process)和“补偿进程”(compensatory process)两个策略进行。所谓限制进程主要指通过关闭气孔或改变鳃角质层脂肪酸组成,调整鳃角质层结构和渗透性,降低离子被动扩散和水流入,以维持机体渗透压稳定,从而短期或长期适应渗透压胁迫环境被认为是甲壳类能长期栖息于不同水环境中的重要机制(Rj Morris et al,1982;R.K. Porter et al,1996)。所谓补偿进程指机体在外界渗透压胁迫刺激下,通过激活离子跨膜转运进程,维持血淋巴渗透压或离子水平,从而平衡由外界渗透压胁迫引起的被动扩散(A. Pequeux et al,1995)。本研究发现在盐度胁迫下至少有5个脂肪酸生物合成相关基因显著上调表达,另外发现大量离子转运相关基因显著差异表达,其中包括氯离子通道、钠氢交换蛋白、钠 / 葡萄糖协同转运蛋白、碳酸酐酶、水通道蛋白、V型质子通道以及5个阴离子转运相关基因,表明“限制进程”和“补偿进程”在三疣梭子蟹盐度适应中均发挥重要作用。除此之外,我们发现了526个差异表达基因无任何注释信息,可能是参与渗透压调节的新基因。这些新基因将为深入研究甲壳类渗透压调节机制提供宝贵数据。
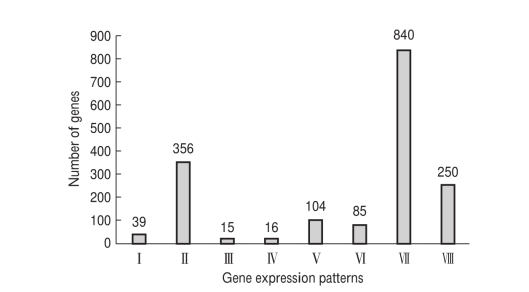
图7 差异基因表达模式
图8 差异表达基因富集分析
进一步将差异表达基因归为8种表达模式(图7)。这八种模式分别为:低盐和高盐胁迫均上调表达(Cluster I,39条unigenes),低盐上调表达(Cluster V,104条unigenes),高盐上调表达(Cluster Ⅶ,840条unigenes),低盐和高盐均下调表达(ClusterⅡ,356条unigenes),低盐下调表达(Cluster Ⅵ,85条unigenes),高盐下调表达(ClusterⅧ,250条unigenes),低盐上调表达高盐下调表达(Cluster Ⅲ,15条unigenes),低盐下调表达高盐上调表达(Cluster Ⅳ,16条unigenes)。将这八种不同模式差异表达基因分别进行富集分析,结果如下(图8);cluster Ⅰ基因富集于几丁质代谢进程(GO: 00060.0.3 unigenes);Cluster Ⅱ基因富集于10个生物学进程,主要包括几丁质代谢(GO:00060.0.13 unigenes)、蛋白聚合(GO:00512.8.6 unigenes)、氧化应激反应(GO:00069.9.4 unigenes)、钾离子转运(GO:00068.3.4 unigenes)等生物学进程;Cluster Ⅲ 基因富集于4个生物学进程,主要包括氧化还原(GO:00551.4.4 unigenes)、脂质代谢进程(GO:00066.9.3 unigenes);Cluster Ⅳ基因富集于5个生物学进程,主要包括氧化还原进程(GO:00551.4.5 unigenes)和蛋白水解进程(GO:00065.8.3 unigenes);. Cluster Ⅴ 基因富集于3个生物学进程,主要包括应激反应(GO:00069.2.5 unigenes)和阴离子转运进程(GO:00068.0.5 unigenes);Cluster Ⅵ基因富集于5个生物学进程,主要包括蛋白水解(GO:00065.8.8 unigenes)和几丁质代谢进程(GO:00060.0.3 unigenes);Cluster Ⅶ基因富集于29个生物学进程,主要包括氧化还原(GO:0055114,72 unigenes)、胞内蛋白修饰(GO:00064.4.50 unigenes)、蛋白水解(GO:0006508,40 unigenes)、磷酸化(GO:00163.0.31 unigenes)等生物学进程;Cluster Ⅷ基因富集于16个生物学进程,主要包括氧化还原(GO:00551.4.27 unigenes)、蛋白水解(GO:00065.8.20 unigenes)、碳水化合物代谢(GO:00059.5.17 unigenes)和几丁质代谢(GO:00060.0.10 unigenes)等生物学进程。
统计发现共有454个差异表达基因富集于63个生物学进程。其中低盐胁迫下差异表达基因共富集于25个进程(6个进程受到诱导,17个进程被抑制,2个进程受到影响)。高盐胁迫下差异表达基因富集于58个进程(31个进程受诱导,24个进程被抑制,3个进程受影响)。进一步分析发现分别有5个和38个进程仅在低盐和高盐胁迫下有差异表达基因富集,另外有20个进程在两种胁迫条件下均有差异表达基因富集,表明三疣梭子蟹低渗调节和高渗调节可能共享一些通路但仍具有较大差异。
研究表明自由氨基酸(free amino acids,FAA)可能在透压调节过程中发挥重要作用,其中甘氨酸,脯氨酸和丙氨酸在很多甲壳动物中发挥渗透调节效应因子功能(D. T. T. Huong et al,2001;Ch Tan et al,1981)。本研究发现很多差异表达基因被富集于氨基酸代谢以及合成进程中。其中甘氨酸代谢过程(glycine catabolic process,GO:0006546)在低盐胁迫中被诱导。在高盐胁迫进程中,甘氨酸代谢过程(glycinemetabolic process,GO:0006544)和 L-丝氨酸的代谢过程(L-serinemetabolic process,GO:0006563)被抑制,但赖氨酸的生物合成过程(lysine biosynthetic process,GO:0009089)被诱导。另外,我们发现大量差异基因被富集于蛋白水解进程(GO:0006508)。有意思的是,低盐胁迫进程中蛋白水解相关基因全部下调表达(11个),而在高盐胁迫中蛋白水解相关基因主要为上调表达(43 个上调和20个下调)。结果暗示,高盐胁迫下三疣梭子蟹通过水解蛋白、加快合成自由氨基酸以及抑制氨基酸代谢等途径增加体内自由氨基酸水平,从而平衡身体内外渗透压水平,降低盐度胁迫损伤;而在低盐胁迫中三疣梭子蟹采取相反的方式进行高渗调节。该结论需后续试验进一步验证。
富集进程中除包含已知与离子转运、自由氨基酸代谢等渗透压调节相关进程外,还包括其他进程,而这些进程以前很少有报道在渗透压调节中发挥作用。本研究发现富集基因数最多的3个进程分别为氧化还原进程(GO:0055114)、胞内蛋白修饰进程(GO:0006464)及磷酸化进程(GO:0016310)。而富集水平最高的3个进程分别为几丁质代谢进程(GO:0006030)、碳水化合物代谢进程(GO:0005975)和小GTPase介导的信号转导进程(GO:0007264)。
氧化还原进程对维持细胞自调节具重要作用。在正常生理状态下,细胞通过产生和消除活性氧和活性氮(ROS/RNS)来维持氧化还原平衡(Dunyaporn Trachootham et al,2008)。一般情况下,体内氧化还原进程处于自稳定状态以确保机体能够正确应对体内外刺激。然而当氧化还原进程自稳定被扰乱时,氧化应激将导致细胞凋亡。研究表明体内、外的刺激均能促使机体形成胞内ROS/RNS,当胞内ROS/RNS水平超出氧化还原调节最大限度后,机体便处于氧化应激状态。本研究发现在盐度胁迫,尤其是高盐胁迫下氧化还原进程被显著诱导,可能是为消除因渗透压胁迫而产生的过量ROS/RNS以减缓机体氧化应激反应。
胞内蛋白修饰和磷酸化进程均属于翻译后修饰调控。翻译后修饰调节存在于很多真核生物蛋白中(Matthias Mann et al,2003)。通过翻译后修饰的蛋白可以暂时或持续改变其功能(Michael Johnston et al,2011)。本研究发现胞内蛋白修饰和磷酸化进程中的很多基因在盐度胁迫进程中显著差异表达,暗示翻译后调节在三疣梭子蟹渗透压调节进程中发挥重要作用,值得开展深入研究。
发现38个差异表达基因富集于几丁质代谢进程且富集程度最高(p-value:1.60E-08),暗示几丁质代谢进程在三疣梭子蟹渗透压调节进程中发挥关键作用。进一步研究发现,这些基因中包含4个几丁质酶基因。甲壳动物在蜕皮过程中必须通过几丁质酶消化旧的几丁质外骨骼。因此,几丁质酶是甲壳动物生长不可或缺的酶。几丁质酶基因属于多基因家族,具多样的生理功能(Y. Arakane et al,2010),在昆虫的生长及发育中发挥重要作用(Qingsong Zhu et al,2008;Jianzhen Zhang et al,2011)。相比昆虫而言,甲壳类几丁质酶研究开展较晚,然而由于其重要性,近几年已成研究热点。目前在中国对虾、凡纳滨对虾、仿长额虾以及日本沼虾中均已开展几丁质酶基因克隆、分类及功能研究(S. Y. Zhang et al,2014;J. Rocha et al,2012;J. Q. Zhang et al,2010;P. Proespraiwong et al,2010;Q. S. Huang et al,2010),结果表明,甲壳类几丁质酶基因至少分三类,可能在甲壳类蜕皮及消化中发挥重要作用。
小GTP结合蛋白在动植物细胞中的很多进程中发挥重要的调控功能,如液泡介导的胞内转运、信号转导、细胞骨架组装以及细胞分裂等(M. Mirzaei et al,2012)。很多研究表明,环境刺激将导致小GTP结合蛋白的表达发生改变。然而,该基因在甲壳动物中的功能很少有研究。本研究发现15个差异表达基因富集于GTP酶介导的信号转导进程,且富集程度很高,表明其可能在三疣梭子蟹渗透压调节中发挥重要作用。另外发现在高盐胁迫下,有17个上调表达基因富集于碳水化合物代谢进程,表明三疣梭子蟹在高盐适应过程中消耗大量能量。
另外,我们注意到氧化应激(GO:0006979)、防御反应(GO:0006952),氧化应激反应(GO:0006979)以及细菌防御反应(GO:0042742)等生物学进程在盐度胁迫中也有差异表达基因富集,其中包括大量免疫及抗逆相关基因如热休克蛋白、组织蛋白酶、凝集素、丝氨酸蛋白酶和过氧化物氧化还原酶等,表明盐度胁迫引发了机体转录水平上的抗逆及免疫反应。本研究结果与Xu et al(2011)在三疣梭子蟹中研究结果一致(Q. H. Xu et al,2011),但与Towle et al(2011)在岸蟹中研究结果不同(D. W. Towle et al,2011)。分析原因可能由于两个物种盐度适应能力不同,或者两个物种具有不同的渗透压调节通路以应对盐度胁迫压力。
(作者:吕建建,刘萍,王渝,高保全,陈萍,李健)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















