第一节 组成生命的元素和化学键
地球上的生物种类繁多,大小和形态结构各异,但在化学组成上基本相同,即生命活动有共同的物质基础,而生命现象的表现则是建立在这些物质的化学现象基础上的。
一、组成生命的元素(element)
生物体中分析得到的各种元素,没有一种是无机自然界所没有的,因此可以说生物界与非生物界在物质组成上具有同一性,也就是说生命物质不存在例外于非生命物质的特殊元素。组成细胞及生物体的主要元素有碳(C)、氢(H)、氧(O)、氮(N)、磷(P)、硫(S)、钙(Ca)等,以上7种元素约占细胞总重的99.35%,其中碳、氢、氧、氮这4种元素约占96%。构成人体的主要元素中氧含量最高,约为65%,存在于绝大部分有机化合物中,参与细胞呼吸,也是水的组成元素;碳含量其次,约为18%,通常能与四个其他原子结合,形成有机分子的骨架;再次是氢,含量约为10%,与氧一样存在于绝大部分有机物中,也是水的组成元素,除此之外,氢离子还与电子及能量的转移密切相关。最后是氮,含量约为3%,是蛋白质及核酸的组成元素。其他元素及功能见表2-1。
表2-1 人体中含量较少的元素及其功能
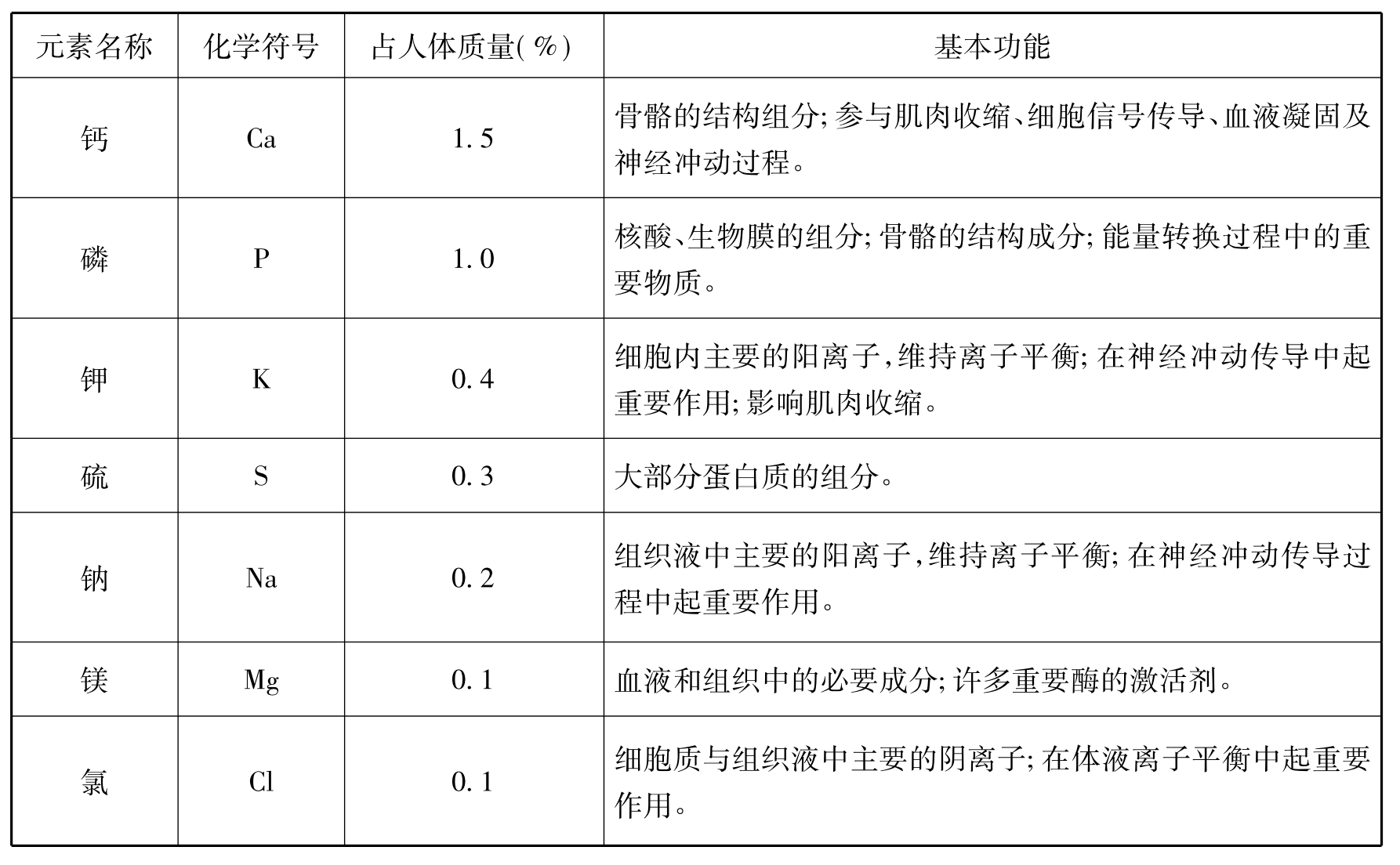
除了表2-1所列出的主要元素外,人体内还含有许多含量低于人体质量0.01%的元素,称为微量元素(trace element),如铁(Fe)、碘(I)、锰(Mn)、铜(Cu)、锌(Zn)、钴(Co)、氟(F)、硼(B)、铬(Cr)、硅(Si)、钒(V)、钼(Mo)、硒(Se)等。组成生物体的元素具有一定的浓度范围,若浓度低于或高于其范围,生命活动便不能正常进行甚至造成中毒或死亡。
二、原子的结构
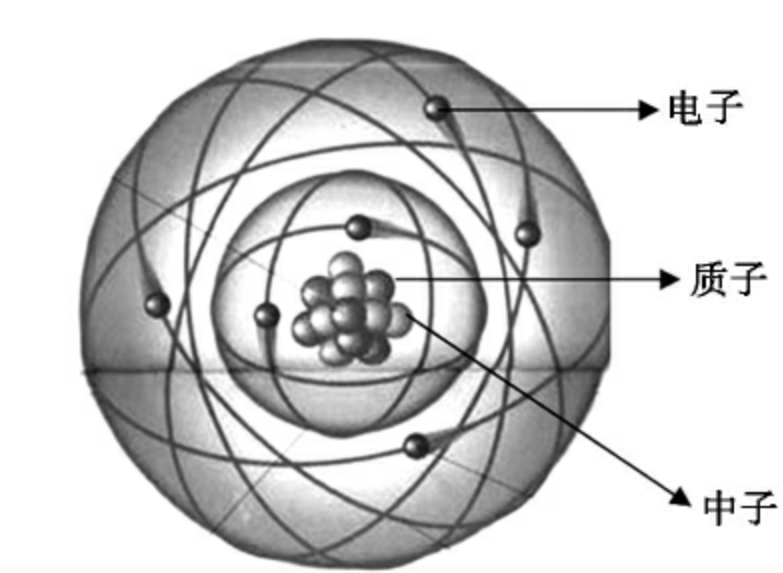
图2-1  原子结构
原子结构
原子核位于原子中心,中央小球代表质子和中子,核外小球代表电子,它们在核外特定轨道上绕核高速运动。
原子的化学性质很大程度上取决于核外电子的分布和运动状态。科学家通过统计电子在核外空间某单位体积中出现的概率密度,发现它们就好像一团带负电荷的云雾笼罩在原子核的周围,称为电子云(electron cloud)。电子在核外空间运动时90%的时间内所存在的特征区域称为原子轨道(atomic orbital)。每一个轨道可最多容纳2个电子。电子的能量大小取决于它们所占据的轨道。例如球形1s轨道离原子核最近,为原子的第一能级,其上电子所带的能量也最低。如氢原子的单一电子或氢分子的两个电子都在1s轨道上。原子的第二能级包括2s轨道和3个2p轨道。4个轨道能级相同,其中2s轨道是直径大于1s的球形轨道,3个2p轨道都是呈哑铃形的。每一个2p轨道的轴垂直于其他2个2p轨道的轴,它们分别用2p x、2p y和2p z来表示(图2-2)。这里x、y、z代表相应的轴。第一能级的1s轨道最多可容纳2个电子,第二能级的2s和2p轨道最多容纳8个电子。在平面上通常用圆环表示不同能级轨道,第二能级圆环在1s轨道外圈,表示其能级高于1s(图2-3)。最外层能级轨道上的电子数目对原子的化学性质影响最大。
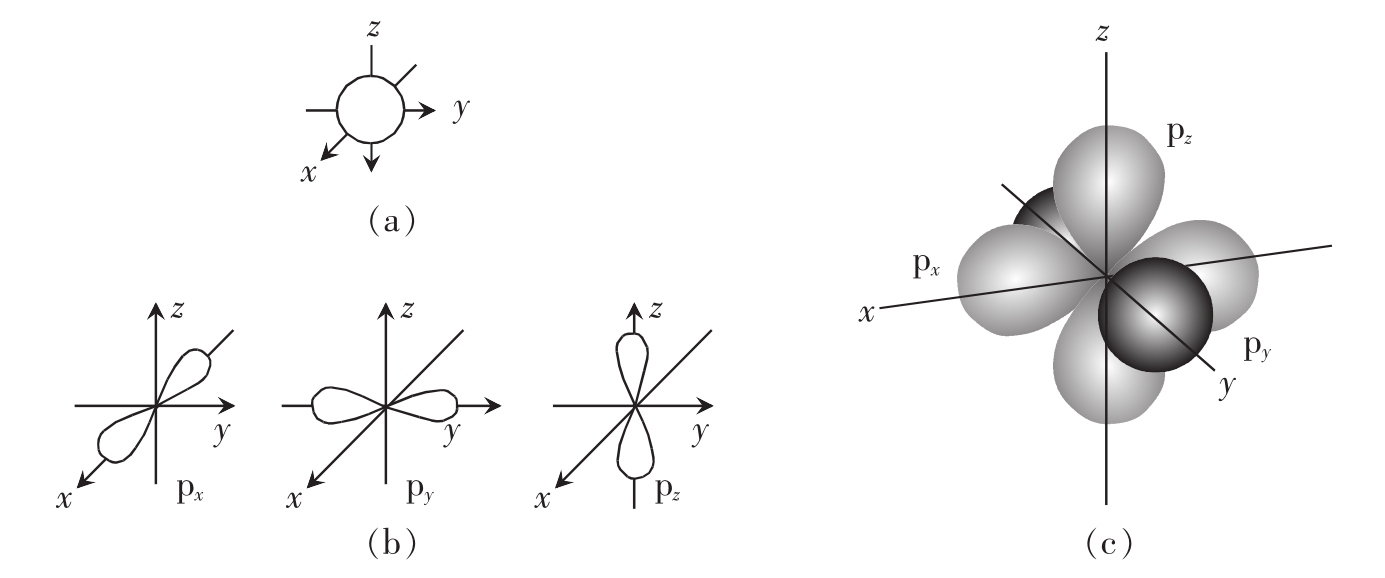
图2-2 原子轨道
(a)第一能级水平包括球形的1s轨道,最多容纳2个电子。(b)第二能级水平包括1个球形的2s轨道,3个哑铃形的2p轨道,每个轨道最多可容纳2个电子,因此最多能容纳8个电子,3个2p轨道轴相互垂直。(c)2p轨道的立体图。
电子按照“能级越低越稳定”的原则优先占据能量较低的原子轨道,整个原子能量最低的状态是原子的基态。如果克服核的吸引力将电子向离核更远的能级轨道上移动,将增加电子的势能,离开基态的电子成为高能电子。同理,电子移向低能级的轨道,降低了其势能,以热的形式释放能量或者释放的能量用来做功。例如在光合作用中,阳光使叶绿素分子中的某些电子激发成高能电子,当跃迁的电子返回原能级时所释放的能量可用于光合作用反应中。在细胞内的生化反应过程中,高能电子可以从一个原子或化合物向另一个原子或化合物转移,失去电子被称为氧化(oxidation),得到电子被称为还原(reduction)。
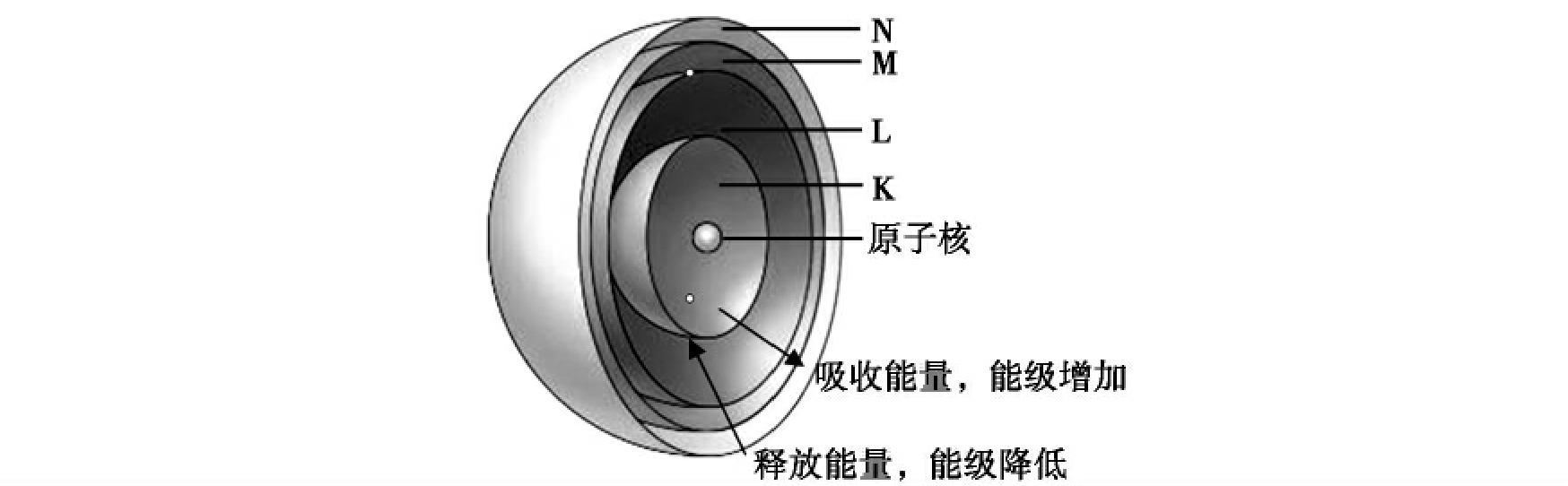
图2-3 电子的能级
K、L、M、N由低到高代表电子的能级水平,其中K代表第一能级,L代表第二能级。离核越近,能级水平越低;离核越远,能级水平越高。电子从低能级向高能级移动需吸收能量,从高能级向低能级移动会释放能量。
三、原子间的相互作用
原子按照一定的顺序排列,相互影响相互作用而结合在一起形成一个整体,称为分子。使原子结合在一起的吸引力叫化学键(chemical bond),是由原子最外层电子相互作用而成的,原子之间通过化学键形成分子。原子的这种排列顺序和相互关系称为分子结构。分子结构是决定分子性质的重要因素之一。
1.共价键
通过原子之间共用电子形成的吸引作用称为共价键(covalent bond)。共价键是有机化合物分子中最主要的、典型的化学键。1916年,Lewis G.N指出,氢原子形成氢分子时,两个氢原子各提供一个电子,通过共用一对外层电子,而结合成共价键。这样在氢分子中两个氢原子都达到电子饱和状态,具有稳定的电子构型。甲烷分子中的碳原子与四个氢原子形成四个共价键而形成稳定的八电子构型。共用一对电子形成的键称为单键。若共用两对或三对电子则分别构成双键和三键。例如形成氧气的两个氧原子共用两对外层电子,形成双键。不同原子对形成共价键的电子所产生的吸引力不同,共用电子更偏向于吸引力大的那一方,这样的原子之间形成的共价键称为极性共价键(polar covalent bond),例如C-H键。而相同的原子对形成共价键的电子所产生的吸引力相同,整个分子的正电荷中心和负电荷中心重合,这样的原子之间形成的共价键为非极性共价键(nonpolar covalent bond),如H2和O2中的共价键。但含有极性共价键的分子不一定是极性分子,如甲烷(CH4)分子。因为C以正四面体方向与4个H形成共价键,4个C-H键极性相互抵消,整个分子没有了极性,成为了非极性分子。
2.离子键
原子之间由于正负电荷强烈的静电作用而形成稳定的分子结构,这种原子间的作用力称为离子键(ionic bond)。而这种正负电荷的形成是由于原子获得或失去外层电子后变成带电荷的粒子,称为离子(ion)。外层具有5、6、7个电子的原子,有从其他原子获得电子的倾向,获取电子后,这些原子的核外电子数大于核内质子数,即核外负电荷大于核内正电荷,所以这些原子带负电荷,为负离子。外层具有1、2、3个电子的原子,倾向于失去电子。失去电子后,这些原子带正电荷,为正离子。如NaCl分子中Na+与Cl-之间形成的离子键就是由于Na原子失去一个电子,Cl原子夺取一个电子,两离子之间由于正、负电荷的吸引而形成离子键。
四、分子间相互作用
除上述共价键和离子键等原子间的相互作用之外,在分子之间还存在着氢键(hydrogen bond)、范德华力(van derWaals’forces)和疏水作用(hydrophobic interaction)等。氢键产生的原因是当氢原子与氧原子或氮原子等电负性很强的原子以共价键结合时,电子云会偏向电负性较大的原子,使氢原子介于原子和氢正离子之间,呈部分正电性状态。这种氢原子往往与其他负电性强的原子间发生静电吸引而形成氢键。氢键可形成于不同分子之间,例如,水分子与氨分子之间形成的氢键。也可形成于同一分子之内,例如构成蛋白质的氨基酸之间羰基和氨基间形成的氢键。氢键与共价键和离子键相比属于一种弱键,易于形成也易于断开,并有特定的键长与键角,在决定大分子的三维结构上起着重要作用。例如维持蛋白质和核酸等的立体结构,是生命系统中十分重要的化学键。范德华力是分子十分接近(相距0.3~0.4nm)时彼此之间由于电子云的相互作用而产生的吸引力。疏水作用是一些不溶于水的非极性分子基团之间的相互作用。是由于水分子之间形成极多的氢键,而将非极性分子驱赶到一起,使不溶于水的非极性分子基团在水中趋向于聚集。所以范德华力和疏水作用都较弱。这种分子之间的相互作用可以是短暂的,如甲烷分子之间只通过范德华力结合在一起,因此它的沸点很低,只有-161.5℃,在室温时是气体。范德华力及疏水作用在生命过程中有时也起着重要作用。例如范德华力在非极性分子之间起重要作用;疏水作用是大分子折叠的主要驱动力,也是酶与底物结合及其他生命系统分子之间相互关系的重要驱动力。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














