第二节 RNA干扰技术原理与方法
RNAi技术主要包括了siRNA的设计、制备与转染。siRNA的设计已有一些规律可循,但还需要筛选;siRNA的制备主要通过化学合成和基因工程技术来完成;转染技术包括直接导入法、脂质体介导法和病毒载体法,转染效率还有待进一步提高。
一、RNAi技术的优势
RNAi技术具有高度的特异性,它可以用于研究单基因功能或基因家族或具有高度相似性的一组基因中的单个基因的功能,还可以同时敲除基因家族中几个相关基因,从而解决了由于多个基因的功能冗余而造成的难以检测到单个基因突变表型的问题。与反义RNA技术相比,RNAi技术的沉默效率更高,效果更好。如果采用具发夹结构(hairpin RNA,hpRNA)的类似shRNA,具有稳定的特点,不仅可用在哺乳动物细胞上,还可用在整个动物上的基因功能进行深层次的研究。Wesley等发现使用含有内含子的发夹RNA(ihpRNA),沉默效率可以达到90%~100%;采用诱导性表达的shRNA,可以研究基因失活产生的即时效应,避免了由于靶基因持续性失活所带来的一系列间接效应或由于适应性造成的干扰或者假象;利用细胞特异性启动子,也可以研究特定基因在不同器官中的功能。总之,RNAi技术较传统的转染实验简单、快速、重复性好。
二、RNAi的研究策略
进行RNAi研究的技术路线包括4个步骤:①选取目的基因和设计相应的siRNA序列;②制备siRNA;③转染siRNA或siRNA表达载体;④分析RNAi效果。
1.siRNA的设计与筛选 双链siRNA序列的设计和合成是进行RNAi研究的关键。研究发现,对于哺乳动物细胞,最有效的siRNA为21~23bp大小、3′端有两个突出碱基的双链RNA。双链siRNA的设计通常遵循Tuscl原则,即以mRNA开放阅读框区域作为靶点,从启动子下游50~100bp处寻找理想的靶序列,不将3′和5′端非翻译区或启动子作为靶点,因为这些区域有许多调节蛋白结合位点,调节蛋白会与RISC竞争结合靶序列,降低siRNA的基因沉默效应。最有效的siRNA设计序列为19nt+dTdT或UU,在70%~80%哺乳动物细胞中有效。具体过程如下:①扫描靶基因的AA序列,使siRNA的3′端为dTdT,可增加siRNA对核酸酶的抗性;②从启动子下游约75bp处开始寻找第一个AA序列,以该序列后的19个碱基作为目的序列,一般设计4~5个siRNA序列,G/C含量30%~70%(50%最为理想),应避免3个连续鸟嘌呤;③在Genebank中用Blast软件查对,确保靶序列与其他基因序列没有同源性。
虽然已有的siRNA设计和筛选规则可作为普遍性的指导,但它们不能保证每一个筛选的siRNA都起作用。据观察很多情况下针对一个基因的siRNA或shRNA设计是无效的。平均计算,5个针对靶区域的待选siRNA/shRNA中只有一个能有效地使目的基因沉默。siRNA在体内的不稳定性,不能与RNAi的组成成分及靶mRNA相互作用等都可能成为siRNA不起作用的因素。有人提出了混合鸡尾酒法,即利用较长编码目的mRNA的cDNA为模板,体外转录制备200~1000bp的长siRNA,然后用RNA酶Ⅲ(或Dicer)裂解,得到许多不同序列的siRNA,在除掉没有被消化的长链dsRNA后,将得到的混合物转染细胞,达到抑制靶基因的目的。这种方法经济快捷,但有可能诱发非特异性基因沉默。
目前已采用多种方法来筛选具有生物学潜力的siRNA寡核苷酸链,包括体外转录RNA的非细胞筛选、寡核苷酸文库和RNA酶H的体外翻译筛选和mRNA与寡核苷酸芯片杂交筛选。最近,还出现了设计程序软件筛选siRNA的方法。这些方法能筛选出与靶mRNA结合最牢固的siRNA寡聚核苷酸链,我们假设结合最牢固的siRNA寡核苷酸链其抑制作用也最强。下面以重组质粒方法为例说明如何进行筛选。
将靶基因全长或一部分的cDNA序列插入到3′非转录区域,将报告基因融合到目的基因序列的N端或C端,构建重组质粒。每一检测的重组体具有相同的启动子,表达相同的产物,且产量相近。使用的报告基因通常有增强的绿色荧光蛋白(EGFP)、红色荧光蛋白(RFP)、增强的青荧光蛋白(ECFP)、增强的黄荧光蛋白(EYFP)和荧光酶等。这些重组体与针对靶基因各个不同区域的个体siRNA共同转染到哺乳动物细胞中。如果某个siRNA可有效地与靶点结合并使相应的mRNA表达受到抑制,报告基因的表达就会显著下降。相反,如果siRNA不能有效地与靶点结合,报告基因的表达就不会有明显的变化。因为荧光素和酶的活性均可被量化,因而可通过一个准确的量化过程来快速识别能有效抑制靶基因表达的siRNA/shRNA。
2.siRNA的制备 有体外和体内两类方法,前者包括化学合成法和体外转录法;后者包括siRNA表达载体法和siRNA表达框架法。
(1)化学合成法:化学合成可由多家公司直接提供服务,虽然费用高,但其性价比优于其他方法,成为许多研究者获取siRNA的一种主要方法。化学合成没有序列和长度的限制,方法直接,产量可控。目前使用的siRNA化学合成方法有3种,即2′-t-丁基甲基甲硅烷基(2′-t-BDMS)法、2′-O-三异丙基甲硅烷氧甲基(2′-TOM)法和2′-乙酸氧乙氧基(2′-ACE)法。3种方法都可产生21个核苷酸siRNA双链,但每种方法均有其局限性,正在逐步改进中。化学合成法最适用的情况是:已经找到最有效的siRNA序列,需要大量的siRNA进行研究。
(2)体外转录法:通过体外转录合成siRNA,成本相对化学合成法而言比较低,而且体外转录得到的siRNA毒性小,稳定性好,效率高,一般只需化学合成的siRNA的1/10就可以达到同等的效果。这类方法主要适用于筛选多种siRNA,以及化学合成的价格成为障碍时。目前体外生物合成siRNA的方法主要有两种:①应用T7RNA聚合酶从DNA模板上转录RNA;②应用重组Dicer或细菌RNaseⅢ将长dsRNA呈递为siRNA。两种方法都是利用体外转录系统合成siRNA,DNA模板可来源于质粒、PCR产物、寡核苷酸链,包含启动子及选定的siRNA基因序列,将DNA模板与启动子引物退火结合,在DNA聚合酶作用下合成dsDNA模板,然后利用RNA聚合酶体外转录,经RNA酶(如Dicer)剪切和去除5′端引导序列后产生21~23nt siRNA。T7或SP6RNA聚合酶为常用的酶,其转录系统模板包括T7或SP6启动子和转录序列,转录序列为19nt(或20nt)再加2nt,在正义RNA链中这两个核苷酸可以是任意的核苷酸,但在反义RNA链中必须与靶序列互补。特异性正义引物形成正义RNA链,特异性反义引物形成反义RNA链,然后复性成双链RNA。在转录体系中加入了5′前导序列,需要应用DNase除去,产物要用Sephadex柱纯化。
体外转录方法的局限性在于其大劳动量与低产出。设计、合成与序列证实的技术要求严格,特别对于短RNA寡聚物来说,易于形成二级结构,可抑制聚合酶活性和干扰互补链的复性。体外转录的另一个局限性是难以引入特异性修饰,使其应用受到很大的限制。最终产物的纯化和处理,包括除去不完全的转录产物和易于被RNA酶降解,均影响了体外表达法的使用。因此又发展了体内表达法。
(3)siRNA表达载体法:体内siRNA表达法包括siRNA表达载体法和siRNA表达框架法。siRNA表达载体法的主要思路是:应用基因工程方法将siRNA对应的DNA双链模板序列克隆入载体的RNA聚合酶Ⅲ(polⅢ)的启动子后,这样就能在体内表达所需要的siRNA分子。选用polⅢ启动子的原因在于polⅢ总是在离启动子一个固定距离的位置开始转录合成RNA,在遇到4~5个以上连续的U时即终止,非常精确。
基于启动元件的组成和它们相对的转录起始位点,polⅢ启动子被分为3个不同类别(Ⅰ、Ⅱ、Ⅲ类)。Ⅲ类启动子中被广泛应用于siRNA表达载体的有人U6小核酸RNA和人组蛋白H1启动子,U6和H1具有一个紧凑和相对简单的组成,转录以一段4~6个U结尾,产生小RNA转录本具有固定的3′突出。Ⅱ类启动子,包括tRNA启动子,广泛应用于表达核糖体和反义RNA。用一种修饰过的人tRNAmet源性的启动子(MTD)来启动短发夹结构RNA(shRNA)的表达,可使表达提高100倍以上。发夹结构RNA由长双链RNA组成,被证明可有效地在植物、线虫、果蝇和哺乳动物细胞中诱导稳定的基因沉默。由于长于30bp的dsRNA在哺乳动物细胞中可引发一种非特异性的抗病毒样免疫反应。因此,一般设计27bp长度的发夹结构RNA,即21nt特异序列和6nt套索。
人H1启动子和各种人U6启动子(U6、U6+1和U6+27)由Hela细胞基因组DNA PCR扩增而得。MTD启动子由重叠延伸PCR产生。包含PCR产物的每种启动子克隆入穿梭载体pCMV-MCS的NotⅠ位点,一个抗新霉素的复合体包含SV40早期启动子和SV40poly A信号,插入pCMV-MCS的BgⅢ和ChⅠ位点间,最终siRNA表达元件亚克隆至pAAV-MCS的NotⅠ位点(图11-3)。P171该载体转染后即可在体内表达siRNA。
![]()
图11-3 shRNA表达元件
采用siRNA表达载体法的优点在于:①将合成siRNA的过程转移到细胞内,排除了RNA酶的干扰,延长了siRNA的半衰期;②由于载体可以复制扩增,降低了成本;③可采用稳定表达的细胞株的筛选和载体的复制扩增,基因抑制效果能够传代。但这种方法制备时间长,效率也较低,于是又设计了siRNA表达框架法。
(4)siRNA表达框架法(siRNA expression cassettes,SECs):是一种由PCR得到的siRNA表达模板,包括一个RNA聚合酶Ⅲ启动子、一段发夹结构siRNA、一个RNA聚合酶Ⅲ终止位点。它能够直接导入细胞进行表达而无需先克隆到载体中。PCR的5′端引物为通用引物,与人U6启动子的5′端互补,3′端引物有几种不同设计,如图11-4所示:①两种3′端引物,引物的前端与U6启动子的3′端互补,其后半部则带有siRNA的正义或反义序列、终止子序列(6个脱氧腺苷,Ter)和一段短的填充标签序列,包含后期可能克隆所需限制性内切酶位点[图11-4(1)];②两种3′端引物,引物1带有正义链和一个9nt的套索,引物2与套索互补并带有反义链和Ter序列[图11-4(2)];③单一3′端引物带有正义链、一个9nt的套索和反义链、Ter和标签序列[图11-4(3)]。3′单一引物相当长,可能会导致反应困难,但该方法有利于直接转染PCR产物,因为它降低了因PCR而导致siRNA序列突变的可能性。
和siRNA表达载体法不同的是,SECs不需要载体克隆、测序验证等颇为费时的步骤,可以直接由PCR得到,不到一天就可完成。因此,是siRNA的筛选工具,可作为构建高效的体内转录载体进行RNAi研究的预实验,对不同宿主细胞优化筛选转录启动子和siRNA序列。如果在PCR两端添加酶切位点,那么通过SECs筛选出来的siRNA可直接克隆到载体中。SECs的主要缺点是PCR产物转染较困难。
3.siRNA的转染 将siRNA、siRNA表达载体或SECs导入哺乳动物细胞中是诱导RNAi的关键,有许多转染方法可选用,最常用的是脂质体转染法和电穿孔法,还有直接注射法。近年来受到人们重点关注的是病毒载体,利用病毒载体可以解决质粒转染效率低、效果不稳定和某些类型细胞不能转染等问题,从而扩大RNAi的应用范围。常见病毒载体有腺病毒载体、反转录病毒载体和慢病毒载体等。腺病毒是无包膜的线性双链DNA病毒,可以高效地转导不同类型的哺乳动物组织细胞,但不整合到宿主细胞基因组中;反转录病毒属于正链RNA病毒,宿主范围广,感染效率高,并能稳定整合到宿主细胞基因组中,但其只能感染分裂细胞。慢病毒载体具有更显著的优点:①既能感染增殖细胞,也能感染非增殖细胞;②可通过感染胚胎干细胞制备RNAi转基因动物。另外,对于在血液细胞内表达的靶基因,可以通过用造血干细胞移植的手段实现siRNA的导入。
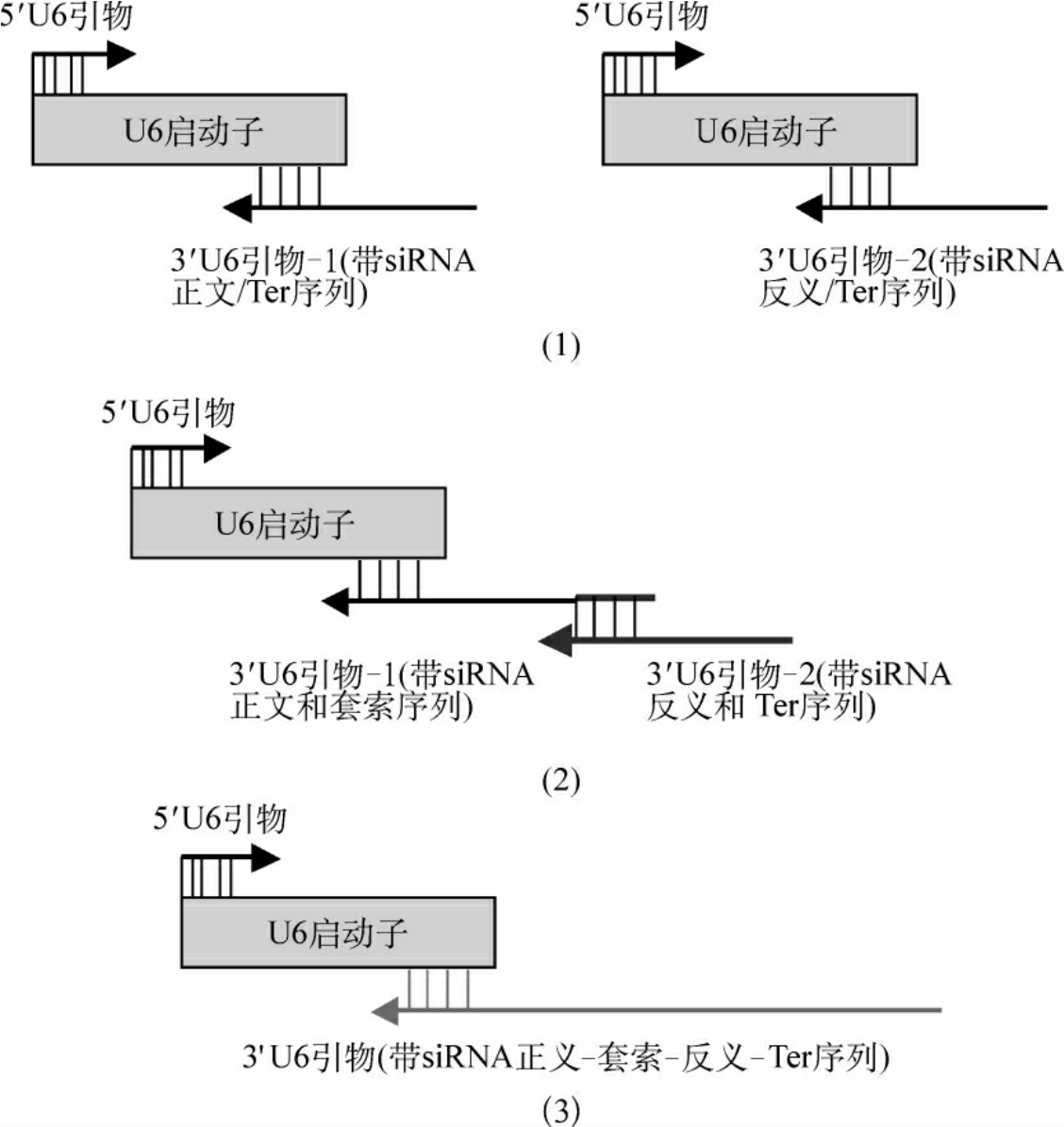
图11-4 siRNA表达框架法RCR引物不同设计
4.RNAi的效果分析 RNAi的效果主要通过mRNA和蛋白质两个方面进行。检测靶基因mRNA表达水平可采用RT-PCR、定量PCR和Northern杂交等。蛋白质水平的检测分析方法有Western印迹、ELISA、流式细胞术等。此外,还可以通过相差显微镜和扫描电镜观察细胞的表型变化。RNAi最终效果应该是在体的表型变化。
三、影响RNAi效果的因素
1.siRNA设计与合成 RNAi的靶位点往往分布于整条mRNA链上,而真正有效的特异靶点是十分稀有的。离靶点越远,抑制效果越差。siRNA与靶点的即使是单个碱基的不配对,也会明显降低RNAi效果。因此,siRNA的设计是首要的影响因素。其次,靶基因在复制过程中突变也会妨碍siRNA对靶序列的识别,因此须针对靶序列保守区域设计siRNA。
2.转染途径及其效率 siRNA可通过脂质体转染、电穿孔、微注射、共沉淀、共培养及病毒载体等方法导入细胞。还可以采用静脉注射途径。对于同一细胞系,使用不同的转染试剂或方法,其效率往往会有所不同;而对于不同的细胞系,使用同一种转染试剂或方法,效果亦会不同。因此在实验过程中,有必要尝试多种试剂或方法来确定最优条件。转染效率可通过测定细胞的密度、转染的时间和siRNA与转染试剂的比例来评价。
一般通过设立阳性和阴性对照来衡量效果。设立阳性对照目的是通过检测不同浓度的siRNA的转染效率及其最终干扰效果,来确定合适的转染条件和最低有效的siRNA浓度。有实验表明RNA诱导的沉默复合物具有饱和性,且过多siRNA会导致细胞毒性和死亡。对于大多数细胞,管家基因如β-肌动蛋白、磷酸甘油醛脱氢酶(GAPDH)等是较好的阳性对照。针对这些基因的高效siRNA序列已有报道。还有MAPK1siRNA也是一种阳性对照。阴性对照是用来检测siRNA的特异性,通常作为阴性对照的siRNA与选中的siRNA序列有相同碱基组成,但与靶mRNA无明显同源性。阴性对照的siRNA序列设计有两种方法。一是将特异性siRNA的序列打乱,但要保证与其他基因没有同源性;另一种是在特异性siRNA中引入几个错配碱基。
3.细胞类型 不同类型细胞对siRNA的转染及其抑制效果往往不一样,最常用于RNAi的哺乳动物细胞为HeLa细胞。在HeLa细胞中,可同时敲除核有丝分裂装置蛋白和Lamin,而敲除CD4、CDS细胞、造血干细胞表面标记蛋白则较困难。
4.目的基因的活跃程度 高效转录的基因一般较低表达基因更难被siRNA抑制,不过有些转录活跃的基因如肌动蛋白也可通过RNAi减少表达,甚至影响到表型的程度。
5.蛋白质的稳定性 RNAi一般在18小时内可见到效应,但半衰期长的蛋白质需要更长时间。RNAi一般可持续3~5个细胞倍增,7~10个细胞间期恢复正常。但不分裂的细胞可持续更长时间。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















