地层中的分子化石在诸多领域得到了广泛应用。相反,在地层划分和对比上,其潜力还有待挖掘。在利用分子化石进行地层的划分与对比时,首先要查明分子化石的分布特征及其与生物、环境、气候变化之间的关系。在此基础上,分辨出重要的可能具有全球意义的各类生物事件和环境事件,并结合生物地层学资料,以各类事件为标志,进行比较可靠的高精度的地层划分和对比。
然而,如前所述,目前分子地层学还没有明确的地层单位,难以进行实质性的地层划分与对比。虽然油气地球化学领域的源-源、油-源和油-油对比实质上是利用分子化石分布的相似性或某些分子化石的特性进行的,但也没有明确的地层单位概念。在沉积有机地球化学领域,提出了有机相或沉积有机相的概念,它与层序地层相结合,可以进行高分辨率的地层划分和对比。虽然分子地层学也可以沿用这一概念,但不能体现出分子地层学的特性,因为有机相的划分不仅仅是考虑分子有机地球化学特征,还考虑其他有机地球化学乃至沉积学特征。
我们建议,分子地层学可以沿用生物地层学中“生物带”的概念,以“分子化石带”作为分子地层的单位。生物带中包括了延限带、顶峰带、组合带等,分子化石带也可以这样用。分子化石的延限带表示某类分子化石在地层中的分布范围,顶峰带表示某类分子化石的最高丰度带,组合带则表示某些特征分子化石的组合。值得注意的是,分子化石不能像传统生物化石那样可以与生物的种属直接联系起来,在大多数情况下,其时代意义不明显。因此,分子化石带的应用(也即分子地层的划分和对比)必须在详细生物地层或者其他年代学方法的框架下进行。分子化石带的对比可以直接利用分子特征进行对比,也可以利用分子特征反映的生物学(例如蓝细菌)、环境(如氧化还原、盐度等)和气候(如利用长链烯酮不饱和度计算的古温度)等信息进行对比。下面分别以具有详细生物地层框架的浙江长兴煤山二叠纪-三叠纪界线地层,以及具有很好的年代学框架的第四纪泥炭为例,探讨高分辨率分子地层工作。
17.4.1 浙江长兴煤山二叠纪-三叠纪界线附近的分子地层
17.4.1.1 样品处理和仪器分析
样品采自浙江长兴煤山二叠纪-三叠纪T/P界线B剖面第23层至第34层底部,紧邻全球T/P界线层型与点(即“金钉子”)剖面。所研究地层的岩性包括灰岩(第23和第24层)、灰白色火山黏土岩(第25、28、31、33层)、纹层状富含有机质的钙质黏土岩(第26层)、泥灰岩(第27层)、灰色富含有机质的页岩和泥灰岩(第29、30、32、34层)。
岩石样品除去表面污染物,干燥,粉碎至100目以下,用三氯甲烷作为溶剂在索氏抽提器中抽提72h,减压旋转蒸发浓缩至1ml,可溶组分经硅胶柱层析,用正己烷和苯作洗脱剂依次分离出饱和烃组分和芳烃组分,分别进行气相色谱、气相色谱-质谱联用仪分析。饱和烃经尿素络合物除掉支链和环状化合物后进行单体碳同位素分析。各类仪器的分析条件请参阅Xie et al.(2005,2007)、Huang et al.(2006)、黄咸雨等(2007)。
17.4.1.2 分子化石分布特征
有关浙江长兴煤山T/P界线附近的各类分子化石已作了详细报道,这里不再详述。主要的烷烃分子化石包括C14-C35正构烷烃,C15-C21规则类异戊二烯烷烃(包括植烷、姥鲛烷),C19-C29三环萜,C24四环萜,C27-C35藿烷,C28-C32 2-甲基藿烷、3-甲基藿烷,C29-C33莫烷、伽马蜡烷,C27-C29规则甾烷。长兴组正构烷烃单体碳同位素变化于-26.3‰到-31.6‰范围,殷坑组正构烷烃单体碳同位素变化于-25.1‰到-36.2‰范围。它们的分布特征和生物学、环境意义请参阅Xie et al.(2005,2007)、黄咸雨等(2007)。
芳烃组分繁多,主要包括C12-C23 2-烷基-1,3,4-三甲基苯系列、C40 isorenieratane (异胡萝卜烷)、萘系列(萘,C1-萘,C2-萘,C3-萘)、菲系列(菲,C1-菲,C2-菲,C3-菲)、芴系列(芴,甲基芴)、二苯并呋喃(氧芴)、二苯并噻吩(硫芴)、苯并萘并噻吩、荧蒽、芘等。它们的分布特征和生物学、环境意义请参阅Huang et al.(2006)、黄咸雨等(2007)。
一些主要分子化石参数在地层中的分布规律综合如图17-3所示。
17.4.1.3 分子地层的划分与对比
因分子化石种类众多,分子化石带的划分必须要有明确的生物学或环境意义,而且不同层位分子化石带有明显的区分,尽可能具有全球性或区域性特征。这样,根据分子化石的分布特征和其所具有的生物学、环境意义,可以明显地把第24层和第27层划分出来(图17-4),这两层与其他层位明显不同,以具有高含量的来源于绿硫细菌的分子化石为特征,可称之为“2-烷基-1,3,4-三甲基苯或isorenieratane带”。同样,第26层和第29层上部以具有高含量的来源于蓝细菌的分子化石为特征,可划分出“2-甲基藿烷带”。第25层以高含量的伽马蜡烷为特征,可称为“伽马蜡烷带”。这些分子化石带相当于生物地层学生物带中的顶峰带。
第23层以高含量的姥鲛烷(较高的Pr/Ph值)和二苯并噻吩(较高的DBT/P值)为特征,可称为“姥鲛烷-二苯并噻吩带”。相反,第28 29层以及第31层以上,以高含量的植烷(较低的Pr/Ph值)和菲(较低的DBT/P值)为特征,可称为“植烷-菲带”。这两个分子化石带相当于生物带中的组合带。
分子地层反映出煤山T/P界线地层存在两类重要的可能具有全球性的地质事件,以此可以进行区域性乃至全球范围内的地层对比:根据第26层分子化石2-甲基藿烷带所反映的蓝细菌繁盛情况,Farabegoli et al.(2006)把意大利Bulla剖面T/P界线附近的钙质微生物岩与之进行对比。Grice et al.(2005)根据绿硫细菌的分子化石2-烷基-1,3,4-三甲基苯和isorenieratane(异胡萝卜烷),把煤山剖面的第24层与澳大利亚Perth盆地的T/P界线具有同样绿硫细菌分子化石的地层相对比。
17.4.2 第四纪泥炭沉积的分子地层
17.4.2.1 样品处理和仪器分析
从英格兰北部Bolton Fell泥炭中部取出一根40cm长的泥炭岩芯,分析前储存在-20℃的冰箱中。为了避免污染,去除岩芯外层。按1cm间隔分割岩芯并连续采集样品。该泥炭岩芯顶部30cm采用210 Pb定年。本泥炭岩芯顶部30cm的沉积速率为1.8mm/a,2倍标准偏差(2σ),为1.3~2.8mm/a。底部10cm的沉积速率也看作不变。这样该泥炭顶部40cm经历的时间约为距今220年。
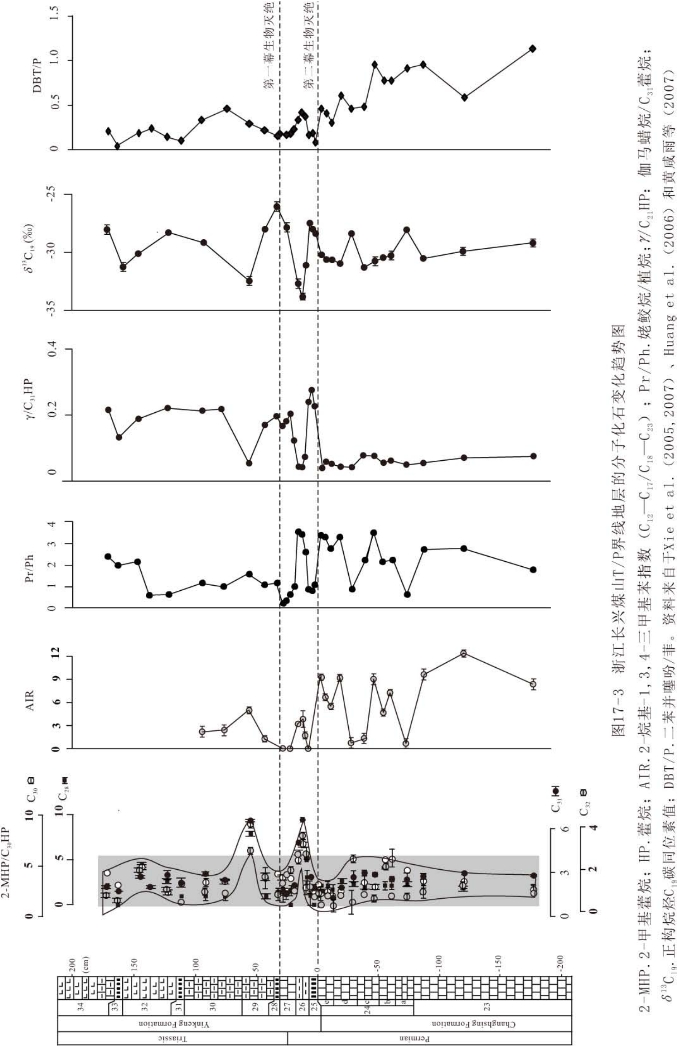
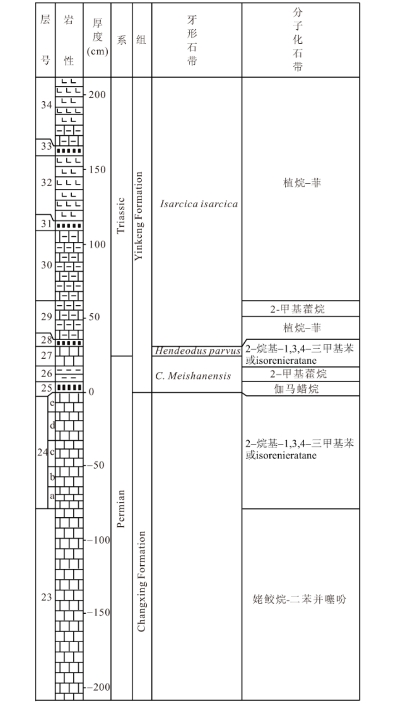
图17-4 浙江长兴煤山T/P界线地层的分子化石带划分图
把泥炭样品冻干后,磨成0.5mm以下的颗粒。0.5g粉末样品用二氯甲烷/丙酮(9∶1,V/V)放在索氏抽提器中抽提24h,并加入一系列标准样品。总抽提物用固相萃取法分离成中性和酸性组分。中性组分进一步用色层柱法(60目硅胶)分离成饱和烃、芳烃、酮/酯、脂肪醇/甾醇和极性组分。淋洗液分别是正己烷、正己烷/二氯甲烷(9∶1,V/V)、二氯甲烷、二氯甲烷/甲醇(1∶1,V/V)、甲醇。脂肪醇/甾醇组分进一步用饱和的尿素甲醇溶液把正构醇类与环状醇类分离开。各类仪器分析(气相色谱仪、高温气相色谱仪、气相色谱-质谱联用仪、高温气相色谱-质谱联用仪、气相色谱-燃烧-同位素比质谱仪、气相色谱-裂解-同位素比质谱仪)请参阅Xie et al.(2000,2004)、谢树成等(2001)。
17.4.2.2 分子化石分布特征及其气候环境意义
生物大化石分析显示,该泥炭岩芯主要以Sphagnum(泥炭藓)为主,特别是在深度8~9cm到30~31cm。在其他深度则以单子叶被子植物为主(图17-5)。
检测出的分子化石包括C21-C35正构烷烃(主峰C23和/或C31)、C25-C35正构脂肪酮(主峰C29或C31)、C38-C52蜡酯(主峰C40和C42)、C20-C34正构脂肪醇(主峰C22)、甾醇(24-乙基胆甾-5-烯-3β-醇,24-乙基-5α-胆甾-3β-醇,24-乙基胆甾-5,22-二烯-3β-醇,24-乙基-5α-胆甾-22-烯-3β-醇,24-甲基胆甾-5-烯-3β-醇和24-甲基-5α-胆甾-3β-醇)、C16 C34正构脂肪酸(主峰C24或C26)、C20-C28为α,ω-二元羧酸(主峰C22)和C20-C28ω-羟基酸(主峰C22或C26),等等。有关这些分子化石的植被和气候意义,请参阅Xie et al.(2000,2004)。
17.4.2.3 分子地层的划分与对比
在该泥炭中,正构烷烃与植物、气候之间具有很好的对应关系,因此,可以根据正构烷烃把本段泥炭岩芯划分成如下3个分子化石带(图17-5)。
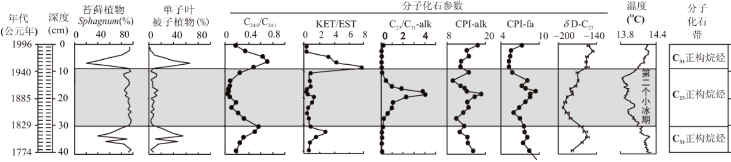
图17-5 英国英格兰某泥炭分子化石变化规律(Xie et al.,2000,2004)与分子化石带的划分
分子化石参数:C24∶0/C24∶1.正构烷烃C24/正构烯烃C24;KET/EST.正构脂肪酮/C16脂肪酸酯;ALK.正构烷烃;CPI.碳优势指数;fa.正构脂肪酸;δD-C23.正构烷烃C23氢同位素值
0~9cm:C31正构烷烃带(顶峰带)。分子化石的分布特征表现出正构烷烃以C31出主峰,正构烷烃/正构烯烃、酮/酯等比值较高,正构烷烃和正构脂肪醇的CPI值较低;正构烷烃C23的氢同位素值升高。植被以单子叶被子植物为主,苔藓植物Sphagnum很少。
9~31cm:C23正构烷烃带(顶峰带)。分子化石的分布特征表现出正构烷烃以C23出主峰,正构烷烃/正构烯烃、酮/酯等比值较低,正构烷烃和正构脂肪醇的CPI值较高;正构烷烃C23的氢同位素值降低。植被以苔藓植物Sphagnum为主,单子叶被子植物很低。
31~40cm:C31正构烷烃带(顶峰带)。分子化石的分布特征表现出正构烷烃以C31出主峰,正构烷烃/正构烯烃、酮/酯等比值较高,正构烷烃和正构脂肪醇的CPI值较低;正构烷烃C23的氢同位素值升高。植被以单子叶被子植物为主,苔藓植物Sphagnum很少。
由于本泥炭岩芯分子化石分布及其同位素组成在地层中的变化规律是对植被和气候的综合反映,因此,可以利用这些分子化石特征进行本泥炭的地层学对比。特别是,C23正构烷烃带相当于第二个小冰期这一具有全球性意义的气候事件,因此,可以把本泥炭的分子地层结果与其他研究载体在全球范围内进行气候地层学的对比。
参考文献
黄咸雨,焦丹,鲁立强,等.二叠纪-三叠纪之交环境的不稳定性和生物危机的多阶段性:浙江长兴微生物分子化石记录[J].中国科学(D辑),2007,37(5):629-635.
谢树成,赖旭龙,黄咸雨,等.分子地层学的原理、方法及应用实例[J].地层学杂志,2007,31(3): 110-122.
谢树成,黄咸雨,杨欢,等.示踪全球环境变化的微生物代用指标第四纪研究[J].2013,33(1):1-18.
谢树成,杨欢,罗根明,等.地质微生物功能群:生命与环境相互作用的重要突破口[J].科学通报,2012,57(1):3-22.
Bianchi T S,Cannuel E A.Chemical Biomarkers in Aquatic Ecosystems[M].Princeton:Princeton University Press,2011:1-396.
Blumenberg M,Seifert R,Reitner Jetal.Membrane lipid patterns typify distinctanaerobicmethanotrophic consortia[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(30): 11111-11116.
Boaretto E,Wu X,Yuan Jet al.Radiocarbon dating of charcoal and bone collagen associated with early pottery at Yuchanyan Cave,Hunan Province,China[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(24):9595-9600.
Brassell SC,Eglinton G,Marlowe IT et al.Molecular stratigraphy:A new tool for climatic assessment[J].Nature,1986,320(6058):129-133.
Brocks JJ,Love G D,Summons R E et al.Biomarker evidence for green and purple sulphur bacteria in a stratified Paleoproterozoic sea[J].Nature,2005,43(7060):866-870.
Brocks JJ,Pearson A.Building the biomarker tree of life[J].Reviews in Mineralogy&Geochemistry,2005,59 (1):233-258.
Buckley M,Kansa SW,Howard S et al.Distinguishing between archaeological sheep and goat bones using a single collagen peptide[J].Journal of Archaeological Science,2010,37(1):13-20.
Cvejic JH,Bodrossy L,Kovács K L etal.Bacterial triterpenoids of the hopane series from themethanotrophic bacteria Methylocaldum spp:Phylogenetic implications and first evidence for an unsaturated aminobacteriohopanepolyol[J].FEMSMicrobiology Letters,2000,182(2):361-365.
Diefendorf A F,Freeman K H,Wing S L.Distribution and carbon isotope patterns of diterpenoids and triterpenoids in modern temperate C3 trees and their geochemical significance[J].Geochimica et Cosmochimica Acta,2012,85:342-356.
Eglinton G,Calvin M.Chemical fossils[J].Scientific American,1967,216(1):32-43.
Gaines SM,Eglinton G,Rullkotter J.Echoes of life:what fossilmolecules reveal about earth history[M].New Yorks:Oxford University Press Inc,2009:1-355.
Golenberg E M,Giannsi D E,Clegg M T et al.Chloroplast DNA sequence from a Miocene Magnolia species[J].Nature,1990,334(6267):656-658.
Goossens H,de Leeuw JW,Schenck PA etal.Tocopherols as likely precursors of pristane in ancientsediments and crude oils[J].Nature,1984,312(5993):440-442.
Grice K,Cao C,Love G D et al.Photic zone euxinia during the Permian-Triassic superanoxic event[J].Science,2005(5710),307:709-714.
Hinrichs K U,Hmelo L R,Sylva SP.Molecular fossil record of elevated methane levels in Late Pleistocene coastal waters[J].Science,2003,299(5610):1214-1217.
Hopmans E C,Weijers JW H,SchefuβE et al.A novel proxy for terrestrial organic matter in sediments based on branched and isoprenoid tetraether lipids[J].Earth and Planet Science Letters,2004,224(1-2):107-116.
Huang X,Jiao D,Lu L et al.Distribution and geochemical implication of aromatic hydrocarbons across the Meishan Permian-Triassic boundary[J].Journal of China University of Geosciences,2006,17(1):49-54.
Huang Y S,Clemens SC,Liu W G etal.Large-scale hydrological change drove the late Miocene C4 plantexpansion in the Himalayan foreland and Arabian Peninsula[J].Geology,2007,35(6):531-534.
Huguchi R,Bowman B,Freiberger M et al.DNA sequence from the quagga,an extinctmember of the horse family[J].Nature,1984,312(5991):282-284.
Ingalls A E,Pearson A.Ten years of compound-specific radicarbon analysis[J].Oceanography,2005,18(3): 18-31.
Jenkyns H C,Schouten-Huiber L,Schouten S et al.Warm Middle Jurassic-Early Cretaceous high-latitude sea-surface temperatures from the Southern Ocean[J].Climate of Past,2012,8(1):215-226.
Köster J,Volkman JK,Rullkötter Jet al.Mono-,di-and trimethyl-branched alkanes in cultures of the filamentous cyanobacterium Calothrix scopulorum[J].Organic Geochemistry,1999,30(11):1367-1379.
Kuypers M M M,Sliekers AO,Lavik G etal.Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J].Nature,2003,422(6932):608-611.
Matthews D E,Hayes JM.Isotope-ratio-monitoring gas chromatography-mass spectrometry[J].Analytical Chemistry,1978,50(11):1465-1473.
Marom A,McCullagh JSO,Higham T F et al.Single amino acid radiocarbon dating of Upper Paleolithic modern humans[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109 (18):6878-6881.
Mitra S,Bianchi TS,Guo L etal.Terrestrially derived dissolved organicmatter in the Chesapeake Bay and the Middle Atlantic Bight[J].Geochimica et Cosmochimica Acta,2000,64(20):3547-3557.
Moldowan JM,Dahl J,Huizinga B Jet al.Themolecular fossil record of oleanane and its relation to angiosperms[J].Science,1994,265(5173):768-771.
Oches E A,McCoy W D.Historical developments and recent advances in amino acid geochronology applied to loess research:examples from Norh America,Europe,and China[J].Earth-Science Reviews,2001,54(1-3):173-192.
P a·a·bo S.Molecular cloning of ancient Egyptian mummy DNA[J].Nature,1985,314(6012):644-645.
Pancost R D,Steart D S,Handley L et al.Increased terrestrialmethane cycling at the Palaeocene-Eocene thermal maximum[J].Nature,2007,449(7160):232-235.
Peters K E,Walters C C,Moldowan JM.The Biomarker Guide(2nd edition)[M].New Yorks:Cambridge University Press:2004:1-471.
Prahl FG,Wakeham SG.Calibration of unsaturation patterns in long-chain ketone compositions for paleotemperature assessment[J].Nature,1987,330(6146):367-369.
Sachse D,Billault I,Bowen G Jet al.Molecular paleohydrology:interpreting the hydrogen-isotopic composition of lipid biomarkers from photosynthesizing organisms[J].Annual Review of Earth and Planetary Sciences,2012,40:221-249.
Schouten S,Hopmans E C,SchefuβE et al.Distributional variations in marine crenarchaeotalmembrane lipids:a new tool for reconstructing ancient seawater temperatures?[J].Earth and Planet Science Letters,2002,204 (1-2):265-274.
Shen W,Sun Y,Lin Y et al.Evidence for wildfire in the Meishan section and implications for Permian-Triassic events[J].Geochimica et Cosmochimica Acta,2011,75(7):1992-2006.
Summons R E,Jahnke L L,Hope JM etal.2-Methylhopanoids as biomarkers for cyanobacterial oxygenic photosynthesis[J].Nature,1999,400(6744):554-557.
Summons R E,Powell TG.Chlorobiaceae in Palaeozoic seas revealed by biologicalmarkers,isotopes and geology[J].Nature,1986,319(6056):763-765.
Ten Haven H L,De Leeuw JW,Rullkotter Jet al.Restricted utility of the pristane/phytane ratio as a palaeoenvironmental indicator[J].Nature,1987,330(6149):641-643.
Thiel V,Sjövall P.Using time-of-flight secondary ionmass spectrometry to study biomarkers[J].Annual Review of Earth abd Planetary Sciences,2012,39:125-156.
Treibs A.Chlorophyll-and haemin derivatives in bituminous rocks,petroleum,mineral waxes and asphalts[J].Justus Liebigs Annalen der Chemie,1934,510(1):42-62.
Venkatesan M I,Dahl J.Organic geochemical evidence for global fires at the Cretaceous/Tertiary boundary[J].Nature,1989,338(2):57-60.
Ventura G T,Kenig F,Reddy CM etal.Molecular evidence of Late Archean archaea and the presence of a subsurface hydrothermal biosphere[J].Proceedings of the National Academy of Sciences of the United States of A-merica,2007,104(36):14 261-14 266.
Volkman J.Marine Organic Matter:biomarkers,isotopes and DNA[M].Berlin:Springer,2006:1-374.
Walters CC,Peters K E,Moldowan JM.History of life from the hydrocarbon fossil record.In K.N.Timmis(ed.),Handbook of hydrocarbon and lipid microbiology[M].Springer,2010:172-183.
Weijers JW H,Schouten S,van den Donker JC etal.Environmental controls on bacterial tetraethermembrane lipid distribution in soils[J].Geochimica et Cosmochimica Acta,2007,71(3):703-713.
Xie SC,Evershed R P.Peatmolecular fossils recorded climate variation and organism replacement[J].Chinese Science Bulletin,2001,46(20):863-866.
Xie S,Nott C J,Avsejs L A et al.Molecular and isotopic stratigraphy in an ombrotrophic mire for paleoclimate reconstruction[J].Geochimica et Cosmochimica Acta,2004,68(13):2849-2862.
Xie S,Nott C J,Avsejs L A etal.Palaeoclimate records in compound-specificδD values ofa lipid biomarker in ombrotrophic peat[J].Organic Geochemistry,2000,31(10):1503-1507.
Xie S,Pancost R D,Huang X et al.Molecular and isotopic evidence for episodic environmental change across the Permo/Triassic boundary atMeishan in South China[J].Globaland Planetary Change,2007,55(1-3):56-65.
Xie S,Pancost R D,Yin H etal.Two episodes ofmicrobial change coupled with Permo/Triassic faunalmass extinction[J].Nature,2005,434(7032):494-497.
Xie S,Yao T,Kang Setal.Geochemical analysis of a Himalayan snowpit profile:implication for atmospheric pollution and climate[J].Organic Geochemistry,2000,31(1):15-23.
Xie S,Evershed R,Huang X et al.Concordantmonsoon-driven postglacial hydrological changes in peat and stalagmite records and their impacts on prehistoric cultures in central China[J].Geology,2013,41(8):827-830.
Xie S,Pancost R D,Chen L etal.Microbial lipid records ofhighly alkaline deposits and enhanced aridity associated with significant uplift of the Tibetan Plateau in the Late Miocene[J].Geology,2012,40(4):291-294.
关键词与主要知识点-17
关键词:
分子化石molecular fossil
化学化石chemical fossil
生物标志化合物biomarker
类脂物lipid
木质素lignin
碳水化合物carbohydrate
古DNA ancient DNA
古蛋白ancient protein
成岩作用diagenesis
生物降解biodegradation
成熟度maturity
气相色谱-质谱联用仪gas chromatograph-mass spectrometer
相对丰度relative abundance
碳优势指数(CPI)carbon preference index
平均碳链长度(ACL)average chain length
碳数分布carbon number distribution
单体同位素compound specific isotope
分子地层学molecular stratigraphy
分子化石带molecular fossil zone
分子化石延限带molecular fossil range-zone
分子化石组合带molecular fossil assemblege-zone
主要知识点:
分子化石的定义
主要的分子化石种类
影响分子化石保存的主要因素
分子化石的常见分析方法
同其他生物化石相比,分子化石的优缺点
分子地层学的基本原理及应用方法
分子地层学的主要应用领域
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















