价键理论和杂化轨道理论较好地说明了共价键的本质和形成,并能解释分子的空间构型,使分子的几何形状和化学键更加直观,容易理解。但是价键理论有局限性,它无法解释:①H2+单电子键的存在;②O2的顺磁性;③有大π键的某些分子的结构等问题。为了弥补价键理论存在的不足,1932年,美国化学家Mulliken和德国化学家Hund提出了分子轨道理论。
分子轨道理论把分子作为一个整体来处理,将分子中的电子看作是在分子中所有原子核及其他电子所形成的势场中运动,比较全面地反映了分子中电子的运动状态,分子整体的性质得到较好的说明。该理论近十几年来发展很快,在共价键理论中占有非常重要的地位。
(一)分子轨道的概念
通过原子结构与周期系一章的学习,知道原子中的电子是处于原子核及其他电子所形成的势场中运动的,可以用ψ1s、ψ2s、ψ2p…等波函数来表示这些电子的空间运动状态,这些空间运动状态俗称原子轨道。
分子轨道理论指出,在多原子分子中,电子不再属于某个原子,也不局限于两个相邻原子之间,而是在整个分子的范围内运动。分子中电子的空间运动状态也可以用波函数ψ来描述,即把【分子中电子的空间运动状态叫分子轨道(Molecular orbit),简称MO】。每一个波函数ψ都有相对应的能量和形状,ψ2为分子中的电子在空间出现的概率密度。分子轨道与原子轨道的不同之处,主要是分子轨道是多中心(多原子核)的,而原子轨道是一个中心(单原子核)的。
(二)分子轨道理论的基本要点
1.作为一种近似处理,可以认为 分子轨道是由原子轨道线性组合(linearly combination of a-tomic orbital,简称LCAO)而成,组合成的分子轨道的数目等于参与组合的原子轨道的数目。
在组合形成的分子轨道中,比组合前原子轨道能量低的轨道称为成键分子轨道,用ψ表示;比组合前原子轨道能量高的轨道称为反键分子轨道,用ψ■表示。
例如两个氢原子的1s原子轨道ψA与ψB线性组合,可产生两个分子轨道:
ψσ1s=C1(ψA+ψB)
ψσ■1s=C2(ψA—ψB)
式中,C1、C2为常数,ψσ1s为成键分子轨道,它是由两个原子轨道同号重叠(波函数相加)而成,波函数同号表示它们所代表的电子波同相,组合时两个波相互叠加,得到强度更大的波。两个原子核间电子运动概率密度增大,体系能量降低,因此成键分子轨道能量较原子轨道能量低。ψσ■1s为反键分子轨道,它是由异号原子轨道重叠(波函数相减)而成,波函数异号表示它们代表的电子波相位不同,相互结合时由于干涉作用,有一部分相互抵消,核间概率密度减小,体系能量升高不利于成键,因此反键分子轨道能量高于原子轨道能量。
2.为了有效地组合成分子轨道,参与组合的原子轨道必须满足以下三条原则,即对称性匹配原则、能量近似原则和最大重叠原则。
(1)对称性匹配原则 对称性相同的原子轨道才能组合成分子轨道。原子轨道均具有一定的对称性,例如s轨道是球形对称,p轨道对中心是反对称(即原子轨道角度分布的波函数符号一半是正,一半是负),d轨道有中心对称和对坐标轴或某个平面对称。为了有效组合成分子轨道,要求参加组合的原子轨道对称性相同(匹配),对称性不相同的原子轨道不能组合成分子轨道。所谓对称性相同,可以理解为两个原子轨道以两个原子核为轴(指定为x轴)旋转180°时,原子轨道角度分布的正、负号都发生改变或都不发生改变,即为原子轨道对称性相同(匹配);若一个正、负号变了,另一个不变即为对称性不相同(不匹配)。图2-15(a)、(c)为两个原子轨道的对称性不匹配;而图2-15(b)、(d)、(e)为两个原子轨道的对称性匹配。
图2-15 原子轨道对称性示意图
(2)能量近似原则 两个对称性相同的原子轨道能否组合成分子轨道,还要看这两个原子轨道能量是否接近。只有能量接近的两个对称性匹配的原子轨道才能有效地组合成分子轨道,而且原子轨道的能量越接近越好,这就叫能量近似原则。在同核双原子分子中,当然1s-1s、2s-2s、2p-2p能有效地组合成分子轨道,而能量近似原则对于异核的双原子分子或多原子分子来说,能否有效地组合成分子轨道尤为重要。
例如H、F原子有关原子轨道的能量分别为:
E1s(H)=—1.8×10—18(J)
E1s(F)=—1.12×10—16(J)
E2s(F)=—6.43×10—18(J)
E2p(F)=—2.98×10—18(J)由于H原子的1s轨道与F原子的2p轨道能量接近,所以在形成HF分子时,这两条轨道能组合成分子轨道。
(3)轨道最大重叠原则 当能量相同(或相近)、对称性匹配的两个原子轨道组合成分子轨道时,应尽可能使原子轨道重叠程度最大,以使成键分子轨道的能量尽可能降低,组合成的分子轨道越稳定,这就叫最大重叠原则。
由此可见,在由原子轨道组成分子轨道的三原则中,对称性原则是首要的,它决定原子轨道能否组成分子轨道的问题,而能量近似原则和最大重叠原则只是决定组合的效率问题。
3.电子在分子轨道上的排布将遵从能量最低原理、Pauli不相容原理和Hund规则等三原则,即得分子的基态电子组态。
4.每个分子轨道都有相应的能量和图像,分子的能量E等于分子中电子能量的总和,而电子的能量即为被它们所占据的分子轨道的能量。
5.根据原子轨道的重叠方式和形成的分子轨道的对称性不同,可将分子轨道分为σ分子轨道和π分子轨道。按分子轨道的能量大小,可以排出分子轨道的近似能级图。
(三)分子轨道的形成和类型
分子轨道的形状可以通过原子轨道的重叠,分别近似地描述。
1. ns-ns 原子轨道的组合
两个原子的能量相等或相近的ns轨道沿连接两个原子核的轴线进行线性组合可得到两个σ分子轨道,若原子轨道同号重叠(波函数相加)则得到能量比ns原子轨道能量低的成键分子轨道,用符号σns表示;若原子轨道异号重叠(波函数相减)则得到能量比ns原子轨道能量高的反键分子轨道,用σn■s表示,如图2-16所示。
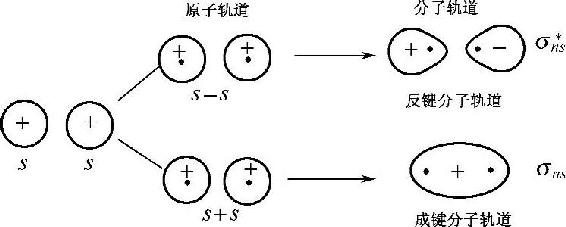
图2-16 s原子轨道组合成分子轨道
2. ns - npx 原子轨道的组合
当一个原子的ns轨道与另一个原子的能量相近的np轨道沿键轴重叠时,由于s轨道只与px轨道对称性匹配,则可以组合成两条分子轨道,成键分子轨道σsp和反键分子轨道σs■p,如图2-17所示。
图2-17 s-px组合成分子轨道
3. np-np 原子轨道的组合
【当2个原子的能量相等或相近的 np 轨道组合成分子轨道时,可以有“头碰头”和“肩并肩”两种组合方式】。每个原子的np轨道共有3条,即npx、npy、npz,它们在空间的分布是互相垂直的。【两个原子的npx轨道沿连接两个原子核的轴线(X轴)以“头碰头”的方式进行线性组合,可以得到两个σ分子轨道,成键分子轨道σnpx和反键分子轨道σn■px】。如图2-18所示。
图2-18 px-px组合成分子轨道
两个原子的npy轨道和npz轨道沿轴方向重叠,以“肩并肩”的方式组合成两个π分子轨道,成键分子轨道πnpy与πnpz和反键分子轨道πn■py与πnFpz,这两组轨道的组合情况相同,仅空间取向互成90°角,形状相同,能量相等,互为简并轨道,如图2-19所示。
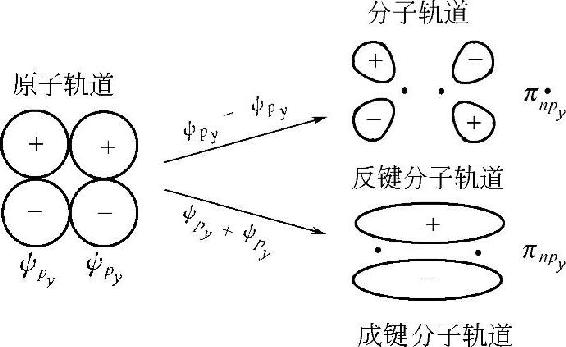
图2-19 py-py组合成分子轨道
由以上讨论可知,分布在成键σ分子轨道上的电子称为成键σ电子,分布在反键σ分子轨道上的电子称为反键σ电子,分布在π分子轨道上的电子称为π电子。成键电子使分子的稳定性增大,而反键电子使分子的稳定性减小。
分子轨道的重叠方式还有p-d、d-d重叠,这类重叠一般出现在过渡金属化合物和一些含氧酸中,将在相应章节中介绍。
(四)第二周期同核双原子分子的分子轨道能级图
每种分子的每个分子轨道都有确定的能量,不同种分子的分子轨道能量是不同的。由于分子轨道能量理论计算很复杂,目前主要借助分子光谱实验来确定。
图2-20是第二周期同核双原子分子的分子轨道能级图。
第二周期同核双原子分子的分子轨道能级顺序有两种情况,下面分别讨论。
1.O 2 和F 2 的分子轨道能级图
对同核双原子分子,当组成原子的2s和2p轨道能量相差较大(一般认为大于15ev或2.4×10—19J),如O的2p轨道能量与2s轨道能量之差为2.64×10—18J,F的2p轨道能量与2s轨道能量之差为3.45×10—18J,原子轨道组合成分子轨道时,只发生s-s、p-p重叠,不会发生2s和2px轨道之间的相互作用。分子轨道的能级顺序如图2-20(a)所示,O2和F2的分子轨道则是按该能级顺序排列的。即:
(σ1s)(σ1■s)(σ2s)(σ2■s)(σ2px)(π2pyπ2pz)(π2■pyπ2■pz)(σ2■px)
括号内的分子轨道为能量相同的简并轨道。
图2-20 同核双原子分子的分子轨道能级图
2.B 2 -N 2 的分子轨道能级图
对同核双原子分子来说,若组成原子的2s和2p轨道能级相差较小(一般认为10ev左右或1.6×10—18J左右),不仅会发生s-s、p-p重叠,还必须考虑2s和2px轨道之间的相互作用,以致造成σ2px能级高于π2py、π2pz能级的错位现象。(此时,由两个2s和2px轨道组合成的对称性相同的分子轨道σ2s和σ2px以及σ2■s和σ2■px进一步组合,形成新的分子轨道。此时各个分子轨道已不是单纯的2s-2s和2px-2px原子轨道的组合,因此用σ2s和σ2px等符号表示已不妥,改用1σg、1σu等符号表示,其中g代表中心对称,u代表中心反对称。对于同核双原子分子轨道,可取核间连线的中心作为对称中心,在对称中心两边ψ符号相同时称为中心对称或g对称;在对称中心两边ψ符号相反时,称为中心反对称或u对称。由分子轨道图形可以看出,σ成键轨道都是g对称的,σ反键轨道为u对称;π成键轨道为u对称,π反键轨道为g对称)。为便于理解,重新组合后形成的分子轨道能级高低次序可写为:
(σ1s)(σ1■s)(σ2s)(σ2■s)(π2pyπ2pz)(σ2px)(π2■pyπ2■pz)(σ2■px)
如N、C、B的2p轨道能量与2s轨道能量之差分别为2.03×10—18J、8.4×10—19J、8.0×10—19J。N2、C2、B2等分子轨道是按图2-20(b)的能级顺序排列的。
图2-20轨道能级的高低顺序是根据光谱实验的结果绘制的,各轨道能级数据见表2-9。
表2-9 氮和氧的分子轨道数据
■N2分子轨道能级数据取自Proc Roy Soc B172,327(1969);O2分子轨道能级数据取自W L Jorgenson The Orga-nic Chemist’s Book of Orbitals 88(1973)。
下面通过几个具体的实例说明分子轨道理论的应用。
(1)H2的结构 H2是最简单的同核双原子分子,两个氢原子靠近时,两个1s原子轨道(AO)可以相互重叠形成σ成键和反键分子轨道(MO)。根据能量最低原理,2个自旋方式不同的电子将先填入能量较低的σ1s成键分子轨道,体系能量降低,形成一个σ键,H2分子轨道电子排布式可表示为[(σ1s)2],如图2-21所示。
(2)H2+的结构 由于H2+分子离子中唯一的一个电子根据能量最低原理进入成键σ分子轨道,体系能量降低,所以H2+可以稳定存在,且形成一个单电子σ键,其键能为255.48kJ.mol—1,H2+分子离子的电子排布式可表示为[(σ1s)1]。
(3)N2分子的结构 每个氮原子有7个电子,N2分子中共有14个电子,按照能量最低原理和Pauli不相容原理排布进入分子轨道。
氮分子的分子轨道电子排布式为:
N2:[(σ1s)2(σ1■s)2(σ2s)2(σ2■s)2(π2py)2(π2pz)2(σ2px)2]
其中对成键有主要贡献的是(π2py)2(π2pz)2和(σ2px)2三对电子,相当于形成两个π键和一个σ键。由于氮分子中存在三键(N≡N),键级为3,所以N2分子具有特殊的稳定性。
(4)O2的结构 氧分子由两个氧原子组成,每个氧原子核外有8个电子,在氧分子中共有16个电子,根据能量最低原理,Hund规则和Pauli不相容原理得到氧分子电子排布的分子轨道能级图如图2-22所示。
图2-21 氢的原子轨道与分子轨道
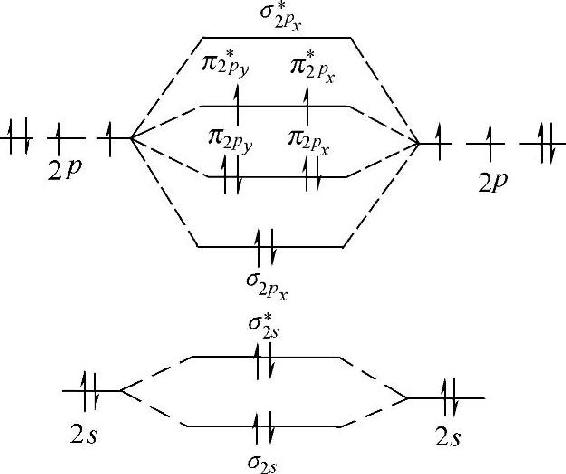
图2-22 O2分子的分子轨道能级图
O2分子的分子轨道电子排布式为:
O2:[(σ1s)2(σ1■s)2(σ2s)2(σ2■s)2(σ2px)2(π2py)2(π2pz)2(π2■py)1(π2■pz)1]
在O2的分子轨道中,成键的(σ2s)2和反键的(σ2■s)2对成键的贡献互相抵消,实际对成键有贡献的是(σ2px)2,构成O2分子中的一个σ键;(π2py)2(π2■py)1构成一个三电子π键;(π2pz)2(π2■pz)1构成另一个三电子π键。所以氧分子的结构式可表示为:
或
氧分子中存在一个σ键和两个三电子π键,每个三电子π键的键能只有单键的一半,两个三电子π键的键能相当于一个单键,这与O2分子具有双键键能是一致的。因此可以预期O2分子中的键没有N2分子的键那样牢固。实验事实也证明,断裂O2分子中的化学键所需的能量(即O2分子的离解能:497.9kJ·mol—1)要小于断裂N2分子中的化学键所需的能量(N2分子的离解能:948.9kJ·mol—1)。
O2分子的分子轨道能级图清楚地表明,O2分子中存在两个自旋相同的成单电子,所以O2具有顺磁性,这已为实验所证明(物质的磁性主要是电子的自旋引起的,通常顺磁性物质中含有单电子,而反磁性物质的电子都已成对)。O2分子具有顺磁性,这是电子配对理论无法解释的,但是用分子轨道理论处理O2分子结构时,则是很自然得出的结论。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














