第五章 共聚焦显微镜在结膜疾病中的应用
一、翼状胬肉
翼状胬肉是我国低纬度或高海拔等紫外线照射较强地区非常常见的眼科疾病.传统观点认为翼状胬肉是一种变性疾病,但是随着对角膜缘干细胞认识的深入,目前的观点认为角膜缘干细胞功能障碍是主要发病的基础.长期大剂量的紫外线照射可造成干细胞功能障碍和数量减少,而完整的角膜缘是阻止结膜向角膜生长的屏障.一旦此屏障被破坏,则结膜成纤维细胞增殖活跃,发生结缔组织重塑和血管化,并向角膜内生长,从而发生翼状胬肉(图5-1)。
在共聚焦显微镜下,翼状胬肉患者的上方和下方角膜缘结构大多正常,可见清晰的Vogt栅栏结构,栅栏结构的存在提示有功能正常的角膜缘干细胞.但是在发生胬肉区域[鼻侧和(或)颞侧]往往见不到Vogt栅栏结构,取而代之的是大量的纤维组织,伴有丰富血管.处于活动期的胬肉组织内往往可见大量的炎症细胞和朗格汉斯细胞.在上皮层下可见散在性的小囊泡(图5-2)。

A.裂隙灯下可见患者鼻侧角巩膜缘处翼状胬肉,侵入角膜缘内约3 mm
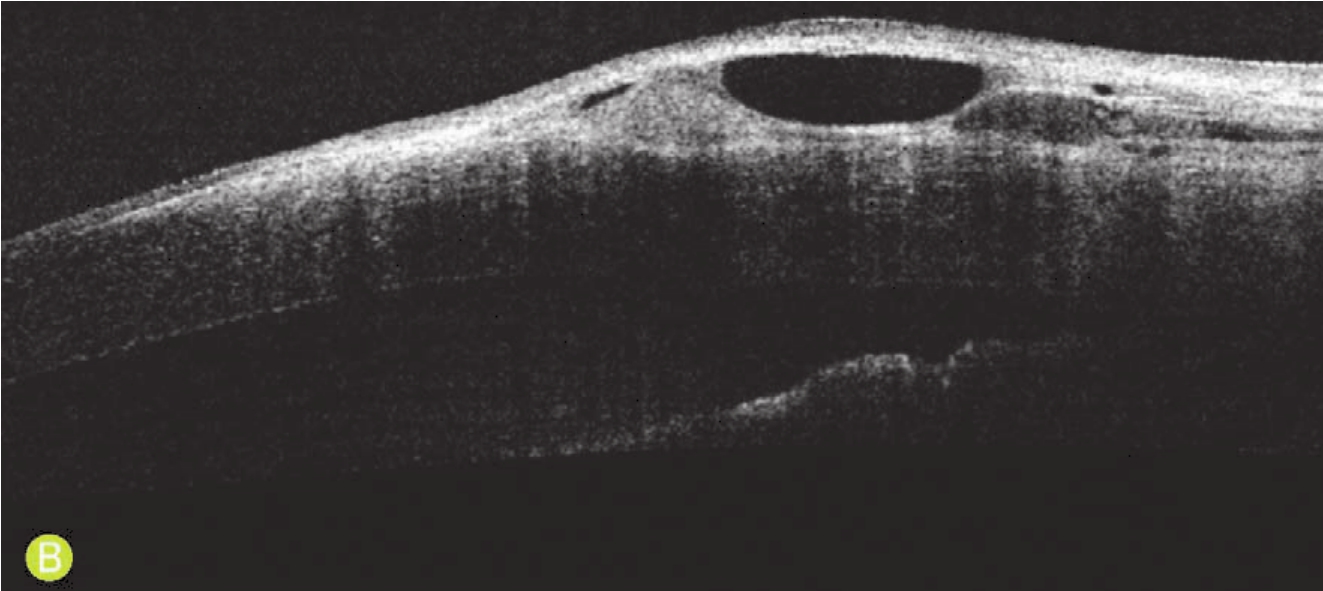
B.眼前节OCT图片,可见胬肉表层的纤维组织较为疏松,反光较弱;深层的纤维组织较为致密,反光较强,胬肉与角膜表面之间存在空隙
图5-1 翼状胬肉患者的裂隙灯下和眼前节OCT表现

A.下方角巩膜缘可见清晰的Vogt栅栏结构

B.上方角巩膜缘也可见清晰的Vogt栅栏结构

C.颞侧角膜缘虽然未见胬肉生长,且在角巩膜缘处可见Vogt栅栏结构,但是上皮柱内高反光的小圆细胞数量较少

D.鼻侧角膜缘处见不到Vogt栅栏结构,组织内见粗大血管,其中可见滚动的血细胞

E.在胬肉组织浅层可见大量疏松的纤维组织
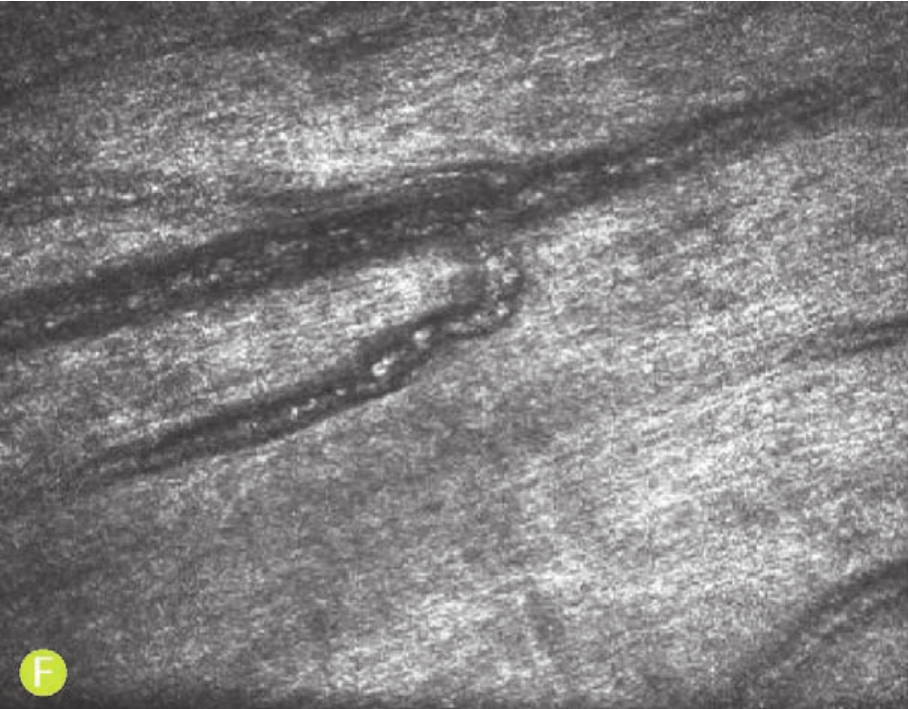
F.在胬肉的深层组织内见大量致密的纤维结缔组织,其中夹杂血管网
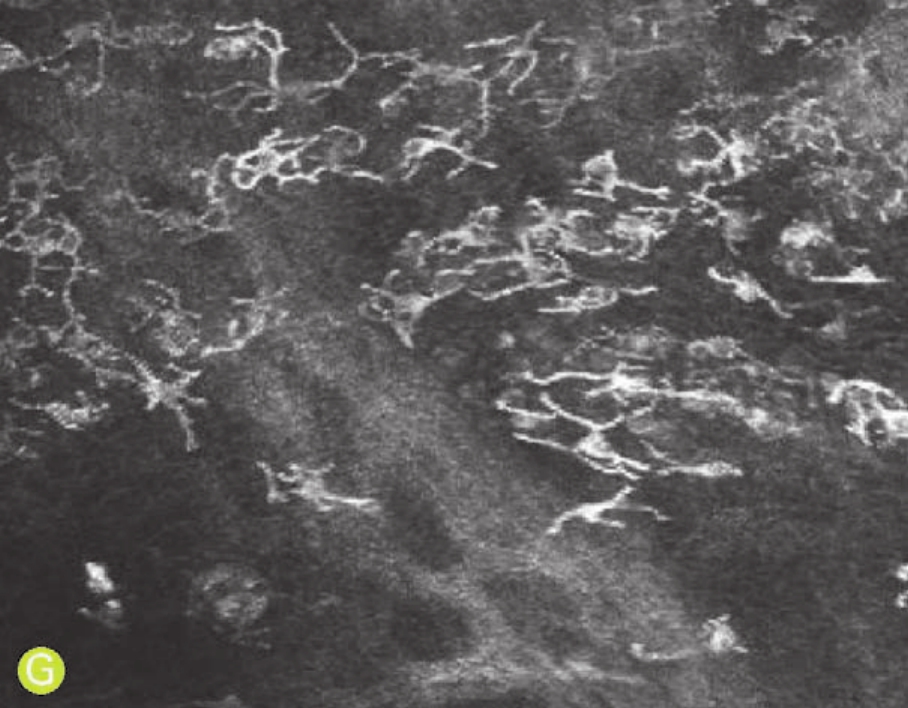
G.活动期胬肉的上皮细胞层内见大量的朗格汉斯细胞

H.胬肉组织内可见散在的小囊泡,囊泡周围有少量炎症细胞
图5-2 共聚焦显微镜观察翼状胬肉患者的角膜(X 800,HRT系列)
二、眼表新生物
眼表常见的良性肿瘤依次为色素痣(30.2%)、皮样瘤(27.5%)、囊肿(20.7%)、乳头状瘤(13.4%)和血管瘤(5.9%)。在恶性肿瘤中,鳞状细胞癌高居首位,占81.4%,较占第2位的黑色素瘤(8.4%)高10倍。对于眼表新生物的确诊主要依靠病理学诊断,但是利用共聚焦显微镜的"活体切片"作用,可提供眼表新生物内细胞的活体影像,为判断其性质提供辅助依据。
使用共聚焦显微镜对3例发生于角巩膜缘的色素性新生物(图5-3,5-4,5-5)进行检查,发现在新生物内有大量形态不规则的细胞,细胞呈高反光性,其中夹杂朗格汉斯细胞。有2例可见这种不规则形的细胞排列成"细胞巢",新生物周围和基底部均见丰富的血管。还有1例在不规则形的细胞周边可见大量大小均一的小圆形细胞。但是这些细胞的来源,以及新生物的良、恶性判断,最终还是需要病理学依据。到目前为止,尚无将共聚焦显微镜应用于眼表新生物诊断的报道,也没有将共聚焦显微镜的活体细胞学观察结果与病理学观察结果进行比较的报道,这可作为今后的一个研究方向。
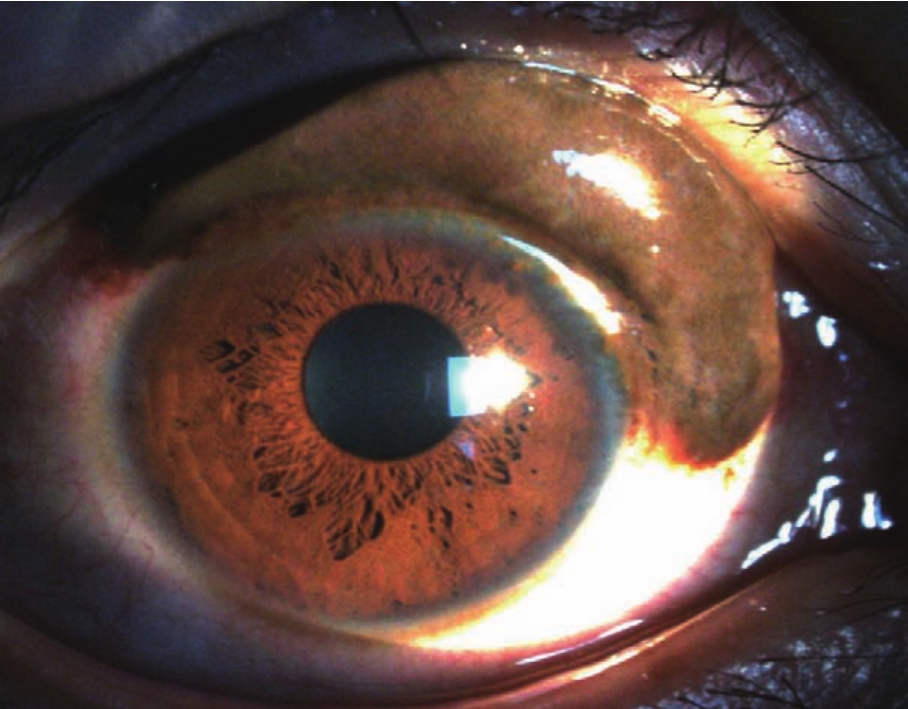
图5-3 色素性新生物的裂隙灯像注:患者为38岁男性,在其上方角膜缘可见一巨大的色素性新生物

A.在新生物的边缘上方可见形态尚属正常的上皮细胞(实线箭头),但在下方可见成堆呈高反光的多角形细胞(虚线箭头),形态与上方的上皮细胞有显著差异

B.在新生物内部可见大量呈高反光的多角形细胞,细胞形态不规则

C.新生物内可见形态不规则的细胞排列成细胞巢

D.在多角形细胞之间夹杂大量朗格汉斯细胞(箭头)
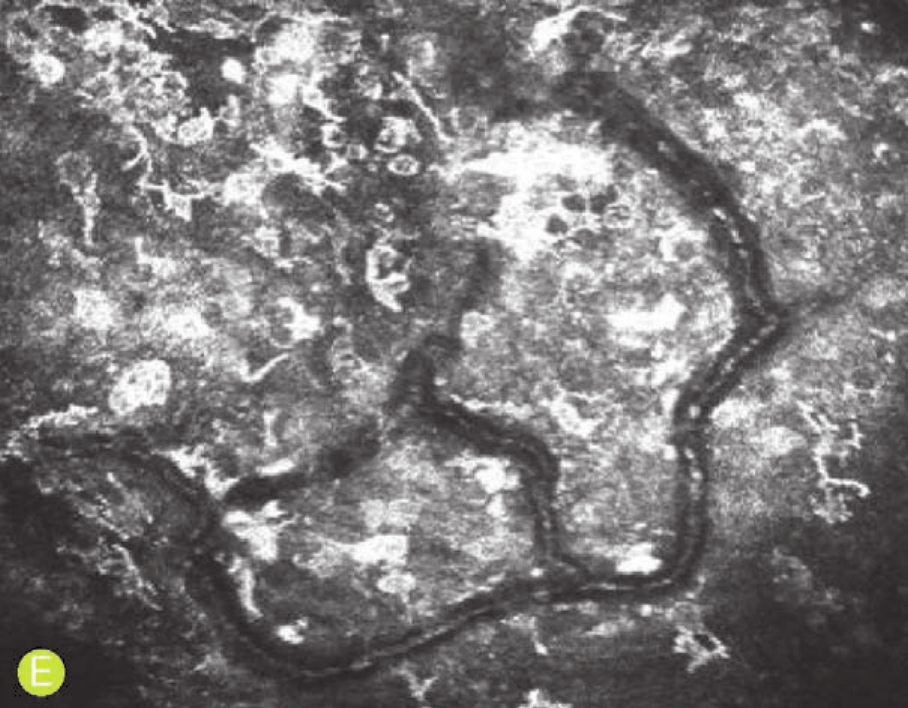
E.新生物内见丰富的血管组织,其中可见滚动的血细胞
图5-4 共聚焦显微镜观察色素性新生物患者的角膜(一)(X 800, HRT系列)

A.角膜缘的色素性新生物内可见大量的多角形细胞,呈高反光性

B.新生物内可见大量的朗格汉斯细胞

C.新生物内可见细胞巢样结构

D.新生物内可见大量大小基本一致的小圆形细胞
图5-5 共聚焦显微镜观察色素性新生物患者的角膜(二)(X 800, HRT系列)
三、青光眼滤过性手术后
滤过性手术是青光眼手术治疗中的最常用方式,分为全厚度滤过、控制性(限制性)滤过(小梁切除术)和非穿透性小梁手术(深层巩膜切除术)。手术的成功与否是以建立有效的永久性房水流出通道来评价的,临床上以形成功能性滤过泡为特征。这种功能性滤过泡可以是薄壁和多囊状的,也可以是比较弥漫平坦、壁较厚但相对周围结膜组织少或无血管的(图5-6)。失败的滤过性手术的滤过泡也有两种:一种滤过泡完全消失,形成纤维瘢痕;另一种在滤过口处形成局限肥厚的Tenon筋膜包裹性囊肿,或称包裹性滤过泡。这种滤过泡虽有形态,但是不具备房水引流功能(图5-7)。

图5-6 青光眼术后功能性滤过泡的裂隙灯像
注:手术区域形成薄壁的无血管滤过泡

图5-7 青光眼术后无功能性滤过泡的裂隙灯像
注:结膜下形成了明显的瘢痕组织
组织病理学发现,功能性滤过泡结膜上皮下的结缔组织排列疏松,并在结膜上皮下存在多囊状清亮空隙;而无功能性滤过泡的结膜上皮下有异常增厚的、多层的致密胶原纤维结缔组织,伴成纤维细胞活跃增生,囊泡内衬纤维素性无细胞结构。
共聚焦显微镜检查功能性滤泡可在结膜上皮下见到大量上皮内微小囊肿(呈低反光性),同时上皮下的结缔组织排列非常疏松(图5-8);而无功能性滤泡内结膜上皮下没有或只有少数几个上皮内小囊肿,上皮下的纤维结缔组织排列十分致密,其中可见炎症细胞浸润(图5-9)。研究结果表明,使用共聚焦显微镜对滤过泡进行活体观察是一种新方法,它与来自活体组织学检查结果完全吻合。共聚焦显微镜在滤过泡的活体观察中所见到的微小囊肿数量及上皮下结缔组织密度与滤过泡的功能相关。通过在活体细胞水平提供滤过泡的细微结构,共聚焦显微镜有望成为了解滤过性手术后损伤修复机制的一种新方法。
(乐琦骅 朱文卿 洪佳旭)

A.结膜上皮下存在微小囊肿

B.滤过口处见大量疏松的纤维结缔组织
图5-8 共聚焦显微镜观察功能性滤过泡(X 800,HRT系列)

A.结膜上皮内未见微小囊肿,上皮下的纤维结缔组织致密

B.结膜上皮内可见成堆炎症细胞浸润

C.滤过口处见大量致密的纤维结缔组织,形成包裹
图5-9 共聚焦显微镜观察无功能性滤过泡(X 800,HRT系列)
参考文献
1. Amar N, LabbéA, Hamard P, et al. Filtering blebs and aqueous pathway: an immunocytological and in vivo confocal microscopy study. Ophthalmology, 2008, 115(7):1154~1161
2. Ciancaglini M, Carpineto P, Agnifili L, et al. Filtering bleb functionality:a clinical, anterior segment optical coherence tomography and in vivo confocal microscopy study. J Glaucoma, 2008, 17(4):308~317
3. Curiel-Lewandrowski C, Williams CM, Swindells KJ, et al. Use of in vivo confocal microscopy in malignant melanoma:an aid in diagnosis and assessment of surgical and nonsurgical therapeutic approaches. Arch Dermatol, 2004, 140(9):1127~1132
4. Dhaliwal JS, Kaufman SC,Chiou A.Current applications of clinical confocal microscopy. Curr Opin Ophthalmol, 2007, 18(2):300~307
5. Duchateau N, Hugol D, D'Hermies F, et al. Contribution of in vivo confocal microscopy to limbal tumor evaluation. J Fr Ophtalmol, 2005, 28(8): 810~816
6. Gheck L, Dupas B, Denion E, et al. Advantages of in vivo confocal microscopy for investigation of the pertygium. J Fr Ophthalmol, 2007, 30(7): 703~710
7. Guthoff R, Klink T, Schlunck G,et al. In vivo confocal microscopy of failing and functioning filtering blebs:Results and clinical correlations. J Glaucoma, 2006, 15(6):552~558
8. Labbe A, Dupas B, Hamard P, et al. An evaluation of blebs after filtering surgery with the in vivo confocal microscope. J Fr Ophthalmol, 2004, 27 (10):1083~1089
9. Labbe A, Dupas B, Hamard P, et al. In vivo confocal microscopy study of blebs after filtering surgery. Ophthalmology, 2005, 112(11):1971~1979
10. Malandrini A, Martone G, Traversi C, et al. In vivo confocal microscopy in a patient with recurrent conjunctival intraepithelial neoplasia. Acta Ophthalmol, 2008, 86(6):690~691
11. Messmer EM, Mackert MJ, Zapp DM,et al. In vivo confocal microscopy of pigmented conjunctival tumors. Graefes Arch Clin Exp Ophthalmol, 2006, 244(11):1437~1445
12. Messmer EM, Zapp DM, Mackert MJ,et al. In vivo confocal microscopy of filtering blebs after trabeculectomy. Arch Ophthalmol, 2006, 124(8): 1095~1103
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















