16.2.1 SOD与辐射防护
在辐射照射过程中,生物体内水分子经激发和电离而产生了包括 在内的自由基,因此有些学者认为照射前供给外源SOD可能有抗辐射效果。照射后内源
在内的自由基,因此有些学者认为照射前供给外源SOD可能有抗辐射效果。照射后内源 的产生可能增加,而清除
的产生可能增加,而清除 的能力却由于SOD活性下降等原因而减弱。有的学者主张照射后也可供给外源SOD以增加疗效。近十多年来,在这方面有大量的论文报道。这些论文指出SOD确有明显的抗辐射作用和疗效。
的能力却由于SOD活性下降等原因而减弱。有的学者主张照射后也可供给外源SOD以增加疗效。近十多年来,在这方面有大量的论文报道。这些论文指出SOD确有明显的抗辐射作用和疗效。
16.2.1.1 SOD对辐射所致脂类过氧化的防护作用
电离辐射对细胞的损伤作用机理尚未完全探明。原来一般认为DNA的损伤可能是主要原因,但是从细胞分裂周期中的辐射效应来看,DNA的损伤不像是最敏感的环节,因而近年来细胞辐射损伤作用机理的其他假说,尤其是生物膜辐射损伤也受到人们的重视。在生物膜的辐射损伤中脂类过氧化是个关键性问题。有一些学者指出,SOD对辐射所致脂类过氧化有明显防护作用。Petkau和Chelack用大豆磷脂制成脂质体,并以X射线或137Cs的γ射线照射。他们观察到,以232nm光吸收增加值作为脂类过氧化指标时,照射的脂质体均发生脂类过氧化。他们还观察到由于脂类过氧化为链式反应,在同样照射量的实验条件下,单位时间的照射剂量愈低,其脂类过氧化效应愈高。用脑磷脂制成脂质体也得到类似结果。
16.2.1.2 SOD对红细胞辐射损伤的防护作用
脂类过氧化是生物膜辐射损伤的重要原因。用磷脂等脂类制成脂质体模拟生物膜应用于体外实验,虽可观察到电离辐射作用下所产生的自由基对脂类的损害,但还不能窥视到生物膜损伤对细胞功能的影响。
红细胞溶血被认为是红细胞膜损伤的后果。在离体照射条件下红细胞溶血程度常增加,但将SOD加入红细胞悬液后照射,则可使其溶血程度减轻。如在某项实验中,将狗的红细胞分别悬液照射10Gy、50Gy和250Gy辐射量,20℃下放置20h,可观察到电离辐射的确可使红细胞溶血;但加入SOD使其浓度达到0.1mg/mL后照射,却使其溶血程度减轻。Inouye等也观察到类似结果,并指出维生素E对辐射所致溶血的防护效果更佳。他们还观察到辐射引起红细胞膜损伤,如体外照射可使K+从细胞内逸出细胞外的量增加。在一次实验中经50Gy照射后,红细胞内K+丧失77%,而未照射的红细胞悬液经同样长的时间放置后,其细胞内K+仅丧失46%。换言之,辐射可使K+的丧失量增加31%。维生素E与SOD对辐射所致红细胞内K+的丧失均有防护效果。
16.2.1.3 SOD对造血干细胞的辐射损伤的防治效果——减轻CFU-S的辐射损伤
造血型辐射损伤的典型症状是干细胞辐射损伤造成了外周血象的变化。Petkau首先研究了SOD对造血干细胞辐射损伤的防治效果,他在数次实验中均观察到SOD不仅对造血干细胞有抗辐射作用,而且对其辐射损伤也有疗效。如他观察,SOD对小鼠粒系多向干细胞的辐射损伤作用时,将供体小鼠与受体小鼠分别照射3.5Gy和8.0Gy的辐射量,并在照射前或照射后按每克(体重)静脉注射SOD 35μg,结果(见表16-4)表明,给予SOD可减轻小鼠CFUS(colony forming unit-spleen)的辐射损伤,其中照射前给予SOD的效果好于照射后给予同样量酶的效果,但照射前和照射后都给予SOD的效果更好。
表16-4 SOD对小鼠CFU-S的辐射损伤的防治效果
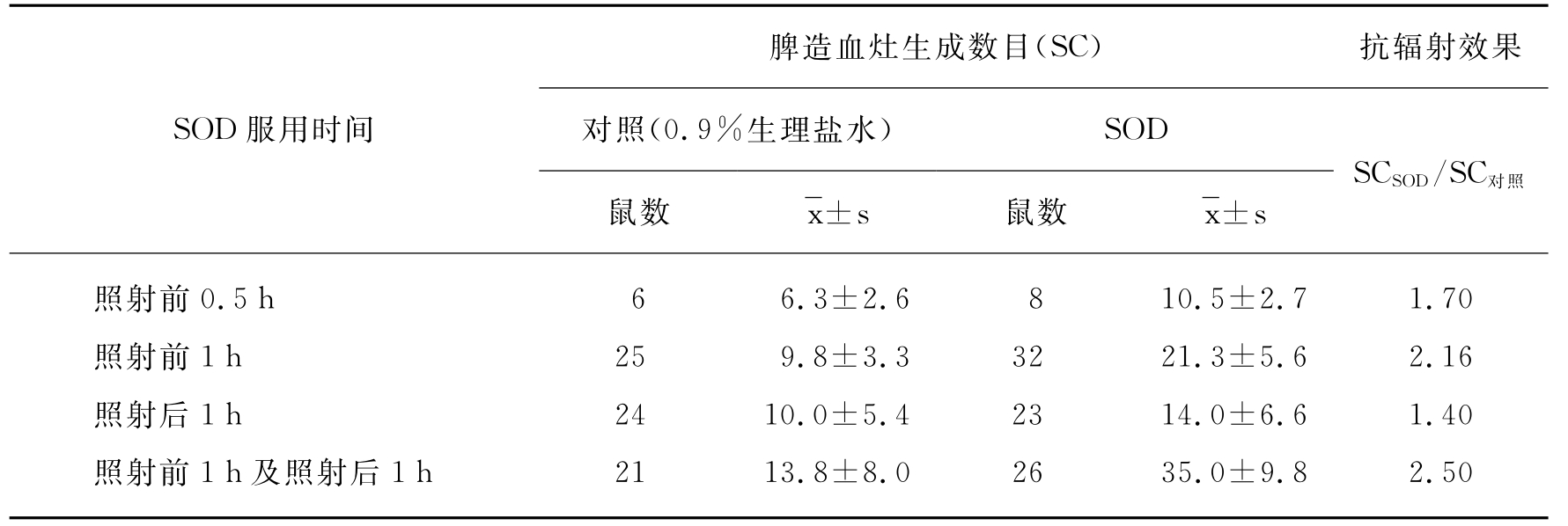
注:CFU-S用SC表示。
杜德林等将供体小鼠与受体小鼠分别照射3.5Gy和8.5Gy的辐射量,也得到Petkau的类似实验结果。同时还观察到静脉注射、腹腔注射或皮下注射等不同途径给予SOD对小鼠CFU-S的辐射损伤均有不同程度的防护效果(见表16-5)。
表16-5 照射前不同途径给予SOD对小鼠CFU-S辐射损伤的影响
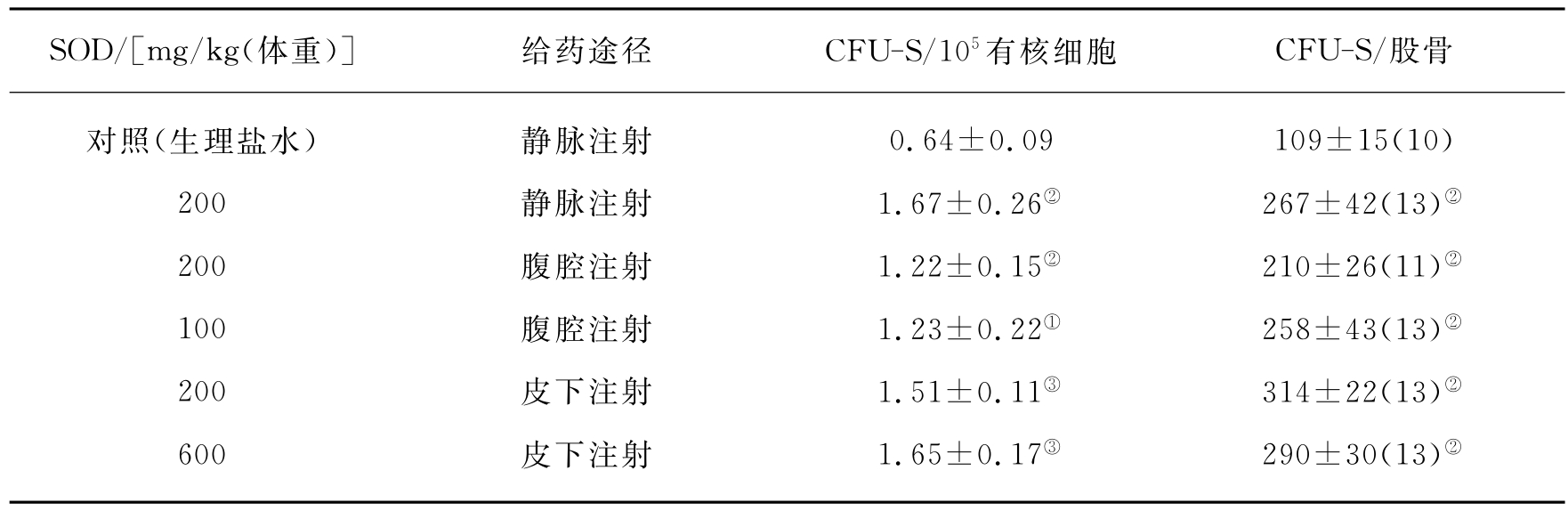
注:括号内为动物数,与对照比较,①P<0.05;②P<0.01;③P<0.001。
16.2.1.4 SOD对全身照射小鼠存活率的影响
SOD对脂类过氧化、红细胞溶血以及干细胞、外周红细胞与白细胞的辐射损伤都有防护效应,其中对干细胞的损伤还表现了治疗效果。这些生物学作用暗示SOD对全身照射引起的辐射损伤也可能有效。在这方面,Petkau首先提出了实验证据,我国科学工作者亦证实了SOD的确可提高全身照射小鼠的存活率。
Petkau在实验中对实验动物给予SOD的途径为静脉注射。这种给予SOD的方法既有助于SOD与血细胞的直接接触,又可借血液循环将SOD运送到全身组织。他曾观察到静脉注射后1h动物全血中SOD含量达到最高,而且脾、肝、胸腺与胃中SOD也有增加,但随后下降。
在此实验条件下,Petkau观察到分别注射15μg/g(体重)、35μg/g(体重)、70μg/g(体重)和100μg/g(体重)SOD的4组动物中,以35μg/g的注射量防护效果最好。如表16-6所示,注射0.1mol/L NaCl的6.5Gy照射小鼠的30天死亡率为85%,而注射35μg/g SOD的小鼠经同样辐射量照射后死亡率却下降至21%。
表16-6 6.5Gy辐射量照射后小鼠死亡率
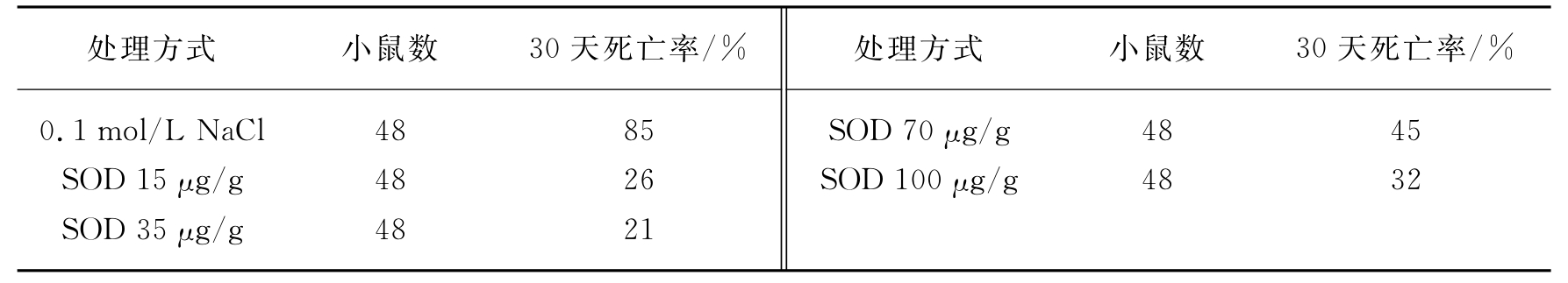
Petkau进一步观察到,将SOD注射量增加至200μg/g尚可使其防护效果提高。此外,照射前给予200μg/g SOD外,再在照射后1h给予SOD 35μg/g,可使防治效果更为增加。这种效果绝非酶蛋白效应,因为用灭活的SOD注射并不能减少死亡率。
为什么SOD对辐射损伤既有防护作用,又有治疗效果?Petkau认为有以下四点解释:
(2)外源性SOD进入动物体后,94%在细胞外液,因此可在细胞外液中发挥SOD清除 的作用,进入细胞内的SOD虽不及6%,但其清除效率据Petkau的计算可以较细胞外增高430倍,故进入细胞内的SOD在防治辐射损伤的作用机制中可能起主要作用。
的作用,进入细胞内的SOD虽不及6%,但其清除效率据Petkau的计算可以较细胞外增高430倍,故进入细胞内的SOD在防治辐射损伤的作用机制中可能起主要作用。
(3)照射后给予SOD可能既起到补充SOD消耗或减轻SOD活性下降的影响,又可能增强了清除内源性 的能力,从而可使动物体内
的能力,从而可使动物体内 生理浓度尽可能得到维持,减轻损伤,促进恢复。
生理浓度尽可能得到维持,减轻损伤,促进恢复。
值得考虑的是辐射损伤时SOD的性质是否发生变化的问题。已知老龄动物中SOD的性质发生变化,肿瘤细胞中Mn-SOD的性质也发生改变,而且我们已观察到整体照射时动物组织与血液中SOD的相对泳动率减低,因此照射后SOD的性质也许会发生改变。在照射前和照射后给予SOD可能起到照射后代替低活性或无活性的SOD的作用。如果此方面原因是主要的,则纠正SOD性质改变的措施可能在辐射损伤防治上起到良好效果。
16.2.1.5 SOD对放射治疗肿瘤病人的放射病综合征的疗效
肿瘤病人进行放射治疗时,不可避免地会发生放射病综合征。既然在动物实验中已观察到SOD对辐射损伤的防治效果,就可将SOD制剂(orgotein)应用于临床。这些年来,SOD制剂确已在临床上试用,其结果证明SOD对放射治疗病人放射病综合征确有较好疗效。下面简述其应用效果。
(1)使急性炎症减轻。放射治疗病人可能发生急性炎症,其主要病因是辐射既可引起细胞破坏,也会使吞噬细胞(包括嗜中性白细胞与巨噬细胞)活性增强,释放某些物质。由于吞噬细胞呼吸爆发,消耗了大量的氧,必然导致 产量增高。由于
产量增高。由于 的产生超过了清除能力便会逸出细胞外,可能使活化的吞噬细胞损伤,并且还会使邻近的细胞和结缔组织损伤。这样一来,组织细胞裂解和细胞炎症因子释放可造成进一步的破坏,导致更多的吞噬细胞的汇集,使发炎面积更为扩大。在放射治疗期间,每日辐射量照射可造成细胞不断被破坏。由于
的产生超过了清除能力便会逸出细胞外,可能使活化的吞噬细胞损伤,并且还会使邻近的细胞和结缔组织损伤。这样一来,组织细胞裂解和细胞炎症因子释放可造成进一步的破坏,导致更多的吞噬细胞的汇集,使发炎面积更为扩大。在放射治疗期间,每日辐射量照射可造成细胞不断被破坏。由于 起到破坏作用,外源性SOD的加入应当有利于清除
起到破坏作用,外源性SOD的加入应当有利于清除 ,从而可预防或改善辐射所致的急性炎症。必须指出的是SOD的加入并不影响辐射直接或间接造成的肿瘤细胞的胞内效应。
,从而可预防或改善辐射所致的急性炎症。必须指出的是SOD的加入并不影响辐射直接或间接造成的肿瘤细胞的胞内效应。
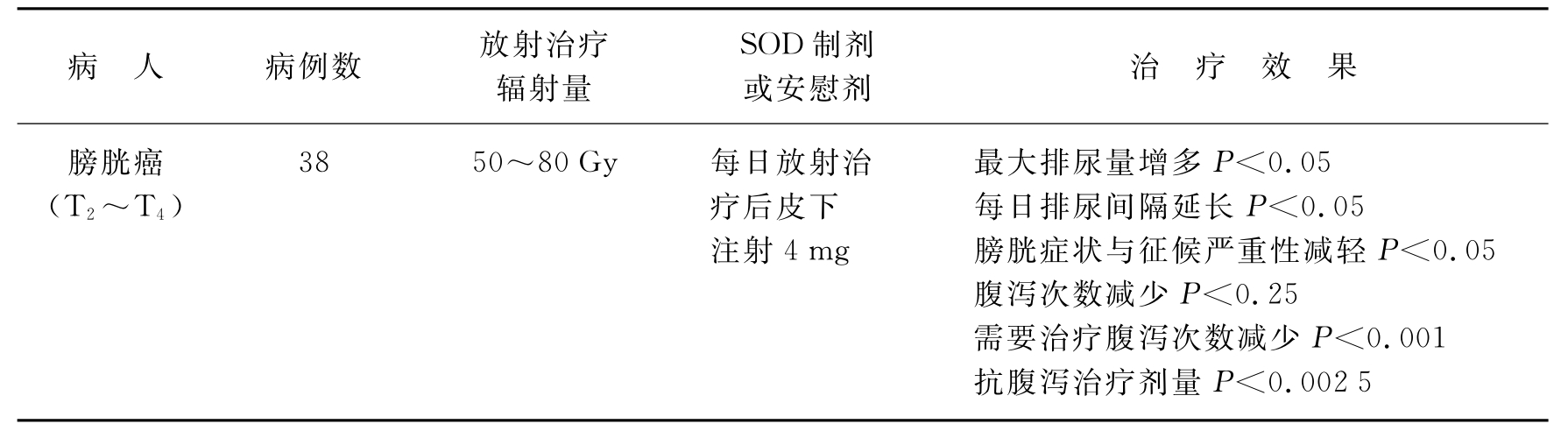
例如,对膀胱癌病人38例进行放射治疗时所用的辐射量为50~80Gy,而每日辐射增加量为2Gy。在这样的照射条件下病人受到辐射量是比较高的。这必然会影响癌以外组织如肠、膀胱及尿道的急性副效应,即所谓的急性炎症。在放射治疗期间及照射后,每日给予SOD治疗,或给予安慰剂作为双盲法对照,其治疗效果均显著或非常显著(见表16-7)。
表16-7 用双盲法对放射治疗肿瘤病人的放射病综合征进行SOD治疗的效果
(2)使慢性炎症减轻。对子宫颈癌病人进行放射治疗所引起的膀胱慢性炎症,一般用药物和手术治疗效果甚微。如果用SOD制剂治疗则不仅有效,而且很安全。SOD的平均有效治疗剂量为10~90mg,每次平均剂量为7~30mg。
在临床上对SOD制剂的适应征为疼痛、痉挛、排尿困难、尿失禁、血尿。经SOD治疗后遗症明显减轻,膀胱镜检查抗炎效果十分明显。采用SOD减轻放射治疗肿瘤病人的放射病综合征,不仅可使患者有较好的生活基础以适应治疗,而且可使医生考虑增加放射剂量以提高疗效。
(3)涂青松等用随机对照双盲方法,以3∶1的比例分为SOD治疗组119例和安慰剂组40例。均在放疗后1.5~1h内肌肉注射SOD,总量DT为50~80Gy/35~36天。SOD治疗组总有效率为71.4%;其中显效率29.4%,有效率42%,无效率28.6%。安慰剂组总有效率为27.5%;其中显效率12.5%,有效率15%,无效率72.5%。两组结果比较有显著性差异(P<0.01)。全组仅1例在放疗结束时即注射SOD,最后1针后出现虚汗、无力,休息后即恢复正常。
陈华东总结了一些临床病例,SOD深部皮下注射治疗因前列腺癌或膀胱癌放射治疗后所引起的38例膀胱炎,显著优于安慰剂,且尿失禁、疼痛、排尿困难等均有改善。将SOD配合用于头颈部癌的放疗、化疗患者12例(放疗8例,化疗4例),均能减轻全身与局部反应,增进食欲。患者均能按计划结束疗程。此外,吴升华用L-SOD治疗34例放疗病人,使80%的放疗后纤维化灶明显软化。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














