第一节 RNA干扰理论基础
RNAi理论还在不断发展和完善中,目前公认的RNAi的分子机制模型是建立在所发现的几种酶及蛋白质与RNA形成复合物的基础上,主要内容包括双链RNA的复制、酶切、与mRNA形成沉默复合物、mRNA的降解和小干扰RNA(small/short interference RNA,siRNA)的扩增与重复利用。
一、RNAi发展简史
RNAi的研究可追溯到20世纪90年代初期,当时研究者发现在植物和真菌中存在对转基因序列应答的转录后沉默方式。1990年,Rich Jorgensen和他的同事尝试把由一强有力启动子控制的基因pigment-produing导入矮牵牛花以加深花的紫色,结果不但颜色未加深,许多花呈现杂色甚至白色,说明外源基因和内源基因的表达同时被抑制。他们称此现象为共抑制(co-supression)。1992年,Roman和Macrino在粗糙脉孢真菌进行转基因研究时,发现了存在于真菌中的类似现象,他们称之为基因压制(quelling)。1995年,Guo和Kempheus等在试图用反义RNA技术阻断秀丽线虫(C.elegans)的par-1基因时,发现反义RNA和正义RNA都能同样地阻断该基因的表达,这与传统上的解释正好相反。该研究小组一直没能给这个意外的结果以合理解释。直到1998年,Fire和Mello等将体外转录合成的单链RNA(反义RNA或正义RNA)注射给秀丽线虫,基因抑制效果微弱;将正义和反义构成的双链RNA注射到线虫中,却能高效特异地阻断相应基因的表达。他们把这种双链RNA对基因表达的阻断作用称为RNA干扰。随后的研究发现,RNAi现象在多种生物中存在,如线虫、果蝇、拟南芥、水螅、蜗虫、锥虫、斑马鱼、真菌及植物等。
1999年,Tuschl等报道在哺乳动物中也存在RNAi,只是导入的RNA是短的双链RNA,即小干扰RNA(small/short interference RNA,siRNA)。2001年,Elbashir等报道,siRNA能在小鼠和人的细胞中阻遏基因的表达活性。随后,Faddison等人的实验表明,siRNA可以稳定地抑制小鼠的体细胞和胚胎干细胞的基因表达。由此人们认识到RNAi作为研究基因功能的一种有力的革命性的工具,在哺乳动物基因研究中有广阔的应用前景,尤其是在基因功能研究、转基因动物的制备、基因治疗、药物开发方面具有巨大的潜力。
而内源性小分子RNA的发现可追溯到1993年,当时Ambros等发现,控制线虫幼虫发育时序的一个已知基因lin-14并不编码产生蛋白质,而是产生一对小RNA。后来的研究进一步发现lin-14RNA与lin-14基因的3′UTR区存在多个互补位点,可以减少lin-14的蛋白产量,但不影响lin-14mRNA的水平。2000年,在线虫中又发现了另一个非编码RNA分子——let-7,研究发现let-7RNA可以促进晚期幼虫向成虫的过渡。这两种RNA最初被统称为小瞬时RNA(small temporal RNA,stRNA)。随后不到一年的时间内,在线虫、果蝇和人类细胞中克隆出上百种微小的非编码RNA,这些小RNA与lin-14和let-7相似,均为22nt大小,推测其都来自具有茎环状结构的前体,将它们统称为小或微小RNA(microRNA,miRNA)。
随着研究的深入和发展,发现miRNA和siRNA在加工和表达机制上有许多相似的地方,两者同为Dicer的水解产物,同为RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)的组分,两者作用的发挥均有赖于小RNA与靶mRNA之间的互补程度,进而剪切mRNA或抑制翻译的进行,说明细胞内部也存在类似RNA干扰的基因沉默机制。
二、RNAi的生物学功能
RNAi的生物学功能还在不断被发现中,就目前的了解,其功能主要体现在以下几个方面。
1.病毒防御 防止通过RNA中介体的病毒或“跳跃”因子的基因表达可能是RNAi的主要功能之一。当病毒RNA侵入细胞后,RNAi就是机体监视系统的成员,检测病毒信息,降解病毒核酸,维持宿主基因组的稳定性,保护机体不受病毒侵犯。如在果蝇细胞中,RNAi可以抵御FHV的入侵。在哺乳动物中,针对脊髓灰质炎病毒和丙型肝炎病毒的体外RNAi显著地降低了人类细胞中培养的病毒滴度。
2.调节基因表达和参与机体发育 RNAi调控机体内基因的表达是其最激动人心的功能。目前的试验结果表明,广泛存在于生物体内的siRNA主要通过两种方式直接调节基因表达:①通过与靶mRNA3′的非翻译区(3′untranslated region,3′UTR)结合抑制其翻译。②通过RNAi途径降解靶mRNA。③也有证据表明内源siRNA可以通过调节染色质的凝集而调节基因表达,也可通过siRNA诱导基因组修饰。这两种水平的调节,不仅保证了RNAi适时适度的发生和进行,而且与生物的发育调控密切相关。
3.清除畸变的RNA RNA依赖下的RNA聚合酶(RNA-dependent RNA polymerase,RdRP)可催化细胞内的畸变RNA转变成双链RNA(double strands,dsRNA),后者进入RNAi途径被降解。
4.参与基因组重排 在四膜虫接合过程中,siRNA可能通过与染色体上的特异序列的结合导致染色体的断裂和DNA的缺失,这一过程可能与重组区域组蛋白的甲基化有关。
5.抑制转座子活性 转座子带有正向的或反向的末端重复序列的可移动元件,它的移动可导致基因重组,往往不利于生物生存。当转座子中某些基因改变,转录后能产生小发夹RNA(small hairpin RNA,shRNA),shRNA具有的发夹结构类似siRNA分子,可诱发RNA干扰,引起编码转座酶的mRNA的降解,抑制了转座子的转座,从而维护基因组的完整性。
三、RNA干扰机制及其特点
RNAi的分子机制现在还没有完全弄清楚,在线虫、果蝇、植物和动物卵细胞的RNAi试验中,相继发现了一些与RNAi作用相关的酶和蛋白质。RNAi在哺乳动物中的机制基本上与果蝇和其他低等生物中RNAi的机制相似。目前,关于siRNA的作用机制主要有3种模型:①在与靶基因序列完全互补的情况下,导致靶序列的降解;②在与靶基因序列不完全互补的情况下,使靶基因翻译受到抑制;③通过甲基化修饰影响染色质的结构(如异染色质的形成),从而导致转录水平上的抑制。那么,siRNA又是如何产生的呢?
siRNA具有5′磷酸和3′端两个核苷酸的突出的特征,表明siRNA可以由RNA双链特异性内切核酸酶RNaseⅢ(RNA酶Ⅲ)家族成员产生。2001年,Bernstein等发现只有长度为22个核苷酸(nucleiotide,nt)的双链RNA才能特异地阻断基因的表达,同时他们还成功地从果蝇中分离出一种能特异性切割dsRNA的核糖核酸酶——Dicer酶,细胞内dsRNA在Dicer酶的作用下可形成约22bp大小的小干扰RNA。随Dicer酶在果蝇中发现后,在植物、线虫、真菌和哺乳动物细胞中也找到其同源基因,即RNA酶Ⅲ家族,可见该酶是一个进化上保守的蛋白质。Dicer酶有5个组成部分:N端RNA解旋酶结构域,1个PAZ(piwi argonaut zwillwe/pinehead,PAZ),2个RNA酶Ⅲ结构域及C端dsRNA结合域。其活性形式为二聚体,反向平行的RNA酶Ⅲ结构域形成2个催化中心,每个催化中心均有2个单体酶,与dsRNA结合时形成4个酶解中心,但中间2个并未活化。
现在公认的RNAi的分子机制模型,把RNAi发生的基本过程分为起始阶段和效应阶段。在起始阶段,RNA酶Ⅲ(在果蝇中命名为Dicer)及其可能的dsRNA结合因子,以ATP依赖的方式将长片段dsRNA切割成21~23bp的siRNA。在效应阶段,siRNA组装成一个siRNA-核糖核蛋白复合体(siRNP),siRNP重排形成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)。这一重排推测是在Argonaute蛋白家族中的一个成员和其他辅助因子(如催化亚基)的协助下完成的。RISC以ATP依赖的方式催化双链siRNA解旋,随后与之完全互补的靶mRNA与siRNA的正义链置换,通过碱基配对识别与RISC内部的siRNA反义链结合,RNA酶切割靶mRNA,从而导致目的基因的沉默。RISC可再次激活以催化另一轮的RNA切割(图11-1)。这是RNAi机制的第1条途径;基因沉默的第2条途径是:若RISC内部的siRNA与靶mRNA部分互补可阻断翻译的进行;第3条途径是:RISC还可以与染色质结合,使之结构改变,达到基因表达调节的目的。
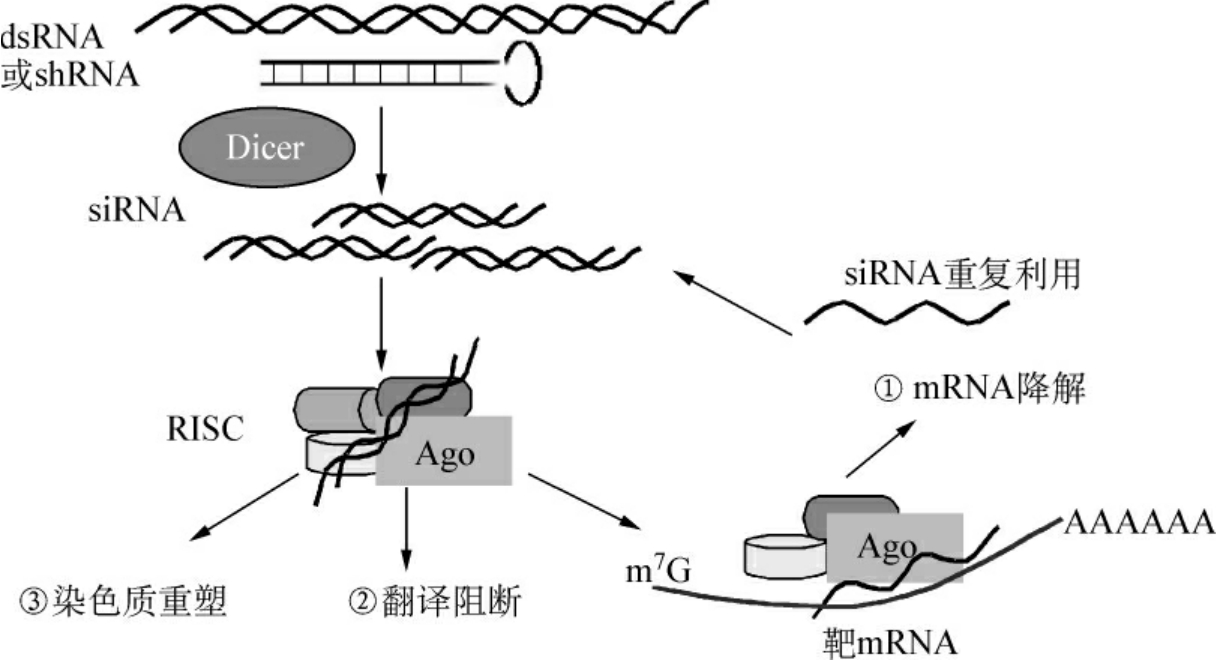
图11-1 RNAi机制模型
近年来,在许多生物中还发现了非编码的单链微小RNA(microRNA,miRNA)的存在,miRNA也通过与siRNA相似的机制导致基因沉默。在miRNA作用途径中,细胞内源基因首先被转录成原始miRNA(primary miRNA,Pri-miRNA),之后在Drosha酶的催化下产生75nt的具有发夹结构的miRNA的前体(Pre-miRNA),然后转运到细胞质中,再在Dicer酶的作用下剪切成为miRNA,以图11-1的机制抑制基因表达。但是在哺乳动物中,miRNA大多数是通过阻遏翻译来发挥作用,而不是mRNA的降解。
因少量双链RNA即能阻断基因表达,且此效应可传至子代细胞,推测细胞内存在RNAi的扩增系统。研究者们发现,在真核细胞内也存在异RNA为模板指导RNA合成的聚合酶(RNA-directed RNA polymerase,RdRP)。在RdRP的作用下,进入细胞内的双链RNA通过类似PCR的过程,呈指数级的数量扩增。双链RNA进入细胞后,一方面在Dicer酶的作用下被切割成小片段siRNA。另一方面,在RdRP的作用下自身扩增后,再被Dicer酶切割成小片段siRNA。siRNA与mRNA结合后,可以作为引物,以mRNA为模板,在RdRP作用下合成出mRNA的互补链。结果mRNA也变成双链RNA,在Dicer酶的作用下也被切割成siRNA。这些新生成的siRNA也具有诱发RNAi的作用。与mRNA结合的siRNA和核酸酶在mRNA降解后得以再生,继续下一轮的结合、扩增和降解。这样周而复始,细胞内的siRNA大大增加,显著增加了对基因表达的抑制作用(图11-2)。正是这种机制赋予了RNAi的高效性和持久性。此外,利用以上扩增产生的沉默信号分子还可以通过细胞间连接和跨膜通道在相邻细胞间传递,甚至可达长距离系统性的扩散。
综上所述,RNAi具有以下几个特点:①RNAi是转录后水平的基因沉默机制,针对基因内含子或启动子序列的dsRNA无干扰效应。翻译抑制剂对RNAi不产生影响。②RNAi具有高度特异性,能特异地抑制相应基因的表达。③RNAi抑制基因表达的效率高,具有放大作用,相对少量的dsRNA就可以使表型达到缺失突变体程度。④RNAi效应具有持久性,并可在不同细胞甚至不同生物间传递和维持,还可传递给子代。⑤在一定范围内,RNAi具有dsRNA浓度和作用时间的双重依赖性。
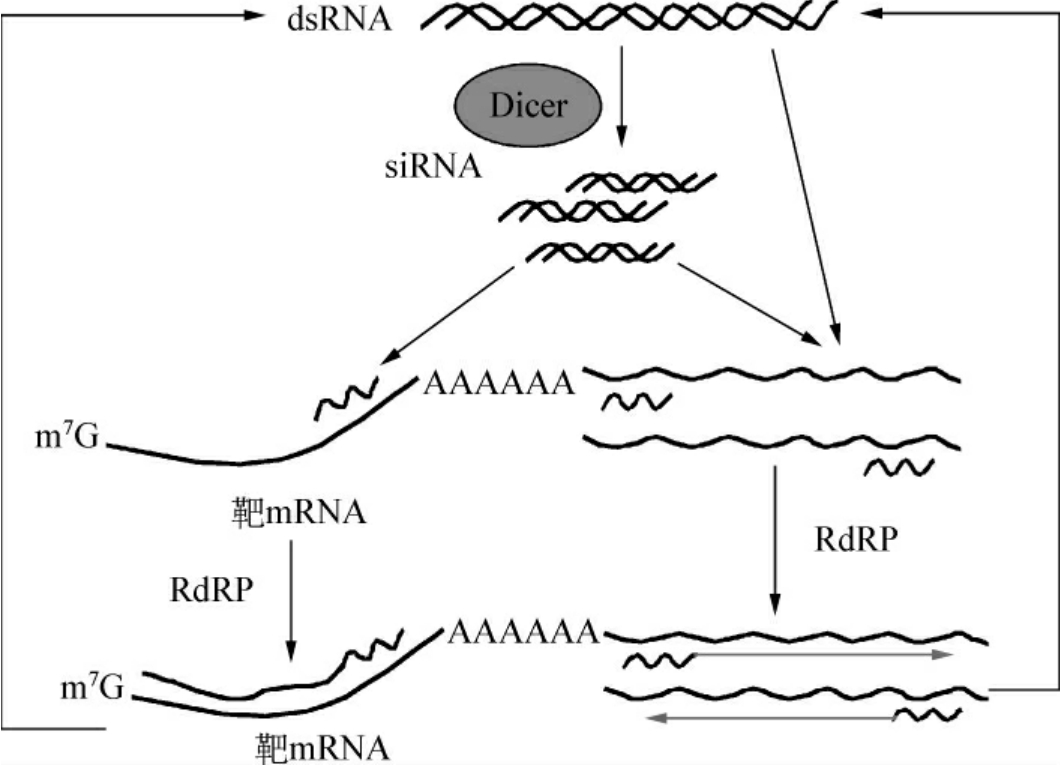
图11-2 RNAi扩增模型
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















