第一节 移植肾排异反应
自体肾移植和同卵双生者的异体肾移植,由于供、受者的组织抗原的一致,故不发生排异反应。但在同种异体移植或异种移植,由于供、受者双方组织抗原性明显差别或不一致性,移植肾受者的淋巴组胞,将视供肾为外来抗原而发生由细胞和(或)体液介导的免疫反应,即称为排异反应(rejection)。根据排异反应的发生机制、临床表现和病理形态特点的不同,一般可将其分为超急性、急性和慢性排异反应3种(表8-1)。
表8-1 肾移植排异反应的病理分类

注:本表译自由Colvin RB和Nickeleit V撰写的《肾移植病理学》.见:Jennette JC,等主编的《Heptinstall's肾病理学》,第6版,第1354页。
一、超急性排异反应
超急性排异反应(hyperacute rejection),或称立即性排异反应(immediate rejection),最早是在供、受者ABO血型不符的移植中发现的。目前,由于临床已采取严格控制供、受者血型的匹配,故这种情况在临床上已很少发生或不再发生。超急性排异反应,是一种在肾移植手术结束后数分钟至几小时内,迅速发生的排异反应。常在移植肾血管吻合接通后,其色泽即刻变为暗红、青紫,质地变软,水肿加重而使其体积不断增大,其病变可延续到肾盂和输尿管。
【发生机制】
超急性排异反应,是一种以体液(即抗体介导)性免疫反应为主的肾损害,多与受者血液内预先存在抗供者组织抗原(HLA抗原)抗体有关。受者预先存在的抗供者抗体,常可因移植前反复多次的血液透析、输血,或曾接受过移植物而产生针对他人血小板、白细胞或其他体细胞表面丰富HLA抗原的抗体,或因多胎妊娠而产生针对胎儿HLA抗原的抗体,或因感染过某些与人体组织可能存在交叉或共同抗原的细菌(特别是链球菌)抗体等。这类抗体可在富含HLA抗原的供肾血管内皮细胞,发生直接结合或沉积,继而又结合补体,导致移植肾血管腔内血栓形成和随即发生肾实质的缺血性坏死。
【病理改变】
发生超急性排异反应的移植肾,其外观已如前述,或称其为“大出血性肾”。病变早期,镜下常发现肾小球和肾小管周围毛细血管腔内,出现多量中性粒细胞聚集。随后即可见肾实质的多数肾血管壁发生纤维蛋白样坏死,管腔内形成由大量纤维蛋白和血小板组成的血栓(图8-1),且伴有肾实质梗死灶形成及肾间质广泛的出血和水肿(图8-2),其病变可自肾实质一直延伸至肾盂、肾盏和输尿管的黏膜。
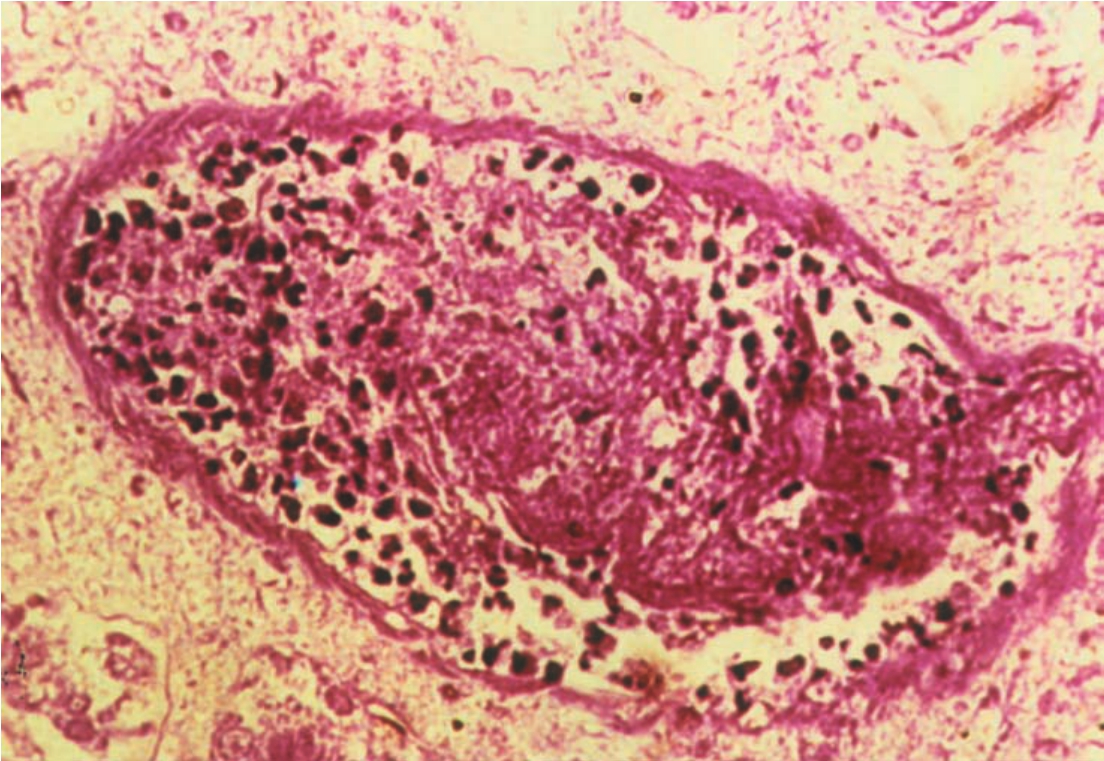
▲图8-1 超急性排异反应(HE ×400)
肾小血管内混合性血栓形成

▲图8-2 超急性排异反应(HE ×100)
肾组织内多个血管壁发生纤维蛋白样坏死,伴管腔内纤维蛋白血栓形成,肾间质广泛淤血和出血
免疫荧光检查显示,移植后即刻可呈现节段性分布的颗粒和线状的IgG、C3,可在肾小球和肾小管周围毛细血管壁沉积,随后即有纤维蛋白沉积于毛细血管管壁,并可阻塞管腔,但常可呈阴性。
电镜检查常显示,早期为血小板在毛细血管腔内的聚集,随后有中性粒细胞、纤维蛋白和红细胞的积聚,还伴有内皮细胞的损伤、脱失及基膜的暴露等。
【鉴别诊断】
与其鉴别的唯一病症是因血管吻合不佳所引起的肾供血不佳。只要手术医师对吻合血管进行仔细的检查,其鉴别并不困难。
【预后】
发生超急性排异反应的移植肾常迅速发生无尿,或开始时有极少量尿液排出后,转而变为无尿,其功能完全丧失。此时,如不及时将其切除,会严重威胁患者的生命。
二、急性排异反应
急性排异反应(acute rejection)是同种异体肾移植中最常见的一种排异反应,一般多发在移植后的数日至几个月之内,少数也可发生移植后数年或在抗排异药物减量或停用后。发生急性排异反应的受者,其临床表现有发热、乏力、移植肾肿痛、尿量减少、体重增加、血肌酐水平升高等。急性排异反应包括细胞和体液介导的两种免疫反应,尤其在病程数周以上的病例中,其两型病理改变常可同时存在。对急性排异反应的分类有两种:一种是根据其病变性质和(或)病变程度,采用分别由美国国立卫生研究院(NIH)移植协作性临床试行方案(Cooperative Clinical Trial of Transplantation,CCTT)和Banff所提出的3型分类法,即Ⅰ型(小管间质型)、Ⅱ型(动脉内膜炎型)和Ⅲ型(血管壁纤维蛋白坏死或透壁性炎症型);另一种则分别根据其发生机制的不同,可分为T细胞介导和抗体介导两种类型。本节根据后一种分类法进行叙述。
(一)急性T细胞介导排异反应
急性T细胞介导排异反应(acute T-cell-mediated cellular rejection),即急性细胞型排异反应(acute cellular rejection,ACR)。多发生肾移植术后的早期,自数日至数周内,偶可发生于移植术数月或几年后。
【发生机制】
急性T细胞介导排异反应主要是由受者T淋巴细胞,通过识别同种移植抗原(allogeneic antigen或alloantigen),经两种方式,即CD8+细胞毒淋巴细胞(CTL)介导的直接杀伤作用和CD4+协助淋巴细胞介导而触发的迟缓性超敏反应而引起。前者是指受者T细胞,经识别移植物中抗原递呈细胞(树突细胞为主)表面的MHC分子,即Ⅰ、Ⅱ类HLA分子及其协同刺激分子(B7-1、B7-2)后,其CD8+细胞在识别其Ⅰ类抗原后便分化成CTL,这种成熟的CTL可直接攻击移植肾组织;后者是因CD4+协助细胞亚型被刺激增生,并分化成Th1效应细胞,在其识别移植物Ⅱ类抗原后,通过分泌细胞因子而增加血管壁的通透性,促进局部组织中单个核细胞(淋巴细胞和巨噬细胞)的浸润,活化巨噬细胞而引起移植肾组织的损伤,其反应酷似迟缓性超敏反应。
【病理改变】
移植肾最常见、早期的组织病理改变,是以肾间质广泛的单个核细胞浸润、水肿为特征,严重的病例可伴有间质出血(图8-3),可称为急性小管间质型排异反应(acute tubulointerstitial rejection)。此时,单个核细胞浸润多集中分布在肾间质血管、毛细血管和肾小管周围的间质中(图8-4,8-5),其中部分为激活的淋巴细胞(即淋巴母细胞),其体积变大,胞质丰富,嗜碱性强,核膜清晰,核仁较清楚,偶见核分裂象,经甲基绿-派若宁染色可显示,其胞质内呈紫红色的RNA颗粒。免疫组化染色显示其表达白细胞介素-2受体(IL-2R)。部分为体积较小的淋巴细胞,其形态与正常小淋巴细胞无多大区别,但经免疫酶标染色可证实其为CD4+、CD8+细胞。其他的炎症细胞,还有浆细胞和巨噬细胞,但其出现一般较迟,也可伴有少量中性和嗜酸性粒细胞等。单个核细胞可侵犯肾小管,引起肾小管坏死,称为小管炎(tubulitis)(图8-6)。
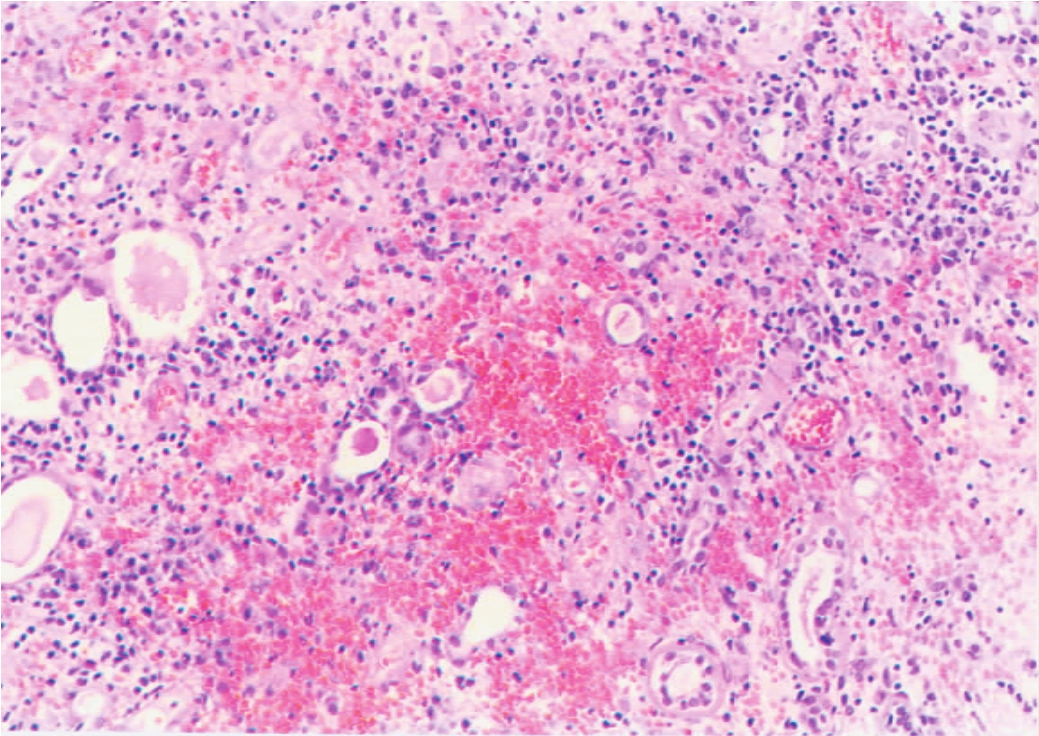
▲图8-3 急性排异反应(小管间质型)(HE ×100)
肾间质出血伴有大量淋巴细胞浸润及肾小管坏死溶解,少数肾小管扩张、蛋白管型形成

▲图8-4 急性排异反应(小管间质型)(HE ×200)
肾小管周围间质及毛细血管腔内有大小不等的淋巴细胞浸润
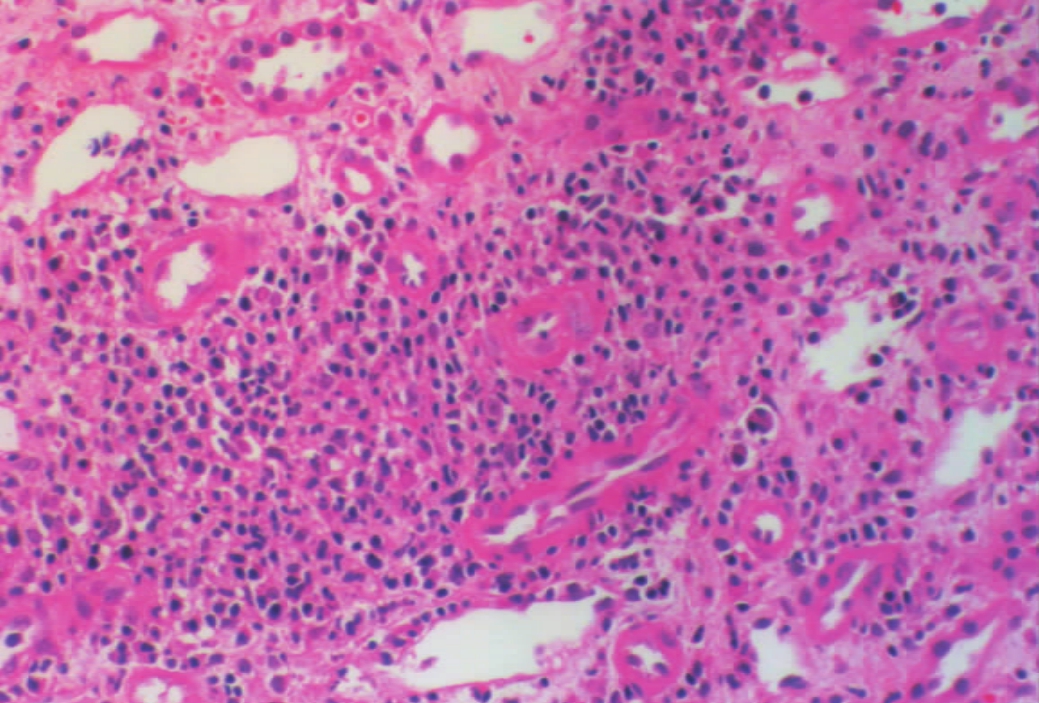
▲图8-5 急性排异反应(小管间质型)(HE ×200)
肾微动脉及小管内有大小不等的单个核细胞浸润

▲图8-6 急性排异反应(小管炎)(HE ×400)
肾小管管壁、管腔内淋巴细胞浸润
CD8+细胞也可损伤血管内皮细胞,从而引起动脉内膜炎(endothelitis),表现为内皮细胞肿胀,管腔、内膜层有淋巴细胞浸润(图8-7,8-8),其程度不等,有时可侵犯整个管壁,称其为透壁性炎症(transmural inflammation)(图8-9)或发生管壁的纤维蛋白样坏死。在少数病例中,肾小球也可被累及,表现为肾小球内以T细胞为主的单个核细胞浸润伴内皮细胞肿胀、脱落,可致GBM暴露,乃至肾小球内形成微血栓,称为急性移植体肾小球炎(acute transplant glomerulitis),或称急性同种移植体肾小球病(acute allograft glomerulopathy)(图8-10)。
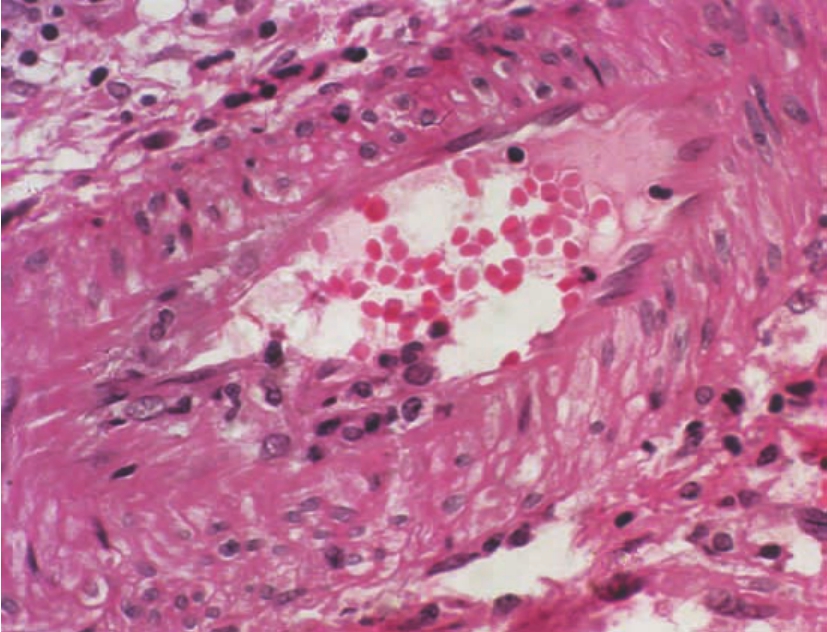
图8-7 急性排异反应(动脉内膜炎)(HE ×400)
肾小动脉灶性内膜肿胀,伴少量淋巴细胞浸润,其管腔内也有少量单个核细胞聚集
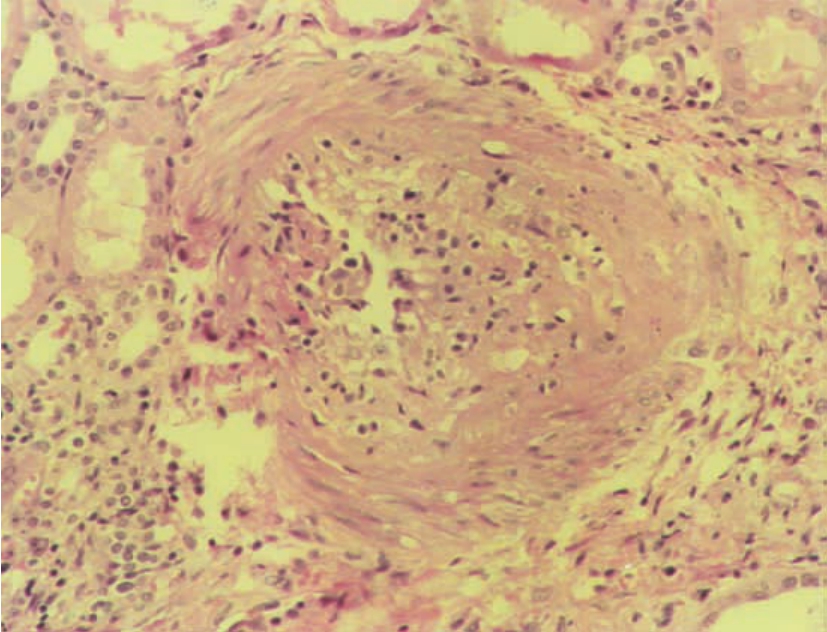
图8-8 急性排异反应(动脉内膜炎)(HE ×100)
肾小动脉内膜肿胀,伴多量单个核细胞浸润
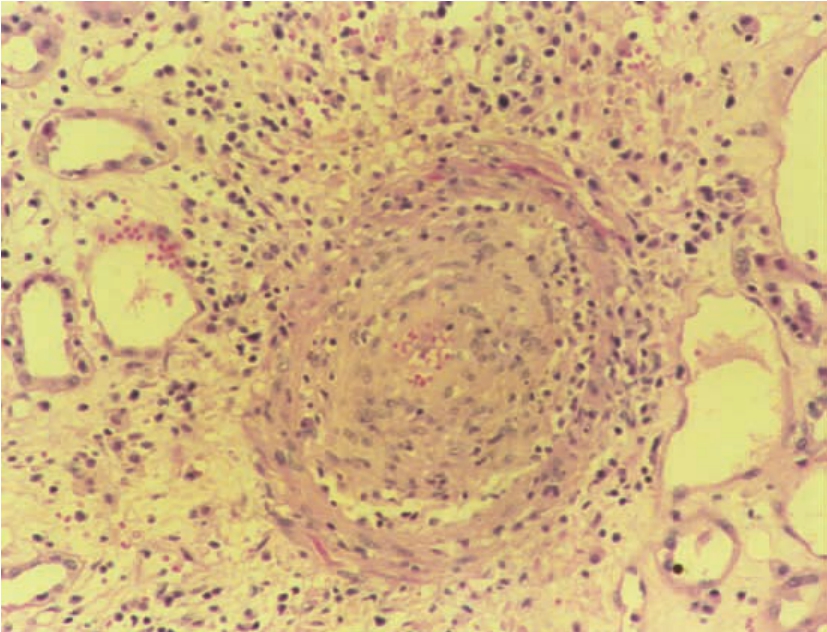
▲图8-9 急性排异反应(血管炎)(HE ×100)
肾小动脉内膜增生,管腔、管壁及管周有大量单个核细胞浸润
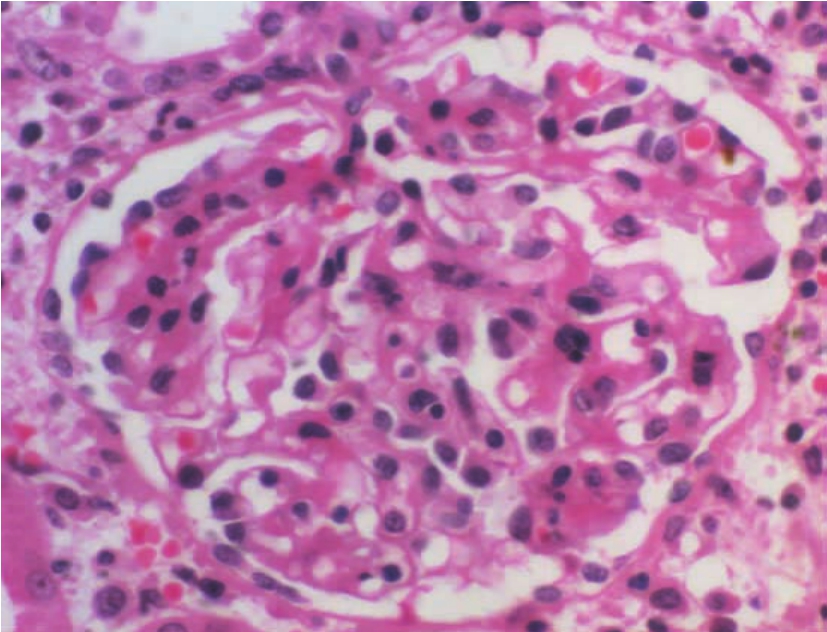
▲图8-10 急性排异反应(肾小球炎)(HE ×400)
肾小球内出现多个淋巴细胞浸润
免疫荧光检查显示,肾小球和肾血管的免疫球蛋白、补体常呈阴性。
电镜检查显示,以淋巴细胞(1/3为淋巴母细胞)为主的单个核细胞,可广泛浸润于肾小球、肾小管周围毛细血管腔内(图8-11)、肾小管壁或管腔和肾间质(图8-12)。

▲图8-11 急性排异反应(EM ×4 500)
肾小管周围的毛细血管腔内淋巴细胞、中性粒细胞浸润
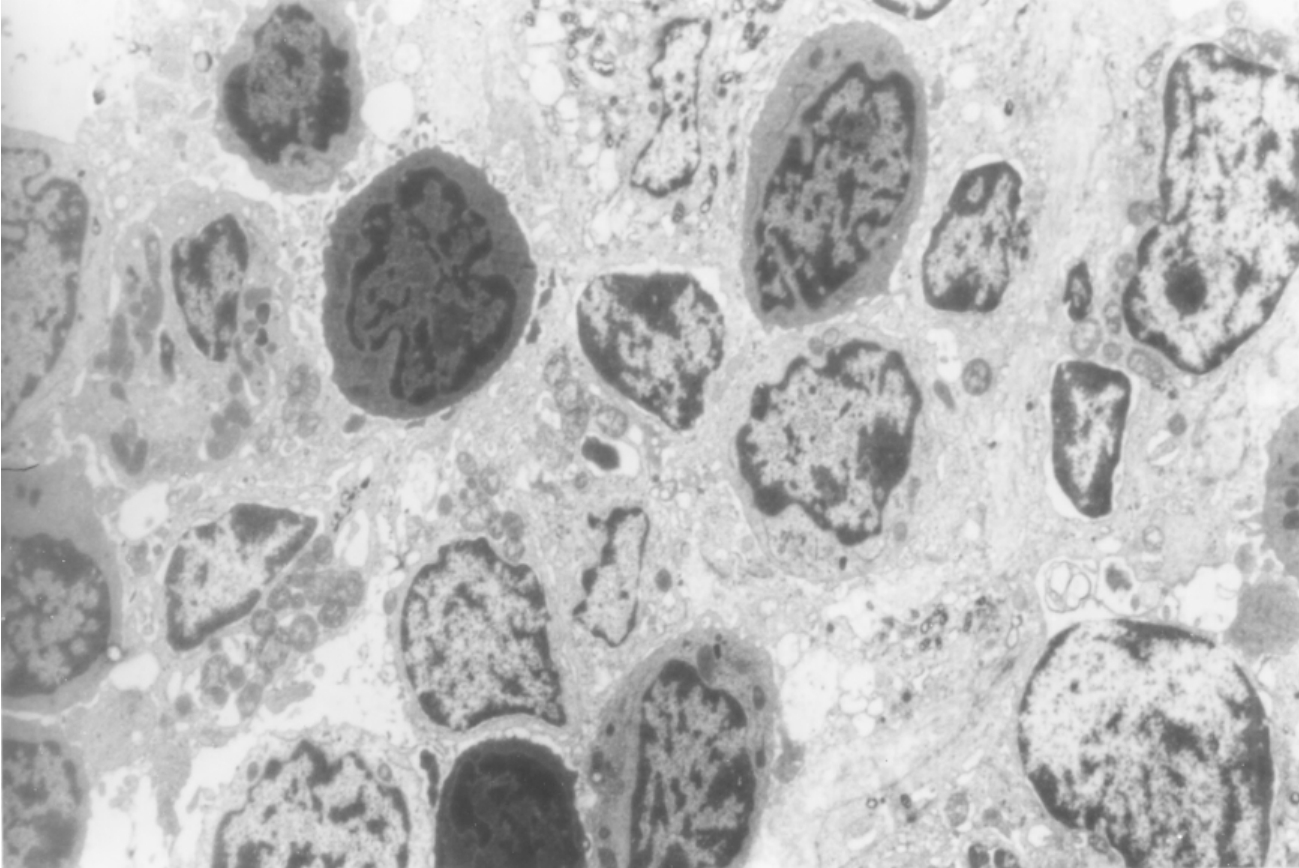
▲图8-12 急性排异反应(EM ×3 750)
肾间质内大量单个核细胞浸润
【鉴别诊断】
须与急性排异反应的小管间质型作鉴别的肾病变,包括:①急性肾小管坏死。本病中浸润肾组织的单个核细胞,甚少呈派若宁染色呈阳性,有核分裂象、活化的标志(如Ia、IL-2R等),间质水肿不明显,肾小管上皮细胞HLAⅡ类抗原表达不增强等,均明显不同于急性排异。②环孢素肾毒性。常出现细动脉(入球微动脉为多)透明变性、近端小管直段上皮细胞胞质等大的空泡变性、条纹状分布的肾小管萎缩伴间质纤维化、肾小管上皮细胞HLAⅡ类抗原表达的降低等改变,借此可与急性排异反应作鉴别。③肾盂肾炎。本病急性期以多量中性粒细胞浸润为特点,而慢性期浸润肾组织的细胞甚少或无淋巴母细胞和巨噬细胞成分。④淋巴增生性疾病。十分少见,且常以呈灶性或弥漫性分布增生的B细胞为主,不仅具有B细胞的标记(SIg、CD20等),还常经原位分子杂交证实其含EB病毒。即使偶见以T细胞增生为主时,但其形态异形,不伴有小淋巴细胞和巨噬细胞成分。
【预后】
急性T细胞介导排异反应是一种可逆性改变,可随着抗排异药物剂量的增加,间质炎症细胞浸润和水肿的程度可获减轻,其肾功能也获得改善。
(二)急性抗体介导排异反应
急性抗体介导排异反应(acute antibody-mediated rejection),即急性体液性排异反应(acute humoral rejection),也称急性血管型排异反应(acute vascular rejection,AVR)或排异反应性血管炎(rejection vasculitis)。多发生肾移植术后2周或几个月之后,偶可发生于肾移植术数年后。
【发生机制】
急性抗体介导排异反应主要是由受者抗供者同种异体抗原的抗体参与的免疫反应。这类抗体作用的最初靶子是血管内皮细胞,既可像超急性排异反应一样,直接结合或沉积于血管内皮细胞,继后又可通过结合补体,致移植肾血管腔内血栓形成和肾实质的缺血性坏死;也可经抗体依赖性或急性体液性细胞毒性作用而表现为血管炎。
【病理改变】
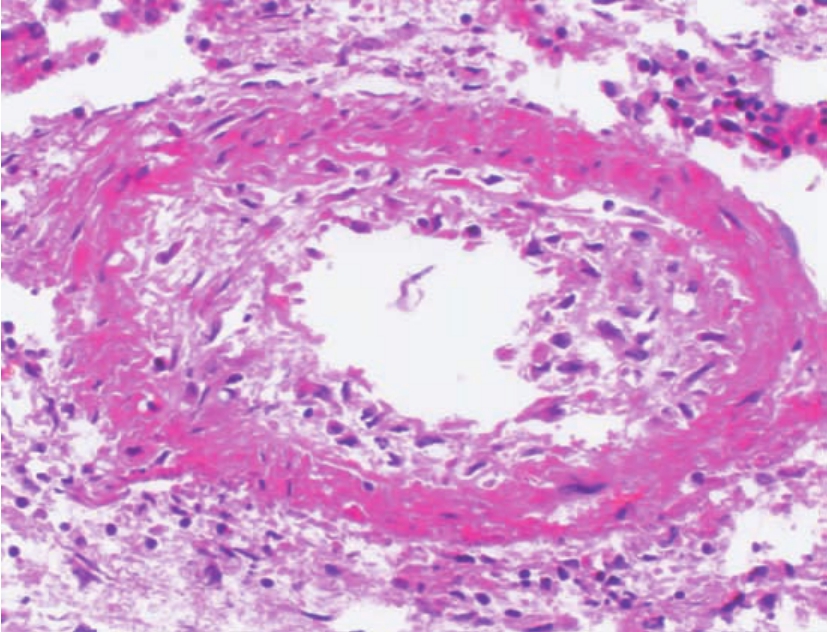
移植肾的组织病理改变以坏死性血管炎为主要特征。轻者仅表现肾细动脉、小动脉壁的纤维蛋白样坏死(图8-13,8-14),PAS可呈阳性反应,病变的分布很不均匀,常呈局灶性或节段性分布,还伴有管壁中性粒细胞或淋巴细胞浸润,抗体、补体和纤维蛋白沉积及管腔内血栓形成。上述病变也可延伸至肾小球的毛细血管襻,形成肾小球部分血管襻的纤维蛋白样坏死(图8-15)或局限性新月体形成(图8-16)及毛细血管腔内微血栓形成。随着病变的进展,病变的血管壁出现内膜增厚,伴成纤维细胞、肌细胞增生和泡沫细胞浸润,后者因单核细胞吞噬由血小板裂解释放的类脂质而形成。严重者,可因排异反应的反复发作,致肾血管腔严重狭窄,甚至闭塞;或可因病变反复出现而使血管壁内弹力层纤维断裂或重叠紊乱。相应的肾皮质或肾单位可因血管损害而致肾缺血,进而引起肾小管萎缩、肾间质纤维化,致肾实质形成新旧不一的纤维瘢痕灶。
▲图8-13 急性排异反应(血管型)(HE ×400)
肾细动脉壁纤维蛋白样坏死,伴管壁和管腔内炎症细胞浸润
▲图8-14 急性排异反应(血管型)(HE ×200)
肾小动脉壁纤维蛋白样坏死,肿胀的内膜内有炎症细胞浸润
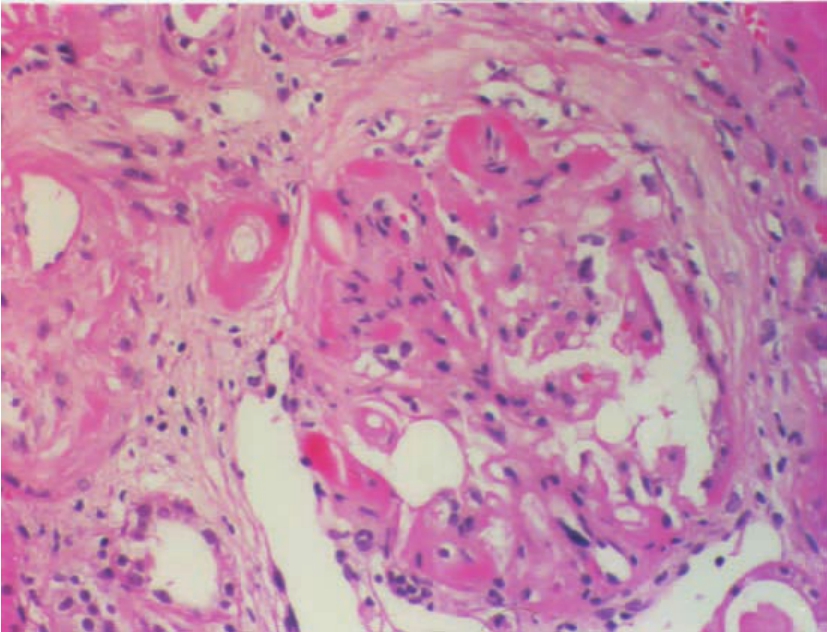
▲图8-15 急性排异反应(血管型)(HE ×400)
肾细动脉及肾小球部分血管襻纤维蛋白样坏死
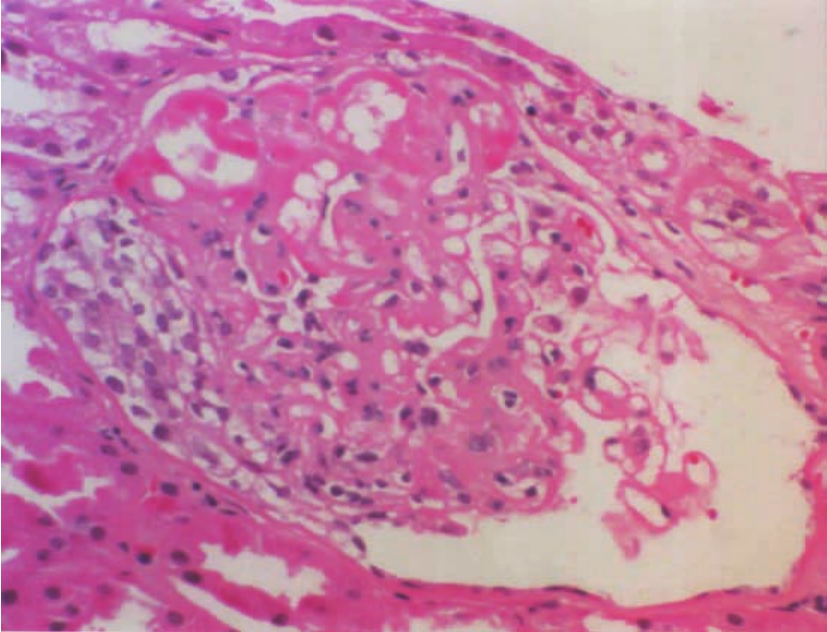
▲图8-16 急性排异反应(血管型)(HE ×200)
肾小球部分血管襻纤维蛋白样坏死,伴小新月体形成
免疫荧光检查显示,常可显示细动脉、小动脉壁及肾小球、肾小管周围毛细血管壁有免疫球蛋白(IgG、IgM)、补体(C1q、C3)和纤维蛋白沉积。
电镜检查显示,血小板可聚集于肾小球和肾小管周围的毛细血管壁,伴纤维蛋白、中性粒细胞聚集及微血栓形成,血管内皮细胞脱落伴肌细胞坏死。
【鉴别诊断】
须与其鉴别的肾病变,包括:①环孢素肾毒性。其肾毒性病变见前述,缺乏因肾血管病变所致的肾间质出血、肾小球血管腔内血栓形成和血管内膜炎或纤维蛋白样坏死等病变。②重度高血压。尽管其血管病变与本型排异反应有相似之处,但其临床表现却截然不同。③复发性微血管病性溶血性贫血(如溶血尿毒综合征、血栓性血小板减少性紫癜)。其病变可有相似之处,但受者提供疾病的既往史,即可有助于鉴别。
【预后】
急性抗体介导排异反应是一种由抗体引起的体液免疫性损害,常是移植肾发生不可逆性病理改变及功能丧失的主要原因。因此,对发生此种严重血管病变的移植肾,临床上常不再予以保留而施行切除术。
三、慢性排异反应
慢性排异反应(chronic rejection)常出现在肾移植术后3个月以上,乃至数月、数年以上的病例,常是临床上难以控制的急性排异反应反复发作的结果。慢性排异反应的起病一般与急性排异反应不同,常呈隐匿性,其主要临床表现为血浆肌酐水平缓慢地升高,伴有蛋白尿、高血压和肾功能的进行性丧失。但在部分病例中,也可出现肾病综合征的一系列临床表现。
【发生机制】
慢性排异反应是以T细胞介导的细胞免疫性损害和抗供者同种异体抗原(即HLAⅠ、HLAⅡ类抗原)抗体参与的体液免疫性损害共同作用的结果。当受者接受了移植肾后,移植体中的Ⅰ、Ⅱ类抗原可刺激机体产生抗供者的抗体,再经过补体依赖性细胞介导的细胞毒反应,或抗体依赖性细胞介导的细胞毒反应损伤移植肾组织,血管是其最初的作用靶子,常表现为血管炎,即排异反应性血管炎的改变。因此,慢性排异反应常发生以血管损害为其最突出表现的肾组织病变。
【病理改变】
正如前述,慢性排异反应的组织病理改变,主要以血管损害最为突出而具有特征性。现以其肾血管、小管-间质和肾小球病变为序,分述如下。
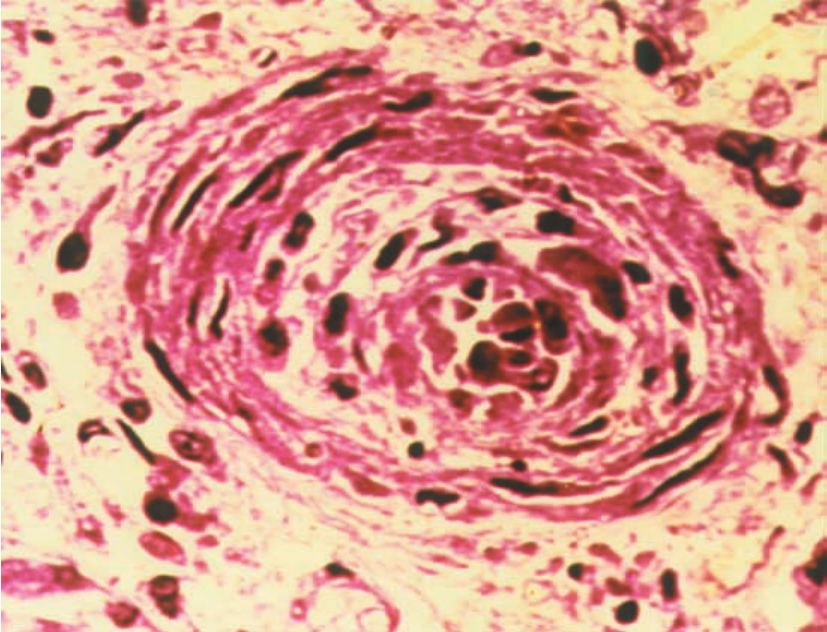
(1)肾血管病变以闭塞性内膜纤维化为其特征性改变,尤多见于肾动脉主要分支,即弓形动脉或小叶间动脉,一般不发生于入、出球微动脉。血管内膜以呈同心圆状纤维组织增厚,伴呈梭形的平滑肌细胞增生为主要改变(图8-17),可伴有不同程度的单个核细胞浸润,有时可出现大量的炎细胞浸润,或伴有吞噬脂质的巨噬细胞(即泡沫细胞)浸润(图8-18)和肌纤维增生,或血管内弹层纤维呈双层或多层改变(图8-19)。对这样的血管病变,有作者称其为慢性同种移植体动脉病(chronic allograft arteriolopathy)。
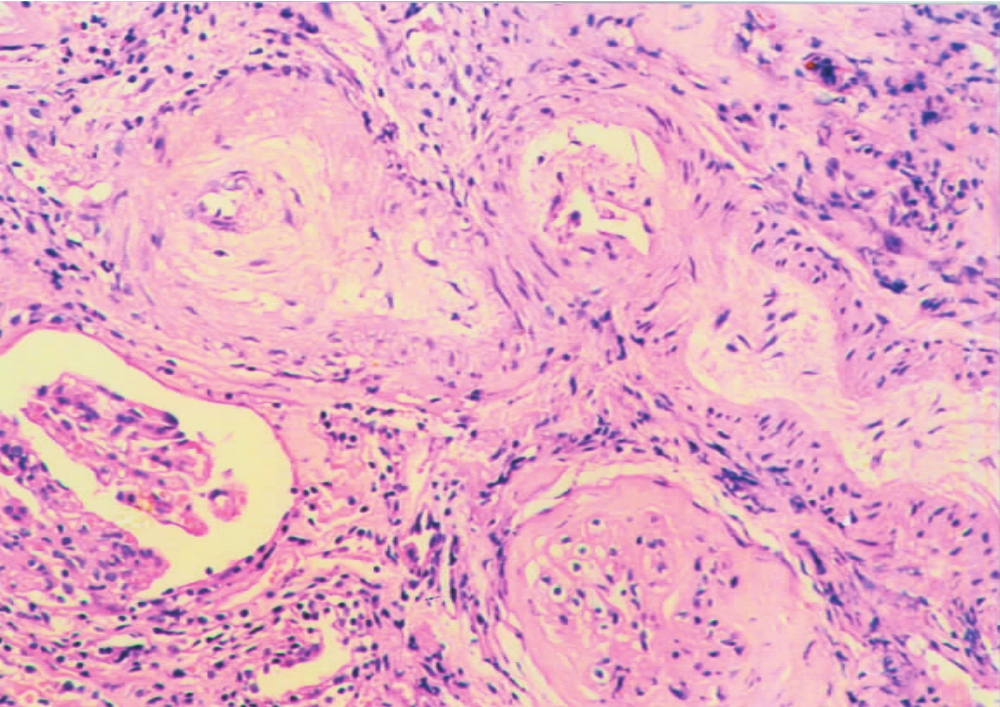
▲图8-17 慢性排异反应(HE ×100)
肾小动脉内膜增厚伴纤维化,管腔高度狭窄,伴肾小球硬化及肾间质纤维化
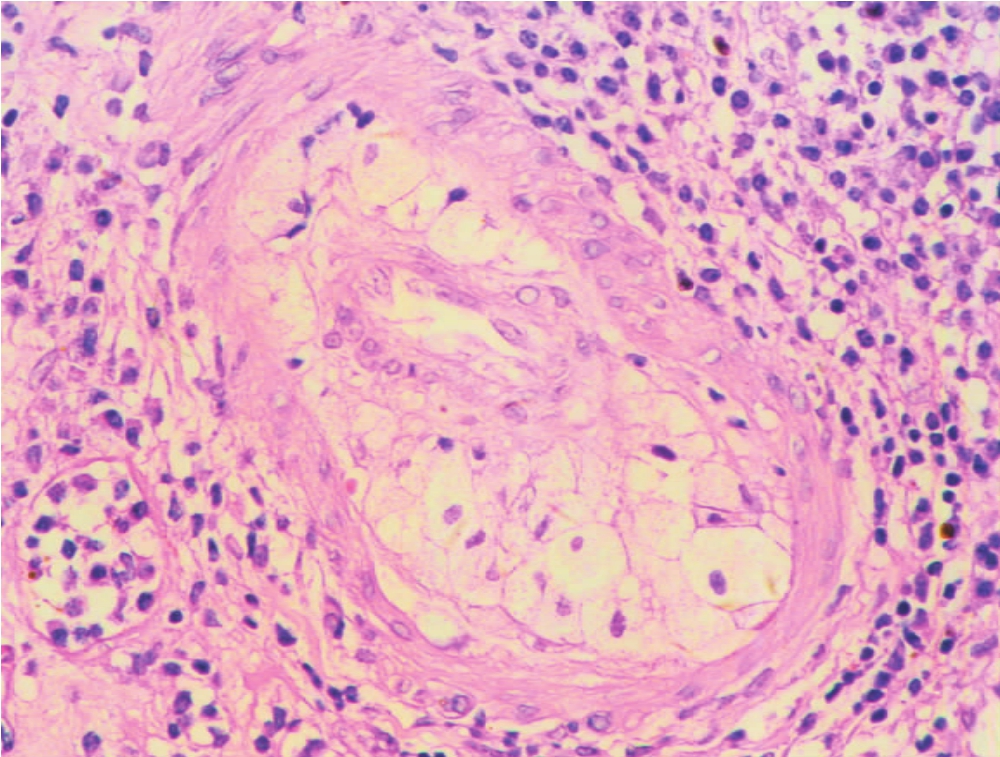
▲图8-18 慢性排异反应(HE ×200)
肾小动脉内膜增厚,伴成堆泡沫细胞浸润
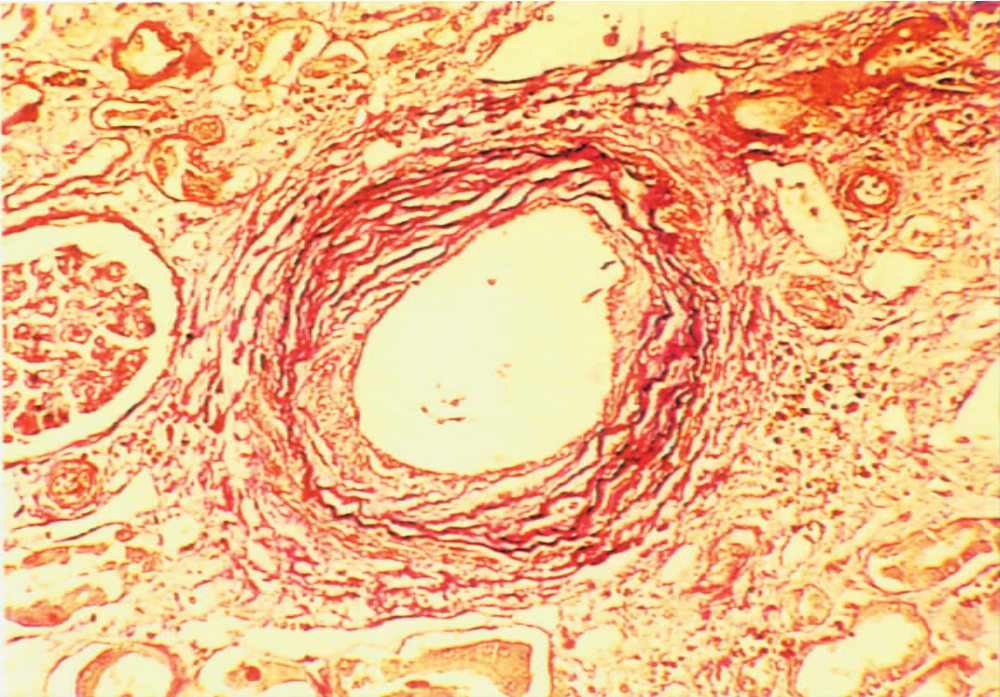
▲图8-19 慢性排异反应(Weigert×200)
肾小动脉内膜弹性纤维(呈棕褐色)增生,呈重叠多层状
(2)肾小管-间质病变呈斑片状分布的纤维化是慢性排异反应最突出的改变,病变常从肾皮质开始,并渐扩展至肾髓质,伴有肾小管灶性萎缩、基膜增厚,肾间质呈散在分布的单个核细胞(淋巴细胞、浆细胞和肥大细胞等)浸润。有时还可叠加急性排异反应的一些改变,如间质水肿、肾小管坏死和炎症(小管炎)(图8-20),或急性排异反应的血管改变(动脉内膜炎)。
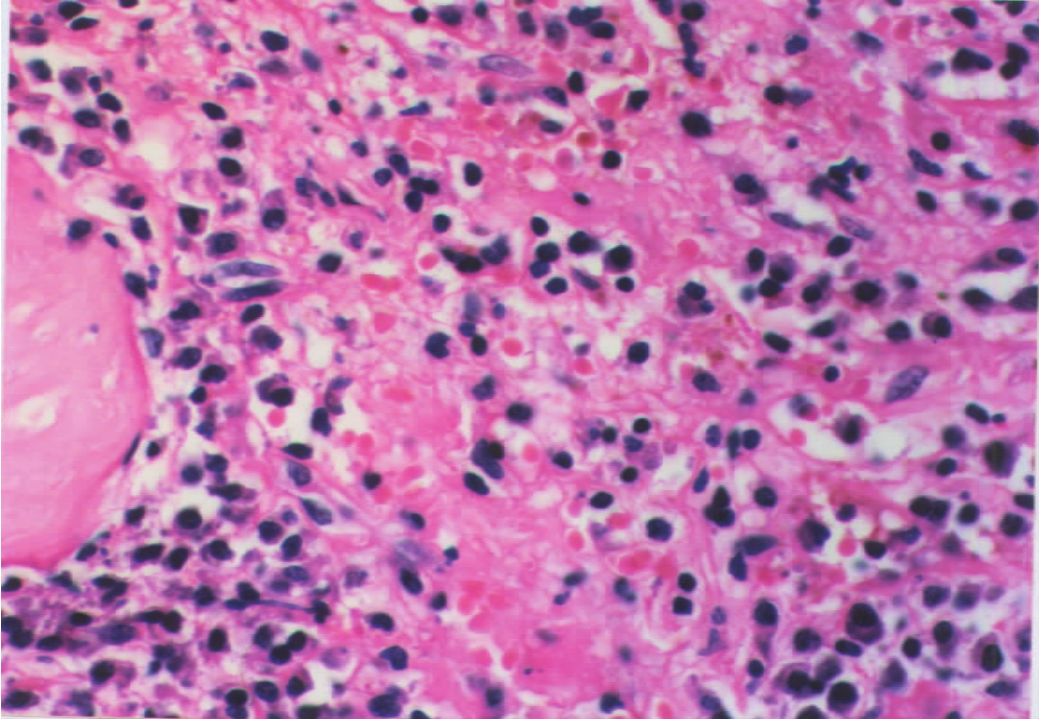
▲图8-20 慢性排异反应(HE ×100)
肾小管及肾间质内有大量淋巴细胞、浆细胞浸润
(3)肾小球病变病变可表现多样化。轻者在镜下可无明显改变,但在电镜检查时,可显示肾球囊足细胞肥大、空泡变和足突融合等;较重者可示轻度系膜基质增多和肾小球毛细血管壁增厚(图8-21),经PAS或PASM染色显示,GBM可呈节段性或球性的双轨状改变,有时也可形成新月体,伴不同程度的肾小球血管襻节段性硬化或瘢痕形成,且与球囊壁粘连,尤多见于血管襻顶端与肾小管起始部(称为肾小球顶端病变);当其GBM呈现弥漫球性分布双轨状改变,或伴有中度系膜区扩大时,则被称为慢性同种移植体肾小球病(chronic allograft glomerulopathy),或慢性移植体肾小球病(chronic transplant glomerulopathy),最终导致肾小球萎陷和硬化(图8-22)。
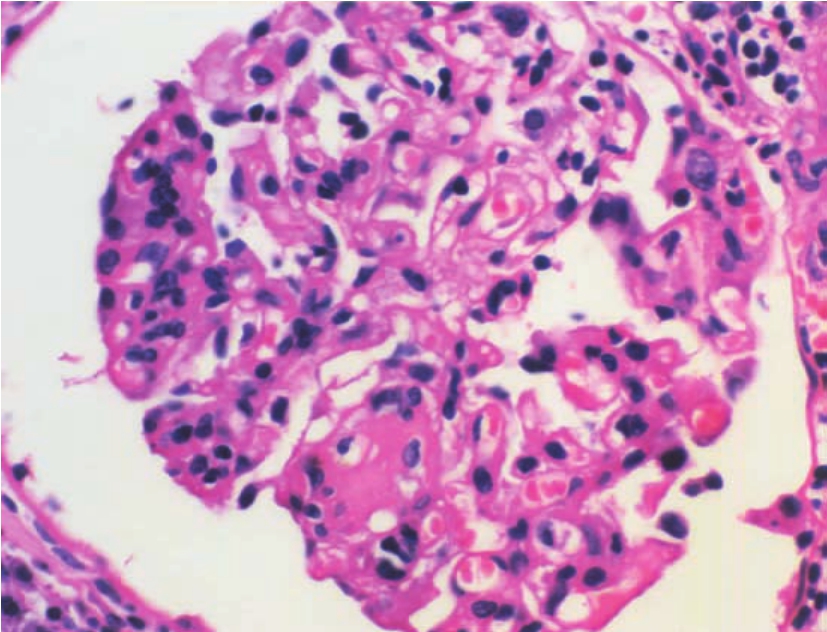
▲图8-21 慢性排异反应(HE ×400)
肾小球血管壁不规则增厚,伴节段性系膜细胞增生及基质增多
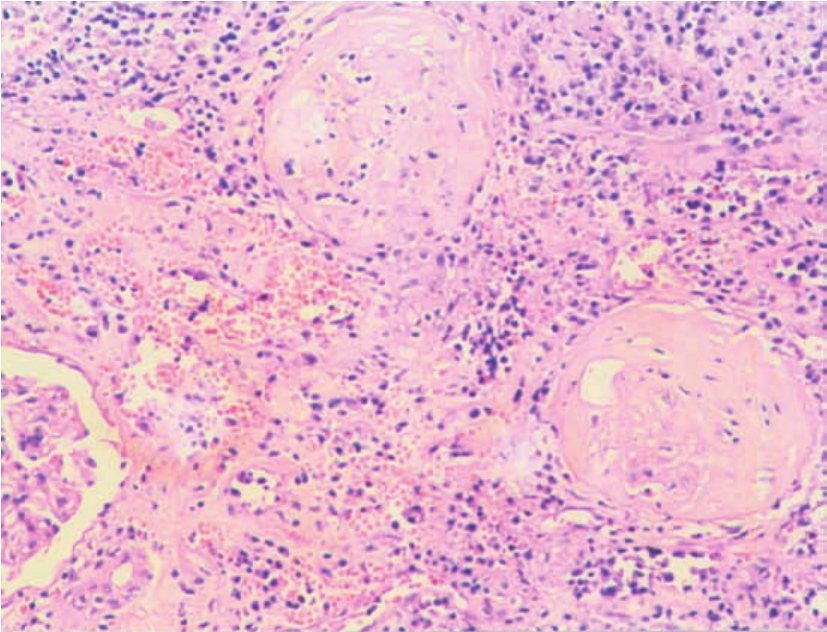
▲图8-22 慢性排异反应(HE ×100)
肾小球已发生硬化,肾小管萎缩、消失,间质内大量淋巴细胞浸润伴纤维化
免疫荧光检查显示,肾血管和肾小球内可有IgM、补体(C3、C1q)和纤维蛋白沉积,偶有IgG沉积呈颗粒或线状。肾间质偶有抗TBM抗体。
电镜检查显示,肾血管壁肌内膜细胞或平滑肌细胞增生,可伴有无定形电子透明物或细颗粒电子致密物沉积及微细胶原纤维增多。肾小球基膜内皮下层增宽,内含血浆沉淀物(图8-23)、细颗粒电子致密物或细碎片、细纤维状物,可伴有系膜溶解、系膜插入(图8-24)及在内皮下、上皮下和系膜区少量电子致密物的沉积。
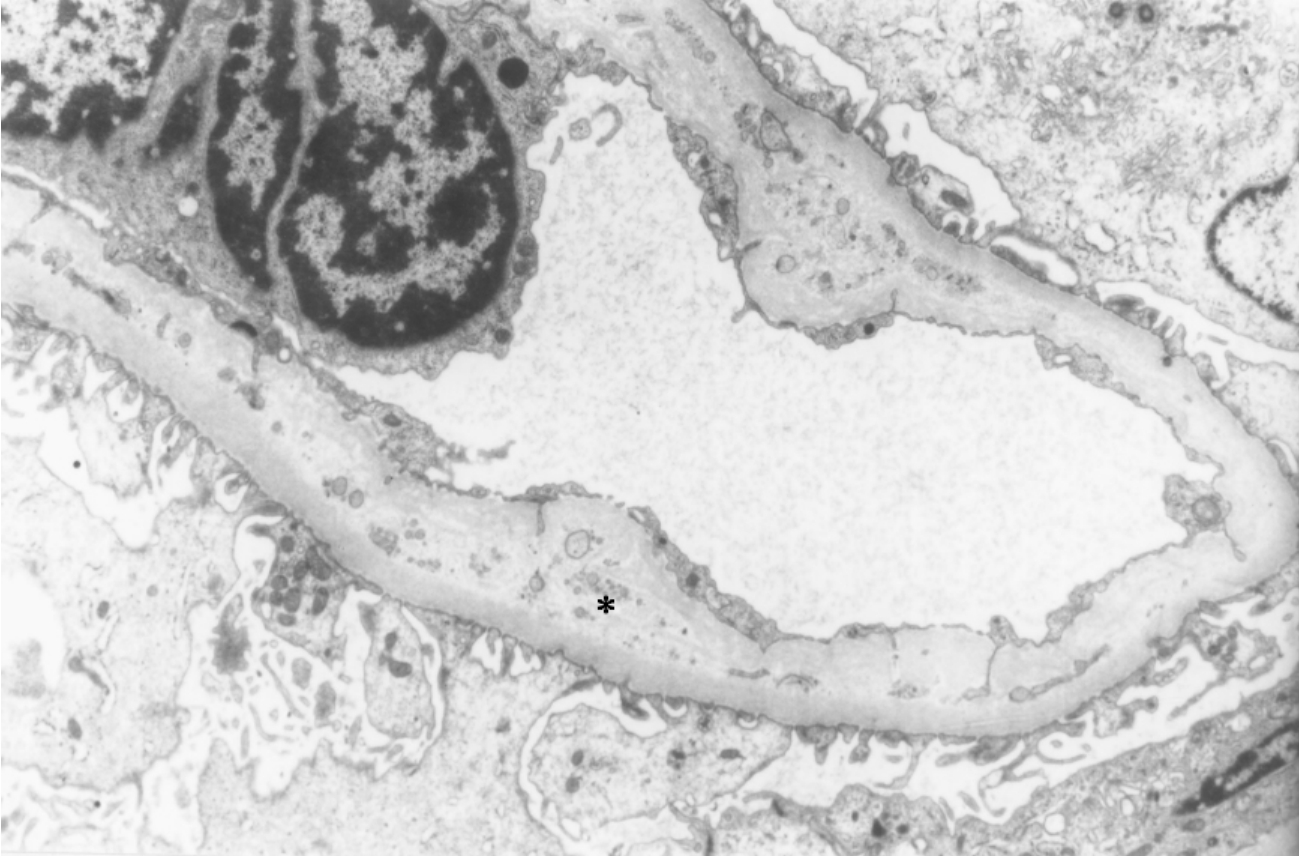
▲图8-23 慢性排异反应(EM ×4 500)
肾小球内皮下区增宽,呈电子透明带(*),内含少量空泡、粗颗粒状物
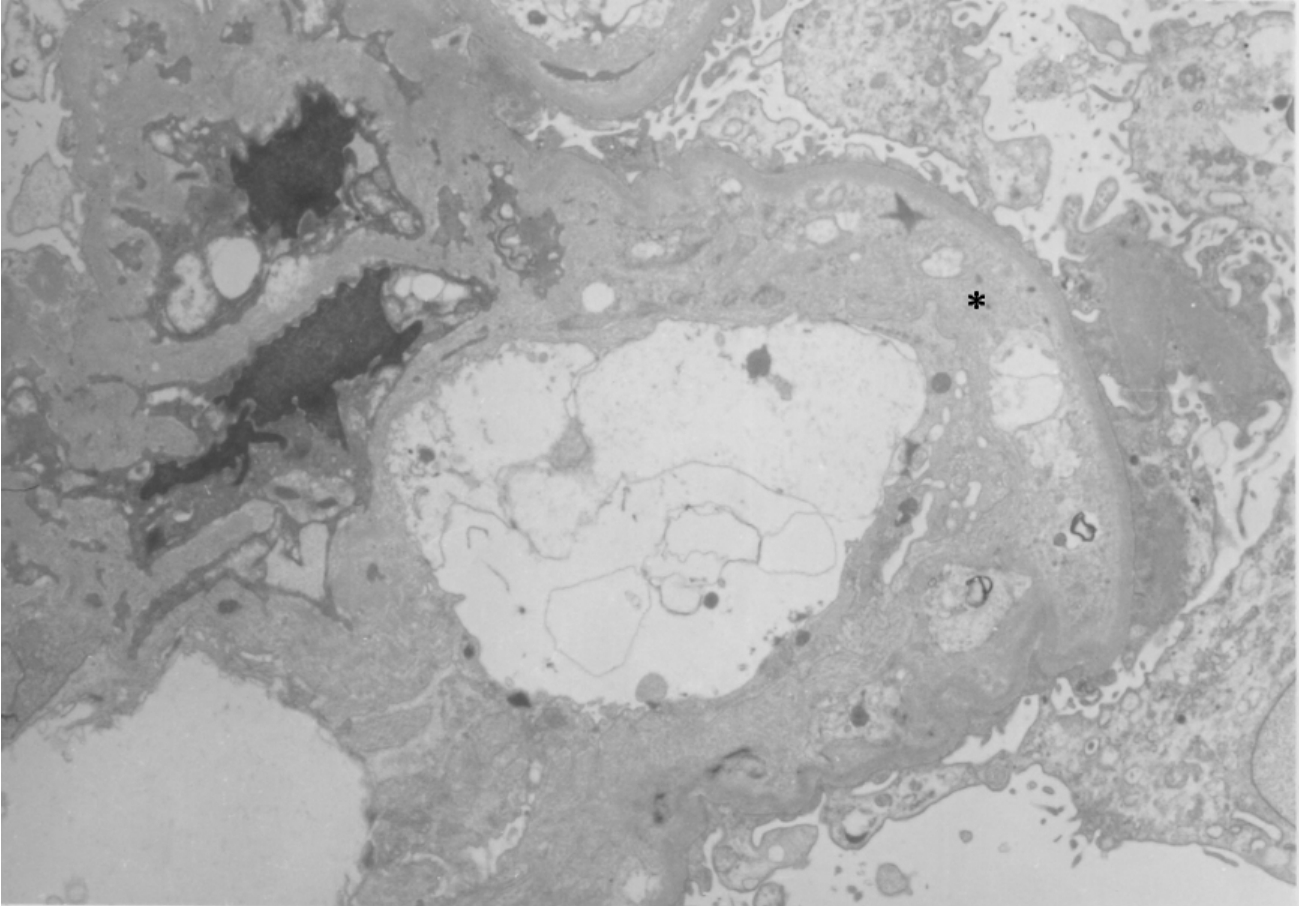
▲图8-24 慢性排异反应(EM ×3 750)
肾小球内皮下区(*)高度增宽,伴有系膜插入和微细胶原纤维沉积
【鉴别诊断】
须与慢性排异反应肾血管病变作鉴别的肾病有多种,如高血压病、动脉粥样硬化症、复发性溶血尿毒综合征和复发性系统性硬化症。然而,因这些疾病不累及肾动脉及其主干(如高血压病)、不造成内弹力层断裂(如动脉粥样硬化症)及患者提供原发疾病史(如溶血尿毒综合征、系统性硬化症)而可资鉴别。需与慢性排异反应小管间质病变的肾病鉴别的有环孢素肾毒性、镇痛药肾病、肾动脉缩窄和反流性肾病,经过适当的检查,其鉴别并不困难。需与慢性排异反应肾小球病变作鉴别的肾小球病,有复发或新发性MPGN(Ⅰ型)、复发性溶血尿毒综合征、缺血性肾损伤,然而,经对肾组织的免疫荧光、电镜检查和询问有关原发疾病史,均可加以区别。
【预后】
应用免疫抑制药物,对其也难以取得良好的疗效。因此,慢性排异反应依然是当前导致肾移植失败最主要的原因。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














