第一节 IgA肾病(包括紫癜性肾炎)
IgA肾病(IgA nephropathy,IgA N),又称IgA肾炎(IgA nephritis),于1968年首先由Berger报道,故又称Berger病(Berger disease)。顾名思义,IgA N是因其突出的IgA在肾小球系膜区的沉积而得名,故也有学者称其为系膜IgA肾病(mesangial IgA nephropathy)。目前多数学者认为,IgA N是过敏性紫癜的局限性类型或是紫癜性肾炎的姐妹病,因两者在其发病机制及病理形态特征方面均有许多相似之处,故本节将其两者并在一起叙述。据国外一些作者对肾活检病例的统计,IgA N除在北美、英国、非洲人群中较为少见外,在世界的许多地区和国家,如法国、德国、西班牙、澳大利亚、新加坡、韩国和日本等,均证实IgA N是肾活检病例中最常见的一种肾小球病。目前,IgA N可分为特发性和继发性两类:特发性患者病因不明,占绝大多数;继发性患者则是全身性疾病,如过敏性紫癜、系统性红斑狼疮、慢性酒精性肝病、炎症性肠道病、疱疹性皮炎、肠腺癌、IgA单克隆γ病和强直性脊柱炎等一部分。
【病因和发病机制】
特发性IgA N的病因和发病机制均不明,但在约50%的患者血清中,可发现多聚体性IgA(可分为IgA1、IgA2两种亚型)和循环的IgA1致肾炎性免疫复合物水平的升高,并有家族性倾向(部分为家族性IgA N、单核-巨噬细胞系统缺陷者),且与HLA位点和补体表型有关。近年一些研究还表明,因IgA糖基化异常而减少其清除率,也可能是其发病机制之一。由此表明,因遗传性状或获得性免疫调节机制的异常,促使患者呼吸道、胃肠道和泌尿道对环境因子(如病毒、细菌、食物蛋白等)反应的增强,增加了黏膜分泌型(多为双聚或多聚体)IgA,尤其是IgA1及其复合物的生成,并随血循环进入肾小球系膜区,继而激活补体旁路及其他炎症介质而诱发肾小球炎症。
【类型】
(1)特发性IgA N(idiopathic IgA N)可发生于任何年龄患者,自4~80岁,但以儿童及青壮年为多见,其平均发病年龄为33岁,以男性居多(男女之比为3∶1)。在大多数病例中,以发作性肉眼血尿、无症状性蛋白尿和镜下血尿为表现,少数病例(约10%)也可出现重度蛋白尿,乃至肾病综合征。在部分成年人病例(分别约1/3或1/4病例)中,可伴有高血压或慢性肾衰竭的表现。一些表现为肉眼血尿的患者,其血浆常有IgA水平升高和IgA型循环免疫复合物形成,部分患者还可检测到IgA型风湿样因子(RF)。特发性IgA N的病程多呈缓慢进行性,约半数病例经20年后可出现肾功能减退。
(2)紫癜性肾炎(Henoch-Sch9lein nephritis,HSN)常发生于2~11岁儿童,约半数以上病例不超过16岁,成人者少见。据国外一组1 599例病例的统计,成人者仅为100例(占0.06%)。HSN是过敏性紫癜(Henoch-Sch9lein purpura)或其综合征(Henoch-Sch9lein syndrome)的一部分,与其构成综合征的其他表现有皮肤紫癜、关节痛和以腹痛为主要症状的肠道功能紊乱,其潜在性病变为破白细胞性血管炎(leukocytoclastic angitis)。HSN以蛋白尿或伴有血尿为主要表现,多数患者的预后良好,仅小部分(<15%)可进展到终末期肾衰竭。
【病理改变】
IgA N(HSN)主要的组织病理学改变是肾小球系膜细胞增生(图3-1)、系膜旁透明结节形成(图3-2)或基质增多,其改变可发生在约3/4病例之中,但其程度在各病例或同一病例的不同肾小球中却有很大差异。轻者肾小球形态结构大致正常,或仅在系膜区或系膜旁区显示嗜伊红色物沉积(图3-3),称其为轻微病变型(minor lesion或minor abnormality),如经Masson染色,可显示其系膜区有呈红色的免疫沉积物(图3-4),此型较少见;最常见者是部分肾小球呈局灶节段性系膜细胞增生伴系膜基质增多(图3-5),而另一部分肾小球的形态结构可大致正常或仅显示轻微病变,这些病变的肾小球还可伴有节段性病变,尤以节段性硬化和透明变性为多见,但也可发生节段性坏死(图3-6)、炎细胞浸润、内皮细胞增生和为数不多的新月体(小新月体为主)形成(图3-7),其中节段性坏死、核碎屑、新月体形成在HSN中较为多见,称其为局灶节段增生型(focal segmental proliferative type);次常见者是绝大多数(≥80%)肾小球,呈弥漫球性分布的系膜细胞增生伴系膜基质增多,同时也可伴有部分肾小球的节段性硬化和透明变性的病灶(图3-8),也可伴有新月体形成,但后者的肾小球数一般不超过总数的30%,可称其为弥漫系膜增生型(diffuse mesangioproliferative type)或系膜增生型(mesangial proliferative type)。如在上述局灶节段增生型和弥漫系膜增生型中,伴有节段性硬化或球性硬化的肾小球数较多(一般不超过肾小球总数的40%),同时还伴有肾小管-间质损害严重者,在我们实际工作中,将其分别称为局灶节段增生伴硬化型或弥漫系膜增生伴硬化型。前者在组织形态上与局灶性节段性肾硬化(FSGS)相似,甚难区别,但其免疫荧光检查结果截然不同。而当出现节段性硬化或球性硬化的肾小球数分别达到或超过肾小球总数之50%或75%,肾小管-间质损害严重时,则分别称其为早期硬化型或硬化型,此型也较少见。

▲图3-1 IgA肾病(系膜增生型)(HE ×200)
肾小球血管襻系膜细胞增生,伴基质增多
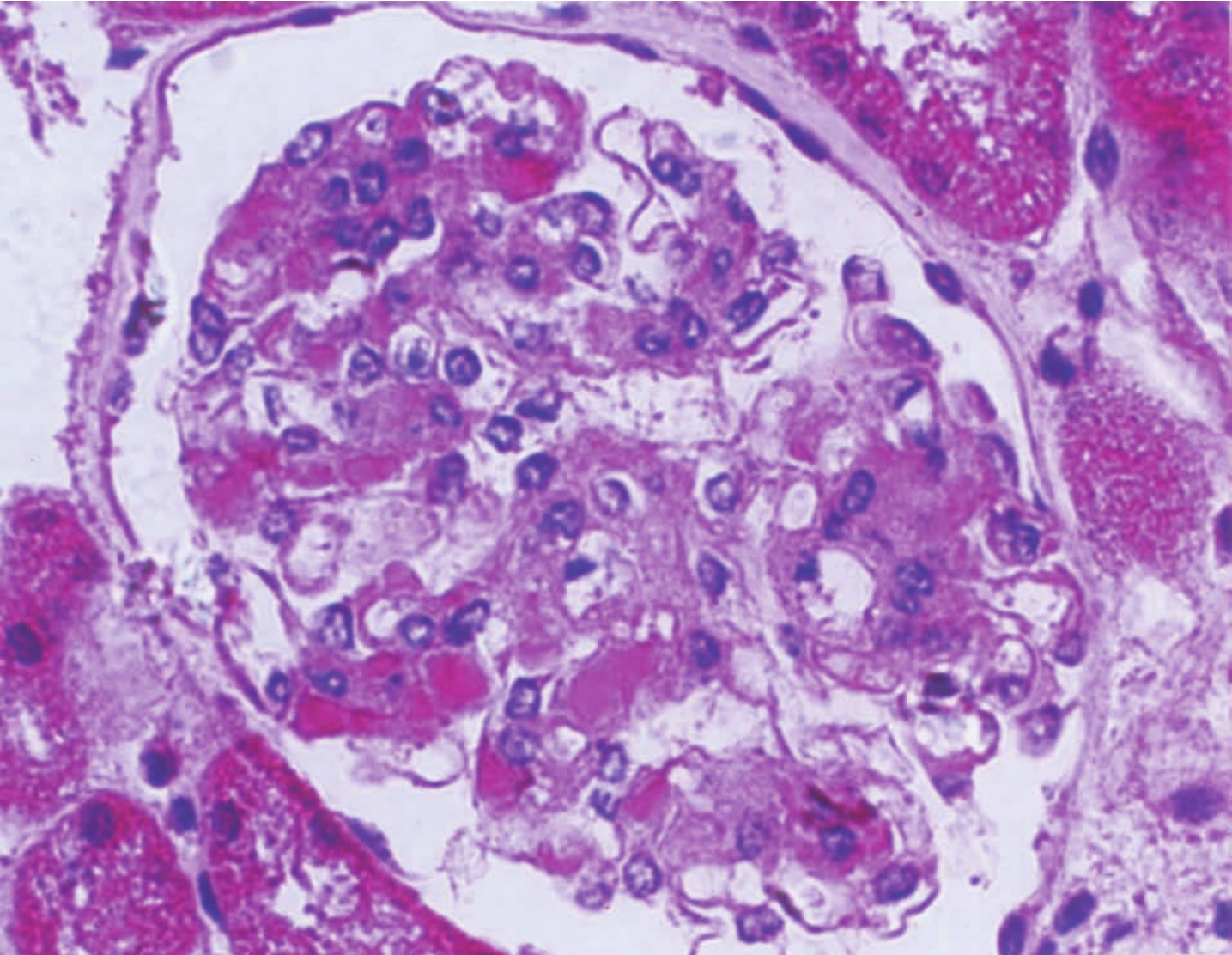
▲图3-2 IgA肾病(HE ×400)
小球多个系膜区有呈嗜伊红性透明样物沉积,伴少数系膜区轻度系膜细胞增生

▲图3-3 IgA肾病(轻微病变型)(HE ×400)
肾小球多个系膜区有呈嗜伊红性物沉积,未见细胞数增多

▲图3-4 IgA肾病(Masson ×400)
肾小球多个系膜区有染成红色的沉积物

▲图3-5 IgA肾病(HE ×200)
肾小球血管襻部分节段系膜细胞轻度增生

▲图3-6 IgA肾病(HE ×400)
肾小球部分血管襻纤维蛋白样坏死,呈无结构嗜伊红性颗粒状或条索状物
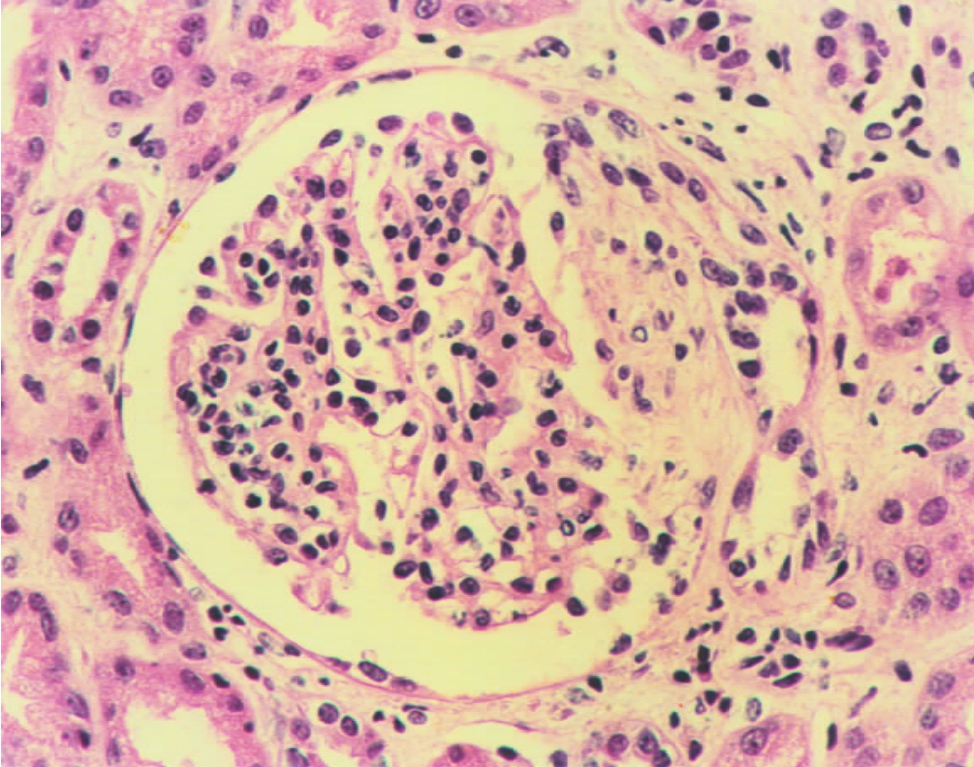
▲图3-7 紫癜性肾炎(HE ×200)
肾小球系膜细胞呈球性增生伴基质增多,肾球囊内有小纤维性新月体形成

▲图3-8 IgA肾病(HE ×200)
两肾小球中的一肾小球形成节段性硬化病灶,另一肾小球系膜区扩大伴系膜细胞增生
我组对3 491例IgA N和241例HSN病例,均按修改的Haas(1997年)的5型分类法,即轻微病变(Ⅰ型)、局灶节段硬化(Ⅱ型)、局灶节段增生(Ⅲ型)、弥漫增生(Ⅳ型)和硬化型(Ⅴ型)进行组织病理学分类。除本组有120例IgA N和22例HSN的肾组织切片,因不含或所含肾小球太少而无法对其进行分类外,3 371例IgA N和219例HSN病例的组织病理学分类参见表3-2。而真正属于该分类法列出的弥漫增生型中的新月体型、毛细血管内增生型和膜性增生型者在我国并不多见,仅有7例IgA N,最后分别被列入为膜性增生型(3例)、新月体型(2例)和毛细血管内增生型(2例)。
表3-2 我组3 371例IgA肾病和219例HSN的组织病理学分类及其发生率

肾小管-间质的损害,包括肾小管萎缩、间质灶性纤维化及单个核细胞浸润等,其程度一般也随着组织病理学类型的演变,即自轻微病变型、局灶节段增生型、弥漫系膜增生型、局灶节段增生伴硬化和系膜增生伴硬化型,直至早期硬化和硬化型而愈加明显或加重。肾微动脉透明变性(图3-9)也较常见,偶然也可见肾细动脉、小动脉壁纤维蛋白样坏死伴炎症细胞浸润,尤以HSN病例为多见。随着病情的加重或病变的进展,肾小动脉内膜纤维化伴管腔狭窄也常被发现。

▲图3-9 IgA肾病(HE ×400)
肾小球微动脉壁呈均质嗜伊红透明变性
免疫荧光检查显示突出的IgA在肾小球系膜区或邻近的毛细血管襻沉积,呈细或粗颗粒状,也常聚集成团块、星芒状或分支状(图3-10,3-11),常伴有C3沉积。部分病例也可伴有少量的IgG、IgM沉积,尤以青少年患者多见,极少数病例也可伴有C1q的沉积。

▲图3-10 IgA肾病(IF ×200)
肾小球系膜区IgA大量沉积,呈不规则颗粒、团块状或分支状排列

▲图3-11 紫癜性肾炎(IF ×200)
肾小球系膜区IgA大量沉积,颗粒状沉积物排列成不规则团块或条索状
电镜检查显示,其最主要的改变是呈扩大的肾小球系膜区内有数量不等的电子致密物沉积(图3-12)。当其呈少量沉积时,常分布于系膜细胞与基膜之间,有时须在高倍电镜下仔细寻找才能发现;当其呈多量或大量沉积时,极易在低倍电镜下发现,其沉积部位不仅出现于系膜细胞与基膜间,也可出现系膜旁和系膜基质内,有时聚集成结节状或半球形向肾球囊腔突出(图3-13),或延伸至毛细血管内皮下(图3-14),偶然可伴有少量上皮下沉积。多数病例的系膜区有系膜细胞增生(图3-15)和基质增多。在部分病例中,还可发现GBM变薄(其厚度<200 nm)、管腔内有纤维蛋白丝(图3-16),后者尤多见于HSN病例。发生透明变性的微动脉壁有微细电子致密物沉积(图3-17),严重者致管腔阻塞(图3-18)。随着病变的进展,在出现节段性和球性硬化的肾小球内,可有大量胶原纤维的积聚。

▲图3-12 紫癜性肾炎(EM×9 000)
肾小球系膜区有聚集成堆的电子致密物(D)
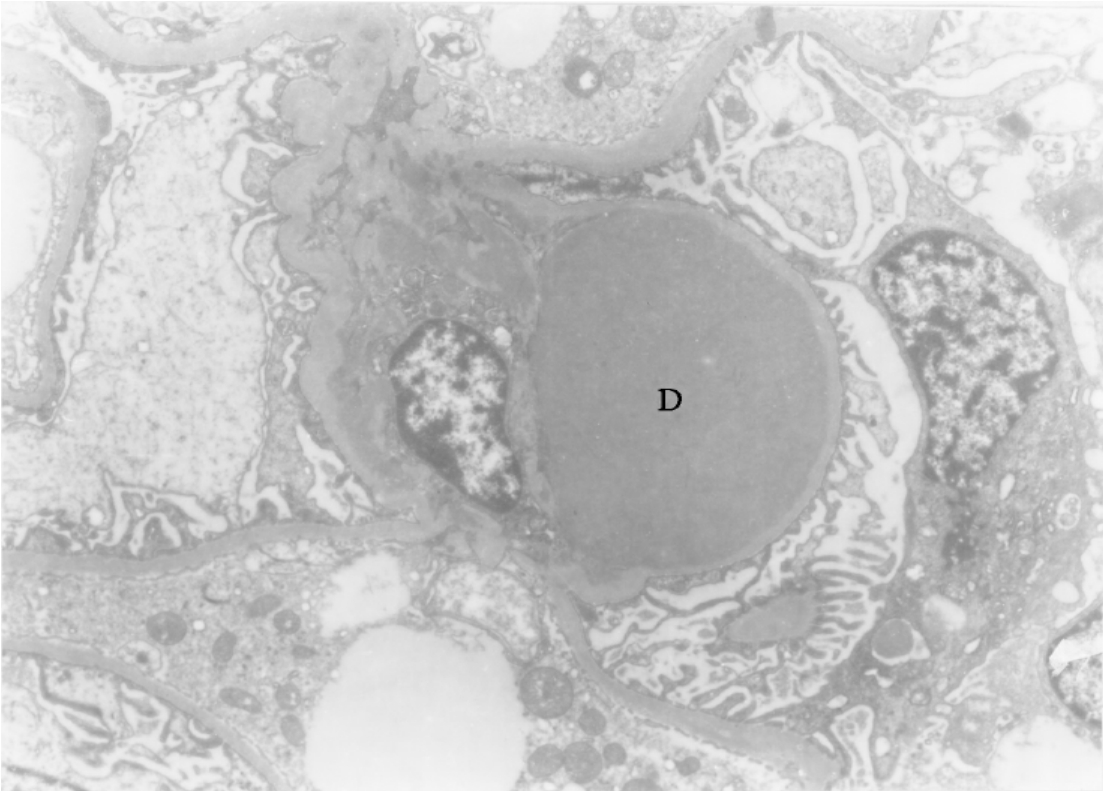
▲图3-13 IgA肾病(EM ×7 500)
肾小球系膜区的电子致密物(D)呈半球形样向球囊腔突出

▲图3-14 IgA肾病(EM ×4 500)
肾小球系膜区有散在分布的电子致密物,伴有内皮下沉积(↑)
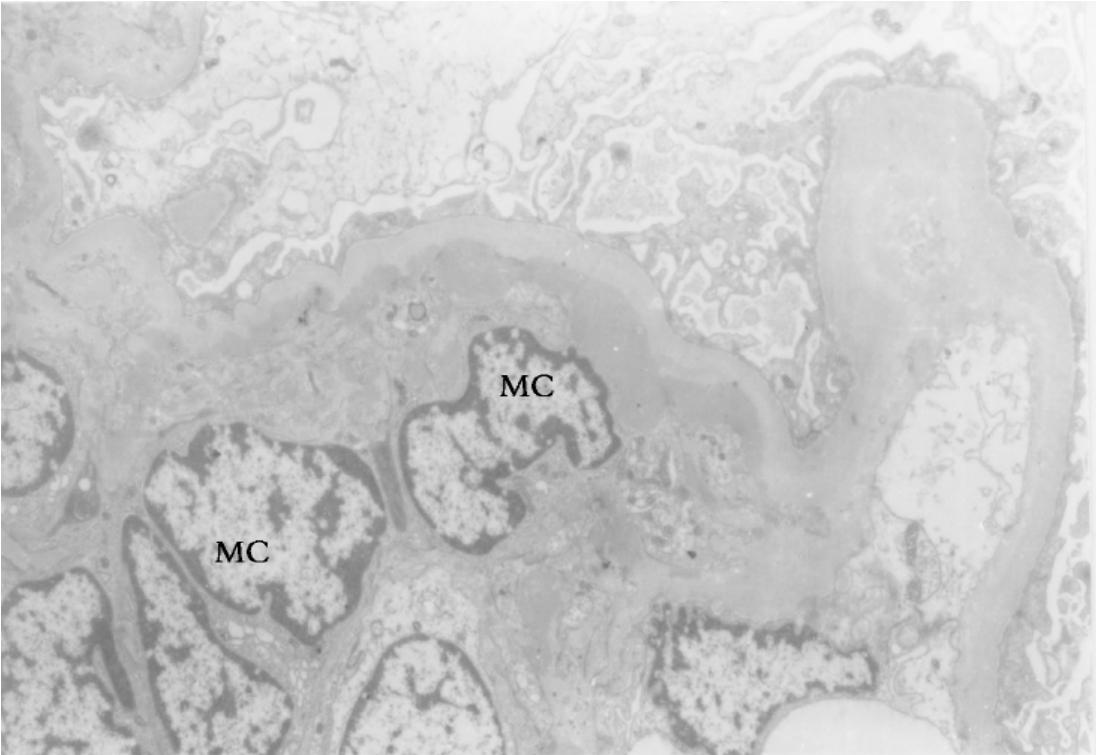
▲图3-15 紫癜性肾炎(EM ×4 500)
肾小球系膜细胞(MC)中度增生,其边缘有电子致密物沉积

▲图3-16 紫癜性肾炎(EM ×9 000)
肾小球毛细血管腔内有纤维蛋白丝状物(Fb)
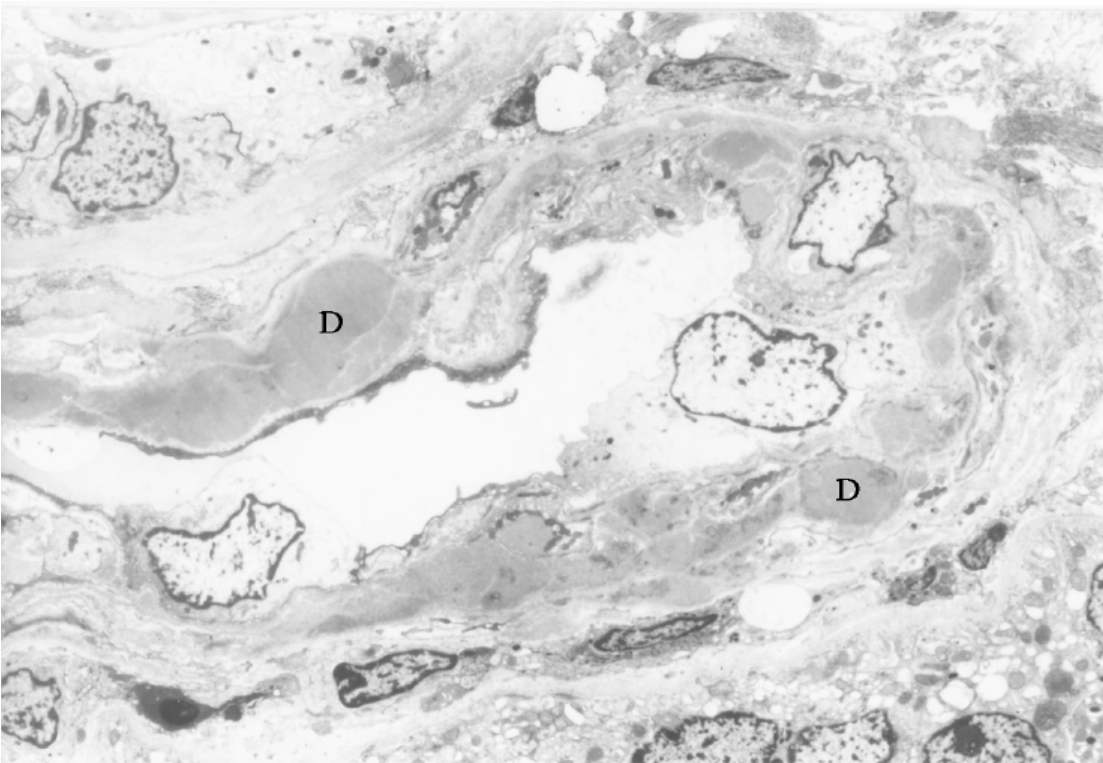
▲图3-17 IgA肾病(EM ×2 250)
肾微动脉壁有多处微细电子致密物(D)沉积

▲图3-18 IgA肾病(EM ×2 250)
肾微动脉壁管腔高度狭窄,管壁充满电子致密物(D)沉积
【鉴别诊断】
须与IgA N鉴别的肾病首先是HSN,除两者的患者年龄和临床表现明显不同外,HSN的病变肾小球易发生血管襻坏死、炎症细胞碎屑、新月体形成和肾小血管炎,然而这种不同决不是绝对的。须与其鉴别的其他肾小球病,如MCD、系膜增生性肾炎(MsPGN)和FSGS,因这些类型均可出现在IgA N或HSN病例中,但只要经免疫病理检查,因均不显示肾小球系膜区有突出的IgA沉积而将它们区别开来。此外,还须注意与以肾小球系膜区IgA沉积为主的部分狼疮性肾炎病例的鉴别,但其免疫荧光检查常可显示肾小球内有较强荧光的C1q和C4的沉积,尤以前者更具特异性。
【预后】
IgA N是一种呈持续性进展的肾小球病,据国外文献报道,约80%的病例可生存10年以上,约半数病例可生存20年以上,获缓解或消退者较为少见。一般说来,起病年龄大和表现为肾病综合征、持续性血尿、伴有高血压者,其预后欠佳;而在其组织病理学上,当其节段性或球性硬化及新月体形成的肾小球数越多、肾小管-间质损害严重或伴有血管透明变性或内膜纤维化明显者,其预后不佳。然而,HSN病例多可自发缓解,其预后良好,据一组报道,其10年存活率可达90%。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














