第二节 血管夹层的处理
一、冠状动脉夹层的定义
冠状动脉夹层通常是指冠状动脉内膜及其斑块在外力(介入治疗时)的作用下,发生在冠状动脉造影条件下可见的管腔内充盈缺损、管腔外造影剂滞留或内膜片,是导致冠脉血管介入治疗后急性闭塞的主要原因。也有部分患者在造影时就发现冠脉内夹层,往往与自发性斑块破裂相关。有时这类夹层非常复杂,血管内超声有助辨别。
二、冠状动脉夹层的影像学诊断方法及分类
1.冠状动脉造影冠状动脉造影是临床最常用的主要诊断方法,诊断夹层发生率为20%~40%。冠脉造影可明确诊断冠状动脉夹层位置及长度(图7-8)。冠脉造影显示夹层特征性表现如下:
(1)冠状动脉内膜部分剥离成薄的透明线,即瓣片,透视下有动态变化;
(2)透明线两侧分别为真、假腔,均有造影剂充盈,假腔内造影剂排空可延迟;
(3)真腔可有局限性狭窄或增宽,夹层远端可狭窄;
(4)夹层可随管腔走行呈螺旋状,随角度转动可变化。
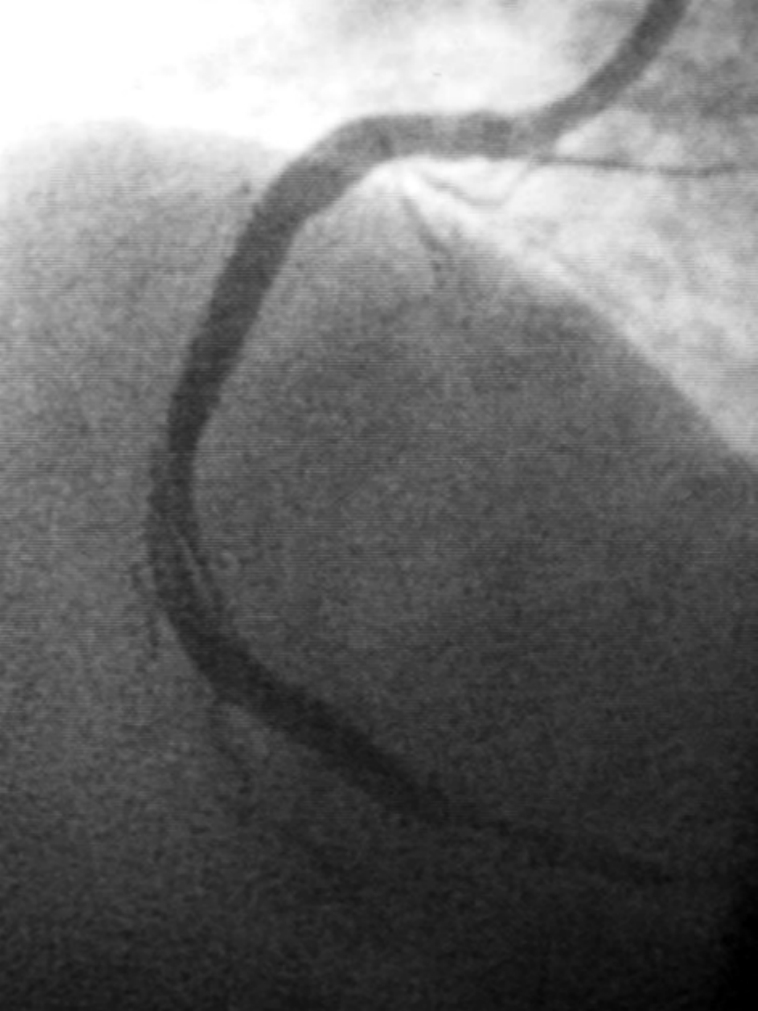
图7-8 冠脉造影显示右冠脉中段球囊扩张后螺旋形夹层
冠状动脉夹层一般以冠脉造影的特征进行分类,但NHLBI的分型法是最常用的(表7-1),这种分型的方法可指导夹层处理或治疗。
表7-1 冠脉夹层NHLBI分型

通常A型、B型夹层不影响治疗结果,称之为微夹层,一般无需处理;C~F型夹层较容易出现缺血并发症,急诊CABG,死亡率高是A型、B型夹层的5~10倍,被称为大夹层。长夹层(≥10mm)和导致≥50%狭窄的夹层即使冠脉血流未受影响,但急性缺血并发症发生率仍较高,应放置支架覆盖夹层。
2.血管内超声(IVUS)IVUS对夹层可做出更明确的诊断,诊断夹层发生率约60%~80%,而且IVUS能清晰地显示冠状动脉夹层的形态改变及判断夹层沿血管纵向和横向撕裂的范围、程度以及有无血栓(图7-9)。IVUS还能分辨冠脉造影不能明确诊断的夹层。根据介入性冠状动脉成形治疗后的血管腔形态变化,在IVUS上将夹层分成四种类型:
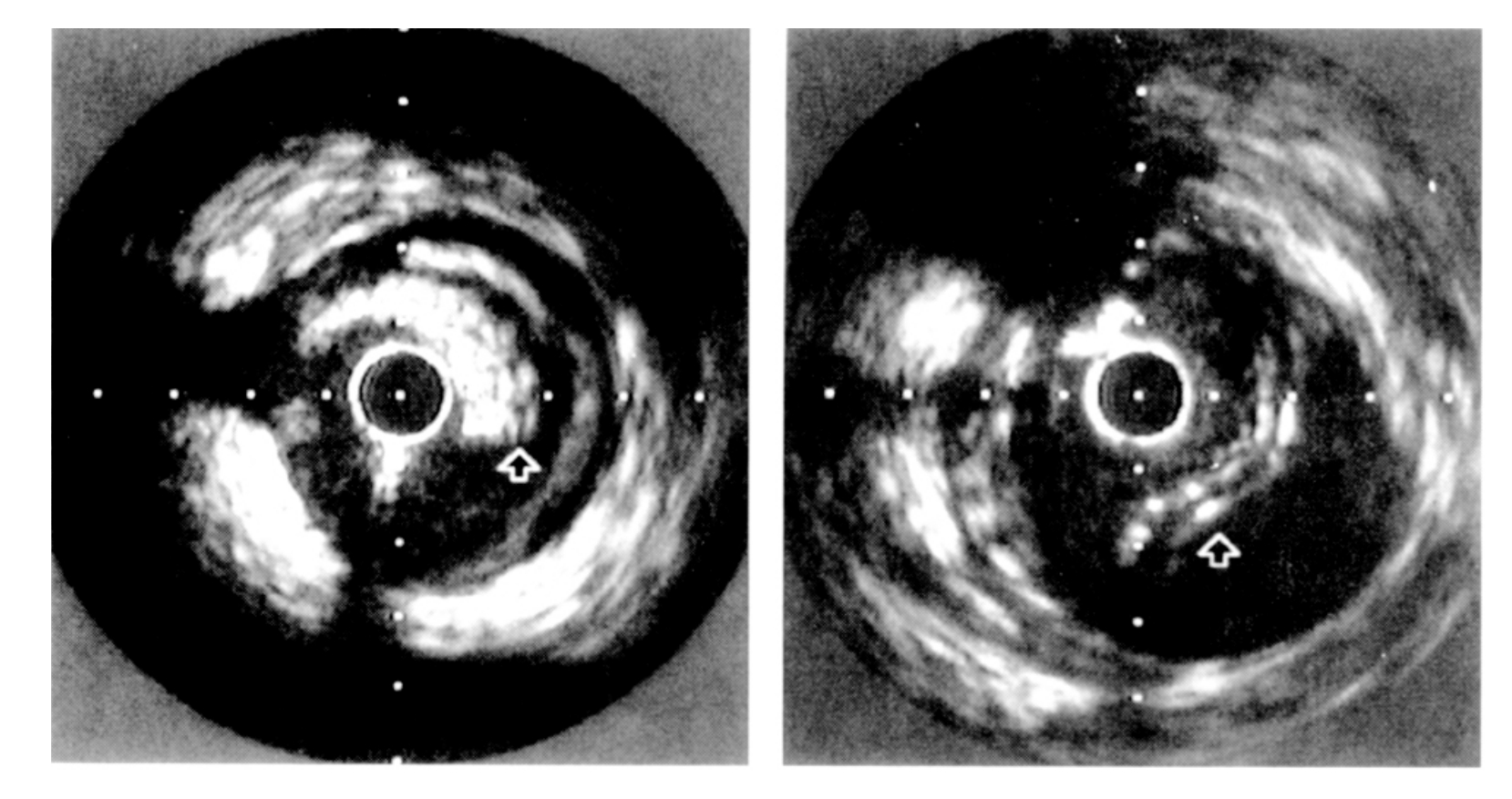
图7-9 血管内超声显示球囊扩张后夹层形成
(1)Ⅰ型夹层(边缘型):该夹层平面位于正常血管段与偏心斑块的交界处,占全部夹层的51%。
(2)Ⅱ型夹层(中心型):发生在同心性或偏心性斑块裂隙的下层,占26%。
(3)Ⅲ型夹层(无通道型):由于重度钙化,夹层入口通道不能被观察到,仅能经注射造影剂后才显示夹层存在,占6%。
(4)Ⅳ型夹层(假腔型):在动脉内腔与夹层之间无交通相连,假腔扩张致真腔受压,斑块下外膜扩张,占17%。
三、冠状动脉夹层发生的相关因素
冠脉夹层的相关因素主要有临床危险因素、病变因素、介入器械因素及操作因素等。
1.临床危险因素包括糖尿病患者、急性冠脉综合征等。
2.冠状动脉病变因素包括小血管病变、钙化病变、偏心病变、长病变或弥漫性病变、复杂病变(如B型、C型病变)、血管迂曲、成角病变等。
3.介入器械因素包括选择球囊与参照血管的直径比>1.2、普通球囊高于切割球囊、支架直径选择过大支架长度过短不能覆盖病变等。
4.操作因素①初学者对介入器械不熟悉及缺乏经验;②指引导管选择和操作不当:Amplatz指引导管引起冠脉开口的损伤;指引导管深插技术引起病变近端夹层;指引导管与冠脉开口不同轴引起冠脉开口的夹层等;③指引导丝选择和操作不当:导丝过硬或鲁莽操作通常引起冠脉夹层;亲水膜导丝容易通过病变,但操作不慎容易引起夹层;慢性闭塞病变时,导丝操作不慎更容易引起夹层;④球囊长时间高压扩张、长病变或弥漫性病变用短扩张、成角和钙化病变用顺应性球囊高压扩张等都增加了夹层的发生率;⑤支架没有覆盖病变引起支架近端或远端的夹层;⑥残余狭窄大于30%。
四、冠状动脉夹层的预后
冠脉夹层的主要危险是冠状动脉急性闭塞和随之而来的临床情况。血管内膜撕裂导致斑块内血栓性物质和血管壁胶原纤维暴露,引起一系列的血小板反应,形成血栓、冠脉痉挛和血管闭塞。在支架广泛应用的时代与早期单纯PTCA不同,冠状动脉夹层一般不至于引起严重后果,但如处理不好同样可引起急性血管闭塞,造成病人的死亡、急性心肌梗死或急诊CABG等严重后果。对于A型、B型夹层一般不影响冠脉血流,引起血管闭塞较少,夹层通常随着时间的延长而愈合,对血管再狭窄也有特别影响。对于严重的夹层,引起急性缺血并发症的发生率是A型、B型夹层的5倍以上,尤其是抗血小板不足的病人、糖尿病病人、急性冠脉综合征的病人、左心功能不全的病人冠脉闭塞的发生率更高,死亡率也随之而增加。因此冠脉的严重夹层或复杂夹层必须进一步处理。
五、冠状动脉夹层的处理策略
1.对冠脉夹层的预后进行分析识别有危险的冠脉夹层:①夹层长度>15mm;②NHLBI分型为C~F型;③残余管腔狭窄>30%;④残余管腔面积<2mm2;⑤管腔外造影剂滞留;⑥导管室内出现一过性闭塞;⑦不稳定型心绞痛;⑧CTO病变。
在药物洗脱支架时代,为了减少对血管壁的损伤,通常应用相对较小的球囊预扩张,使夹层发生率明显降低;另外,支架的应用也使因夹层导致的缺血并发症的风险降低。
2.冠脉夹层的预防策略由于冠状动脉支架的广泛应用,使冠脉夹层导致急性冠脉闭塞的发生率明显降低。因此,处理冠脉夹层的关键在于预防。
(1)对于高危患者及高危病变的患者术前加强抗血小板治疗,如阿司匹林、氯吡格雷;术中规范的肝素抗凝;必要时可使用血小板Ⅱb/Ⅲa受体拮抗剂以降低血栓形成的发生率;术后强化抗血小板治疗。
(2)严格规范介入操作规程,切忌粗暴,特别是在使用一些特殊类型导管时尤显重要。避免将导引导管过深插入冠状动脉内,对一些确需通过深插导管以增加主动脉支撑力的情况,应轻柔操作,当球囊、支架到位后,应迅速轻柔回撤导管,以避免长时间阻塞冠状动脉开口,影响冠脉血流。
(3)应根据不同的血管病变特点来选择相应的手术器械(导引钢丝、球囊、支架)。
(4)忌用较高压力反复扩张病变血管,特别是严重扭曲、钙化的病变血管、偏心病变等。长病变或弥漫性病变用长球囊扩张可减少夹层的发生率。
(5)严重钙化病变行球囊扩张时,夹层发生率高,程度较重,可先用斑块旋磨术后再植入支架,以减少夹层的发生率。
(6)病变相对简单的非严重钙化病变直接支架植入可减少夹层的发生率。
(7)在药物洗脱支架时代支架植入应完全覆盖病变。
(8)在支架植入后,怀疑有冠脉夹层时要多体位造影,必要时使用血管内超声,观察支架近端或远端是否存在夹层。
3.冠脉夹层的处理策略一旦出现冠脉夹层,应根据夹层的特征及相应临床情况作出判断,采取相应的措施。植入冠状动脉支架以覆盖内膜撕裂片、稳定血管腔、防止夹层扩展是首选的方法。
(1)对于无症状、无心电图改变、TIM I 3血流的夹层通常预后好,发生血管急性闭塞的机会小,无需进一步处理。
(2)对于长度<10mm、管腔狭窄<30%而且血流好的夹层可不予以处理,但如果支架植入简单而且可使病变趋于稳定的,较多术者主张植入支架。
(3)对于尽管血流正常但是有缺血并发症危险因素的夹层应植入支架。
(4)对于夹层长度<20mm的大血管,支架应完全覆盖夹层。大多数介入医生对没有影响血流的高危夹层病变植入支架,可避免导管室外的急性闭塞。
(5)对于造影结果不满意、残余狭窄<30%、螺旋夹层<15m、TIM I血流≤2级。C~F型夹层应植入支架;特别是范围广泛的螺旋形夹层,可采用多个支架植入;也可在夹层两端分别支架,于夹层的远端点状植入支架以防止撕裂继续向远端扩展,然后于夹层近端点状植入支架以使夹层完全封闭(图7-10)。

图7-10
A.冠脉中段A型病变;B.直接植入3.5/13mm支架;C. 90min后患者胸痛,心电图ST段抬高,造影支架远端夹层,血管闭塞;D.支架植入,封闭夹层,冠脉血流恢复。
(6)对于植入支架后产生的夹层,IVUS发现支架两端夹层的发生率较高,支架两端的小夹层如血流不受影响,IVUS或冠脉造影未发现危及管腔闭塞的情况,无需进一步处理,但应加强抗凝抗栓药物的力度,以防止急性、亚急性血栓的发生。Colombo等认为以下几种情况应在支架两端考虑植入支架:①IVUS提示假腔占管腔的50%以上;②多普勒冠脉血流储备(CFR):CFR<2.5;③冠脉血流储备分数(FFR):FFR<0.75(应用腺苷后)。
(7)对于支架植入后血流未得到改善,仍有50%以上管腔狭窄,且血流动力学不稳定的患者应积极采用在IABP支持下行急诊CABG术。
(8)对于左主干夹层、支架不能稳定的长夹层、支架植入失败血流动力学不稳定的,应考虑急诊CABG。
(9)对于自发性夹层的处理比较困难,这类夹层通常比较复杂,处理不当可引起冠脉急性闭塞,而导丝通过病变是手术成功的关键,导丝的选择及操作是通过病变的关键,术者必须具有介入治疗的良好技术及丰富经验,才能保证手术成功。
(王伟民 刘 健)
参考文献
[1] FarbA,VirmaniR,AtkinsonJB,et al.Plaquemorpholo-gyandpathologicchanges in arteries from patients dying aftercoronary balloon angioplasty[J]. J Am CollCardiol,1990,16:1421.
[2] HonyeJ,MahonJD,JainA,et al. Morphological effects of coronary balloon angioplasty invivo assessed by in travascular ultrasoundimaging[J]. Circulation,1992,85:1012.
[3] YockPG,LinkerDT,AngelsenBAJ. Two-dinensional intravascular rultrasound:technical development and initial clinical experience[J]. J Am SocEcho,1989,2:296.
[4] TobisJM,MalleryJ,MahonD,et al. Intravascularul-trasound imaging of human coronary arteries invivo:anal-ysis of tissue characterizations with comparison vitrohisto-logicals pecimens[J]. Circulation,1991,83:913.
[5] GerberTC,ErbelR,GorgeG,et al. Classification of morphologic effects of percutaneous transluminal coronary angioplasty assessed by intravascular ultrasound[J]. Am J Cardiol,1992,70:1546.
[6] BlockPC,MylerRK,StertzerS,et al.Morphology after transluminal angioplasty in human beings[J]. NEng lJ Med,1981,305:382.
[7]WallerBF,OrrCM,PinkertonCA,et al. Coronary balloon angioplasty dissections:“thegood,thebadandtheugly”[J]. J Am Coll Cardiol,1992,20:701.
[8] Fitzgerald. PJ,PortsTA,YockPG.Contribution of local-ized calcium depositsto dissection after angioplasty—an observational study using intravascular ultrasound[J]. Circulation,1992,86:64.
[9] DuberC,JungbluthA,RumpiltHJ,et al. Morphology of he coronary arteries after combined thrombolysis and percutaneous transluminal coronary angioplasty for acute myocardial infarction[J]. Am J Cardiol,1986,58:698.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















