第七节 胰腺外分泌肿瘤
一、概述
胰腺癌是一类高度恶性的肿瘤,至今其预后仍很差。导管腺癌是最常见的类型。目前在认识导管腺癌发病的分子机制方面已取得了很大进步。非导管性胰腺肿瘤涵盖的形态学范围很广,需要病理学家逐个认识并分类,其获治的机会有显著差异。
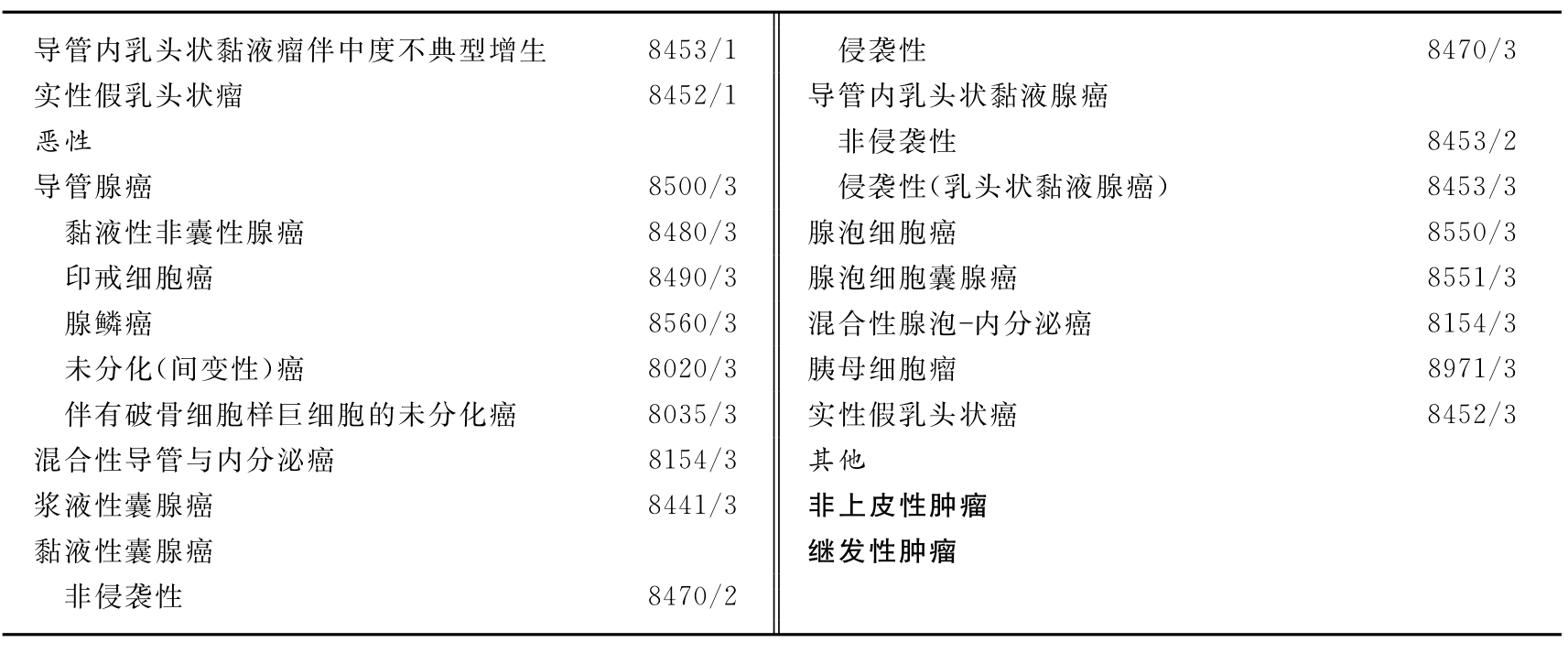
胰腺外分泌肿瘤的组织学分类见表5-6。
表5-6 胰腺外分泌肿瘤的组织学分类

(续表)
二、胰腺癌
胰腺癌仍是治疗最棘手、诊断最困难的肿瘤。由于其预后极差,被称作dismay疾病。在美国2001年死于消化系统肿瘤的235 700人中,12%是患胰腺癌,仅居结肠癌之后。
在实体肿瘤中,按致死率排序,胰腺癌位居第5位,而且在过去20年中无明显改变。一项令人惊异的统计发现,2002年美国的胰腺癌发病人数(n=30 300)几乎等于因胰腺癌而死亡的人数(n=29 700)。人类肿瘤中很少有发病率几乎等于致死率的肿瘤。低于20%的胰腺癌患者生存2年以上,仅2.5%~3%的患者存活5年以上,大多数报道的胰腺癌5年生存率仅1%。美国癌症协会制订的奋斗目标是到2015年,减少25%的癌症发病率和50%的癌症致死率,但这一目标在胰腺癌恐怕难以实现。
胰腺癌的发病率经历了1930~1980年的稳定增长,之后开始保持稳定。
我国的胰腺癌发病率与地域有关,上海的发病率最高,达到7.21/10万,湖南省发病率最低,为0.47/10万,发病率也有逐年上升趋势(20世纪60年代发病率为所有恶性肿瘤的第22位,90年代达到第5位)。上海的胰腺癌致死率由1997年的第9位上升到2004年的第7位。
(一)胰腺导管腺癌
胰腺导管腺癌(ductal adenocarcinoma of the pancreas)是一种几乎完全发生于成人的肿瘤,可能来自胰腺导管上皮,并且在表型上与之类似,可产生黏液,并表达特征性的细胞角蛋白。
60%~70%的导管腺癌见于胰头部,余者位于胰体和(或)胰尾。胰头肿瘤大多位于上半部分,位于钩突者罕见。在极罕见的情况下,异位的胰腺组织也会发生癌。
1.大体特征 导管腺癌为质硬、边界不清的肿块,其切面为黄白色,出血和坏死并不常见,但可见一些微囊肿。在手术切除标本中,大多数胰头癌的大小为1.5~5cm,平均直径为2.5~3.5cm。胰体/尾的肿瘤在诊断明确时通常要比胰头肿瘤更大一些。直径<2cm的肿瘤并不常见,并且在大体检查时可能难以辨认。
胰头癌通常侵及胆总管和(或)主胰管,并造成狭窄,导致两个导管系统的近端扩张。主胰管完全阻塞会造成狭窄前的导管极度扩张,伴导管袋状结构形成,以及胰腺实质的纤维性萎缩(即阻塞性慢性胰腺炎)。更为晚期的胰头癌会累及Vater壶腹和(或)十二指肠壁,造成肠壁溃疡。胰体/尾的肿瘤会阻塞主胰管,但一般不会累及胆总管。
手术切除的胰腺癌尚局限于胰腺之内是非常少见的。在胰头癌中,肿瘤对胰周的侵犯通常通过神经鞘进行,主要累及腹膜后脂肪组织,之后会侵及腹膜后静脉和神经。在晚期病例中,可见肿瘤直接蔓延到邻近的器官和(或)腹膜。在胰体/尾癌中,由于肿瘤发现得更晚,局部的蔓延通常更为广泛,累及的范围包括脾、胃、左侧肾上腺、结肠以及腹膜。
胰头癌的淋巴扩散,按照受累频率的降序排列,分别为十二指肠后(胰、十二指肠后)和胰头上淋巴结组,胰头下和胰体上淋巴结组,胰、十二指肠前和胰体下淋巴结组。在标准的Whipple术式中,这几组淋巴结通常要随胰头一起切除。更远的淋巴结转移可见于肝十二指肠韧带、腹腔干、肠系膜上动脉根部,以及肾动脉水平的主动脉周围淋巴结。只有进行扩大式Whipple术,才能将这些淋巴结清除。胰体/尾癌首先转移到胰尾上下淋巴结组和脾门淋巴结。它们也会通过淋巴管扩散到胸膜和肺。血行转移的靶器官,按照转移频率的大致次序排列,分别为肝、肺、肾上腺、肾、骨、脑和皮肤。
2.组织病理学
(1)光镜下,大多数导管腺癌为中到高分化。它们表现为形成较好的腺体结构,与正常胰腺导管有不同程度的相似,弥漫分布在反应性结缔组织增生的间质中。大量的纤维间质形成了它们坚硬的质地。在同一肿瘤中,不同区域分化程度的差异非常常见,但在高分化肿瘤中出现低分化灶是很少见的。
(2)组织化学和免疫组织化学 虽然没有组织化学和免疫组织化学的标记物可以明确地分辨胰腺和胰腺外腺癌,但还是有一些标记物可用于辨析胰腺的导管腺癌,以及非导管类型的肿瘤或是其他胃肠道的肿瘤。导管腺癌主要是硫酸化的酸性黏蛋白染色阳性,但也有局灶区中性黏蛋白染色阳性。在免疫组化方面,大多数导管腺癌表达MUC1,MUC3,MUC5/6(但不表达MUC2),CA19-9,Du-Pan-2,Span-1,CA125以及TAG72。CA19-9,Span-1,CA125和TAG72的表达在其免疫反应性和特异性方面具有高度可比性。这些标记物也会不同程度地与正常胰腺导管上皮细胞反应,特别是慢性胰腺炎的标本中,以及某些浆液性囊腺瘤和腺泡细胞癌的肿瘤细胞中。
抗CEA的单克隆抗体,不识别CEA家族的其他成员,因此可用于分辨非肿瘤性的导管改变,比如导管乳头样增生及各种肿瘤。在浆液性囊腺瘤中CEA是阴性的。
正常的胰管和胆管细胞以及胰腺中央腺泡细胞表达CK7、CK8、CK18、CK19,偶尔表达CK4。腺泡细胞只表达CK8和CK18,胰岛细胞表达CK8和CK18,偶尔还有CK19。导管腺癌与正常导管上皮表达的细胞角蛋白组合相同,即CK7、CK8、CK18、CK19。>50%的癌还会表达CK4,但通常不表达CK20。既然非导管类型的胰腺肿瘤(腺泡细胞癌和内分泌肿瘤,CK8、CK18和CK19)以及肠道癌(CK8、CK18、CK19和CK20)的常见角蛋白类型与导管癌的角蛋白类型有所不同,就可以根据它们的角蛋白型别进行鉴别诊断。
导管腺癌通常是波形蛋白阴性的。除了极少的例外情况(参见混合性导管-内分泌癌),诸如突触素、嗜铬素之类的内分泌标记物的标记结果也是阴性的,但它们也可能含有一些散在的、紧邻肿瘤细胞的内分泌细胞(可能是非肿瘤成分),尤其在分化非常好的癌中。它们的胰酶标记结果,如胰蛋白酶、糜蛋白酶和脂肪酶一般都是阴性的。
3.组织学亚型 目前认为腺鳞癌以及未分化癌(包括含破骨巨细胞的肿瘤),黏液性非囊性癌和印戒细胞癌是导管腺癌的亚型,因为这些癌即使是在分化很差的情况下,也包含小灶性具有导管分化的肿瘤性腺体。
(1)腺鳞癌是一种少见的肿瘤,相对发生率为3%~4%,其特征为含有多少不等的产黏液的腺体和鳞状成分。鳞状成分至少应占肿瘤组织的30%,而且,可以存在小灶分化不良的细胞和梭形细胞。纯鳞形细胞癌非常罕见。
(2)未分化(间变性)癌也被称作巨细胞癌、多形性大细胞癌以及肉瘤样癌,这些肿瘤相对发生率为2%~7%。
(3)伴破骨细胞样巨细胞的未分化癌,患者平均年龄为60岁,但发病年龄范围可以很宽,可见于32~82岁。有些肿瘤被发现与黏液性囊性肿瘤相关。在有关该肿瘤的早期报道中,有人认为它比通常的导管腺癌预后良好。更近一些的文献报道的平均生存时间为12个月。
(4)非囊性黏液性腺癌,发生率仅1%~3%,也被称为“胶样”或胶质癌。肿瘤>50%都由黏液构成。此型发病的性别与年龄分布与导管腺癌类似。肿瘤可很大,而且通常边界清楚。曾有文献报道它可形成腹腔假黏液瘤。有趣的是,有些导管内乳头状黏液性肿瘤的浸润成分与非囊性黏液性腺癌类似,但黏液性非囊性腺癌不应与黏液性囊性肿瘤混淆,因为后者的预后明显更好。
(5)印戒细胞癌是极为罕见的。预后极差,在作出该诊断前必须排除胃肠原发肿瘤转移到胰腺的可能。
(6)混合性导管-内分泌癌的生物学行为与通常的导管腺癌相似。
(7)带有某些内分泌及导管成分的腺泡细胞癌和胰母细胞瘤,以及带有导管成分的内分泌肿瘤不在此处的讨论范围之内,因为它们的行为是由其腺泡和内分泌成分决定的。混合性导管-内分泌癌还必须与伴有散在内分泌细胞的导管腺癌相鉴别,因为在40%~80%的导管腺癌中都可见散在的内分泌细胞,在分化好的肿瘤中尤其常见,这些内分泌细胞可以沿着肿瘤性导管结构的基底呈线性排列或是间插在肿瘤柱状细胞之间。“碰撞”肿瘤,即由分界清楚的两种成分构成的肿瘤不在混合性导管-内分泌癌之列。
(8)其他具有导管样表型的非常罕见的癌,包括透明细胞癌以及纤毛细胞癌。最近报道了具有“髓样”特征的癌,这些病变与野生型K-ras状态和微卫星不稳定性有关。
(9)黏液性囊性肿瘤以及导管内乳头状黏液性肿瘤可能进展为浸润性癌。重度导管不典型增生-原位癌、高级别的上皮内瘤变常与浸润性的导管腺癌有关,并可能代表浸润性癌的癌前病变或是浸润性肿瘤的导管内持续延伸。类似的导管改变也曾见于远离大体肿瘤处,或是见于浸润性导管腺癌发生数年之前。被广泛接受的癌前病变包括黏液细胞肥大、导管乳头样增生伴黏液细胞肥大(无不典型增生的乳头状导管病变)、腺瘤样导管增生以及鳞形上皮化生。
如最近一项针对普通胰腺炎的研究表明,只有少部分导管病变可以进展为浸润性癌,该研究显示,所有类型的导管病变,甚至正常上皮都可能带有K-ras突变,而且这些病变在胰腺内均匀分布,并不集中在胰腺癌最高发的胰头部。近来有提议采用“胰腺上皮内瘤变”(PanIN)来命名这些病变。(http://pathology.jhu.edu/pancreas.panin)
4.预后和预测因素
(1)导管腺癌在大多数病例中是致死的。未经治疗的患者平均生存时间为3个月,在根治切除术后,平均生存时间为10~20个月。术后总体5年生存率为3%~4%。虽然曾有报道,经过挑选和分期-分层所得出的亚组生存率可以接近25%甚至46%。不可切除的肿瘤要采用姑息性的引流手术。最多约10%的患者对5-Fu和吉西他滨化疗有反应,而单独放疗多无效。
(2)肿瘤局限在胰腺之内,且直径<3cm的病例的生存时间(17~29个月)要长于肿瘤体积更大,或是有腹膜后侵犯的患者(6~15个月)。胰体/尾部的癌倾向于比胰头部的癌分期更晚。有些作者发现,有淋巴结转移会使得预后大大变差,但另一些作者未发现这一点。
在手术切除的患者中,切除后无瘤组织残存的患者预后最佳。残存的瘤组织提示肿瘤局部扩散到胰腺周围组织,比如腹膜后切缘,在决定预后方面至关重要。
(3)局部复发是胰腺导管腺癌切除术后决定存活的主要因素。最常见的复发部位就是围绕大的肠系膜血管的组织。因此如果要达到“治愈”切除(RO)的目的,干净的腹膜后切缘是必需的。常见的复发部位来自于太小而不能在手术中发现的淋巴结和肝转移灶。腹膜和骨髓是复发的罕见部位,虽然有1/4的患者可以通过腹腔镜检出肿瘤细胞,有1/2的患者可以在Whipple术中通过骨髓环钻术检出肿瘤细胞。
(4)根据分级系统的标准,可见术后中位生存时间与肿瘤分级,核分裂指数以及细胞异型性的严重程度密切相关。但是,由于分级系统在很大程度上具有主观性,可重复性低。其他研究未发现分级与生存期之间存在相关性。核参数(如核的中位大小、核面积和核周径)也显示对于导管腺癌有判断预后的价值。
(5)非二倍体和(或)非整倍体DNA与较晚的肿瘤分期以及更短的生存时间相关。有人报道细胞嗜银染核仁组成区(AgNOR)计数低(<3.25)的肿瘤比该计数高的肿瘤预后好。Ki-67标记指数高是预后不良的一个标志,但不能成为独立的预后指标。
一系列生长因子的免疫组化表达显示与生存时间只有弱相关。
(二)腺泡细胞癌
腺泡细胞癌(acinar cell carcinoma,ACC)是一类主要发生于成人的癌,肿瘤细胞大小相对一致,排列成实性或腺泡状,并分泌胰酶。
腺泡细胞癌占成人所有胰腺外分泌肿瘤的1%~2%。发病年龄较大,平均年龄62岁。该肿瘤在40岁以下的成人中罕见,儿童中确有发生,患者年龄多在8~15岁。腺泡细胞癌多见于男性,男女之比为2∶1。
1.大体特征 腺泡细胞癌可发生于胰腺的任何部位,胰头部最常见。
腺泡细胞癌大体上边界清楚,可呈多结节状,结节质地软,呈黄色或棕色,可见坏死或囊性变的区域。腺泡细胞癌常为一巨大肿物,平均直径>10cm。偶尔肿瘤附于胰腺表面。肿瘤可侵犯邻近组织,如十二指肠、脾或大血管。多囊性的腺泡细胞癌即腺泡细胞囊腺癌已有报道。
腺泡细胞癌转移至局部淋巴结及肝最常见,其他器官转移偶有报道。其分级与导管腺癌相同。
2.免疫组织化学 通过免疫组化证明肿瘤细胞中胰酶的产生对腺泡细胞癌的诊断非常有帮助。抗胰蛋白酶、糜蛋白酶、脂酶及弹力蛋白酶的抗体都可选用。95%的病例表达胰蛋白酶和糜蛋白酶,脂酶阳性率较低(约70%)。胰液蛋白的表达也很常见。有关酶的免疫组化染色在实性区域肿瘤细胞胞质弥漫阳性,而在正常腺泡区域仅胞质顶端阳性。
腺泡细胞癌中,小部分肿瘤细胞可表达内分泌及导管分化的标记物。>1/3的病例可有散在的个别肿瘤细胞CHG-A或SYN阳性。半数以上病例CEA和B72局灶阳性。AFP阳性较少见,通常见于血清AFP升高的病例。
3.腺泡细胞癌的亚型
(1)腺泡细胞囊腺癌 很罕见。大体上为一多囊性肿瘤,镜下具有囊壁细胞且有腺泡细胞癌的特征,在间隔内也含有实性细胞巢。组织化学和超微结构相似于经典腺泡细胞癌,治疗和预后也相似。
(2)混合性腺泡-内分泌癌 具有多于一种细胞类型的罕见肿瘤(每种细胞成分>25%)。根据细胞类型,这些“混合性癌”可分别命名为“混合性腺泡-内分泌癌”、“混合性腺泡-导管癌”或“混合性腺泡-内分泌-导管癌”,其中最具特征的是混合性腺泡-内分泌癌。在大多数混合性腺泡-内分泌癌只能通过免疫组化证实肿瘤的多向分化。
4.预后 该肿瘤具有侵袭性,中位存活率为18个月,5年存活率<10%。约50%的患者在确诊时已转移,另有25%的患者在原发肿瘤手术切除后出现转移。影响预后的最重要的因素是肿瘤的分期,无淋巴结或远处转移的患者存活时间较长;伴有脂酶过分泌综合征的患者多数已有广泛远处转移,因此存活时间明显缩短。尽管肿瘤存活率很低,但有个案报道有转移但存活数年的病例,同时肿瘤对化疗的反应也引起了关注。因此就某种意义而言,腺泡细胞癌的预后略好于导管腺癌。
目前尚未提出腺泡细胞癌特异的分期体系。腺泡的广泛形成与肿瘤预后没有关系。目前尚无足够的病例对发生于儿童的腺泡细胞癌的预后进行精确评估。已有的数据表明,发生于20岁以下患者的腺泡细胞癌侵袭性低于成人。
三、胰腺浆液性囊性肿瘤
胰腺浆液性囊性肿瘤(serous cystic neoplasms,SCN)是一种囊性上皮性肿瘤,由富于糖原的导管型上皮细胞组成,并且产生类似于血清的水样液体。多数病例(浆液性囊腺瘤)为浆液性微囊性腺瘤或浆液性寡囊性腺瘤,均为良性病变。罕有病例有恶性指征(浆液性囊腺癌)。还有一种实性亚型,实性浆液性囊腺瘤,很少见。
(一)浆液性微囊性腺瘤
浆液性微囊性腺瘤(serous microcystic adenoma,SMA)是少见肿瘤,占所有胰腺外分泌肿瘤的1%~2%。平均年龄为66岁(34~91岁),女性居多(70%)。复旦大学附属中山医院SMA病例12例,占4%,平均年龄51岁(36~69),女性占80%。
肿瘤最常见于胰体或胰尾部(50%~75%),其他见于胰头部。
约1/3病例是在常规体检或尸检时偶然发现。2/3的病例由于肿物的局部影响而出现症状,包括腹痛、腹部包块、恶心呕吐以及消瘦。即使肿瘤位于胰头部,因胆总管梗阻而导致的黄疸也并不常见。
浆液性微囊性腺瘤是单发、边界清楚、圆形略有小圆突起的肿物,直径为1~25cm不等(平均6~10cm),肿瘤切面呈海绵状,由众多小囊组成,内含浆液性(透明水样)液体。囊腔直径为0.1~0.5cm,少数直径>2cm。通常这些囊腔围绕中央星状瘢痕排列,后者中央为致密纤维结节核心,纤细的纤维分隔向周边呈放射状排列。
低倍镜下,囊的排列方式呈海绵状。囊内含蛋白性液体,衬以单层立方或扁平上皮细胞。胞质透明,极少嗜酸性和颗粒状。细胞核居中,呈圆形、卵圆形,大小一致,核仁不明显。胞质内丰富的糖原PAS染色阳性,但淀粉酶消化后PAS染色及阿尔辛兰染色阴性。缺乏核分裂,细胞没有异型性。偶尔肿瘤细胞形成囊内乳头状突起,但没有纤维血管轴心。中央纤维瘢痕核心由透明变的组织构成,其中可见少量簇状小囊。
肿瘤细胞表达上皮标记,如EMA、CK7、CK8、CK18、CK19。另外,肿瘤细胞可局灶表达CA199和B72.3。CEA、胰蛋白酶、CHG-A、SYN、S-100、vimentin、desmin、actin及Ⅷ因子相关抗原均为阴性。
浆液性微囊性腺瘤患者的预后很好,很少有恶变的危险。
(二)浆液性寡囊性腺瘤
浆液性寡囊性腺瘤比浆液性微囊性腺瘤更为少见,没有明显的性别倾向。目前仅有10例浆液性寡囊性腺瘤报道。患者年龄在63~72岁,男女各为5例。成人患者多>60岁(30~69岁,平均65岁);有报道有2名男婴及2名女婴发生该肿瘤,年龄为2~16个月。复旦大学附属中山医院1例为成人(女性55岁)。大多数浆液性寡囊性腺瘤位于胰头和胰体部。位于胰头部的肿瘤可能会引起胆总管壶腹部的梗阻。
典型的肿瘤是直径为4~10cm(平均为6cm)的囊性肿物。切面有数个(有时仅1个)充满透明或棕色水样液体的囊腔,囊腔直径为1~2cm,但也有报道囊腔直径8cm的病例。囊腔排列不规则,没有中央星状瘢痕,有时可见宽的纤维分隔。肿瘤边界不清,囊可以延伸到周围胰腺组织深部。
浆液性寡囊性腺瘤与浆液性微囊性腺瘤组织形态相似。但有时衬附的上皮更趋向于立方上皮而非扁平上皮,核相对较大,局灶可有轻度的核多形性。由于富含糖原而胞质透明或嗜酸性。纤维间质通常透明变。免疫组化及超微结构特征同浆液性微囊性腺瘤。
若没有恶性潜能的证据,且生长缓慢,即使进展期的肿瘤经姑息性手术切除也有效。
四、胰腺黏液性囊性肿瘤
虽然文献中已有多于500例的报道,黏液性囊性肿瘤(mucinous cystic neoplasms,MCN)仍然属于少见病例,约占胰腺外分泌肿瘤的2%~5%。在复旦大学附属中山医院的300例胰腺肿瘤中占5%(15例)。近年来随着影像诊断技术的进步,MCN数目逐步增加,这可能是因为其诊断标准的变更,再加上它与导管腺癌相比,手术可切除率更高。
(一)概述
根据MCN定义,即与胰腺的导管系统没有相通并具有卵巢型间质的肿瘤,最近一项研究发现绝大多数病例发生于女性。在早期文献中发生于男性的病例有可能都属于导管内乳头状黏液性肿瘤。AFIP的130例MCNs中女性占85%~95%,复旦大学附属中山医院的病例也只有2例男性(2/15),患者平均年龄49岁(29~78岁)。黏液性囊腺癌患者年龄大约比腺瘤或交界性肿瘤患者大10岁(分别为54岁和44岁),显示其腺瘤-腺癌的序列演变过程。
绝大多数病例发生于胰腺体-尾部。胰头部很少累及,且多为黏液性囊腺癌。
MCN的术前诊断很重要,因为它与其他类型囊性肿瘤的处理方法完全不同。另外,MCN必须与炎性假囊区别,若为后者,将假囊内液体抽吸掉就足够了,而这样的操作对MCN患者而言是相当危险的,即使是组织学上良性的黏液性囊性肿瘤,在将囊液抽吸后也有可能复发,并发展为浸润性囊腺癌。术前获得准确诊断的最可靠的方法就是,将所有可获得的临床、血清学、影像学资料及活检所见汇集起来综合评价。
浸润性黏液性囊腺癌与导管腺癌的局部扩散途径相同。典型情况下首先转移至胰周淋巴结及肝。分期与导管腺癌相同。
(二)大体特征
典型的MCN为一圆形肿物,表面光滑,有纤维性假包膜,包膜厚度不等,常伴有钙化。肿块直径为2~35cm,平均为6~10cm。切面为单房或多房性肿瘤,囊腔直径从几毫米到数厘米,腔内含黏液或黏液和出血坏死物的混合物。单房性肿瘤的内壁通常光滑有光泽,而多房性肿瘤内壁常有乳头状突起和(或)附壁结节。恶性肿瘤更容易出现乳头和附壁结节。原则上肿瘤与胰腺导管系统没有交通,但也有例外。
(三)组织病理学
MCN有两种明显的成分:内衬的上皮细胞和致密的富于细胞的卵巢型间质。大的囊腔上皮可能广泛剥落,因此需要广泛取材以显示衬附的上皮。上皮细胞扁平或形成乳头状或息肉状突起,有时呈假复层结构及隐窝样凹陷。柱状细胞的核位于基底部并有丰富的细胞内黏液,消化后PAS染色及AB染色均阳性。假幽门腺、胃小凹、小肠和大肠及鳞形细胞分化均可见到。约半数的肿瘤柱状细胞基底部有散在的嗜银性或亲银性的内分泌细胞。
按照柱状上皮的组织学形态,可以分为轻度到重度不典型增生(上皮内瘤变低-高级别)。根据上皮内瘤变的分级,肿瘤可分为腺瘤、交界性(低度恶性)及非浸润性或浸润性癌。
(1)黏液性囊腺瘤的细胞异型性小,细胞核位于基底部,核轻度增大,没有核分裂。
(2)交界性黏液性囊腺瘤有乳头状突起以及隐窝样凹陷形成,细胞排列成假复层,核拥挤,轻度增大,可见核分裂象。
(3)黏液性囊腺癌可以是浸润性或非浸润性。它们显示高级别上皮内瘤变,但这些病变通常为局灶性,只有通过从不同区域多取材才能发现。上皮多形成乳头,伴不规则的分支及出芽,核复层,有重度不典型增生且核分裂多见。
浸润性黏液性囊腺癌的特征是恶性上皮成分浸润至间质。浸润的成分通常与普通的导管腺癌相似,但黏液性囊腺癌可以出现浸润性腺鳞癌、破骨细胞样巨细胞癌或绒癌。浸润灶可能很局限,因此需要仔细检查。
卵巢样间质由紧密排列的梭形细胞组成,细胞核圆形或卵圆形,胞质少,常有不同程度的黄素化,特点为单个或成簇的上皮样细胞,圆形或卵圆形核及丰富的透明或嗜酸性胞质。有时这些细胞类似于卵巢门细胞,与神经干相关或位于其中。从腺瘤到癌,间质黄素化呈减少趋势。体积大的MCN间质可能纤维化,细胞不丰富。罕见情况下MCN出现具有肉瘤样间质或肉瘤样的附壁结节。
(四)免疫组织化学
上皮成分呈上皮标记阳性,包括EMA、CEA、CK7、CK8、CK18、CK19,有时可能显示胃、肠、胰腺分化。这在卵巢及腹膜后MCN中也可以见到。随着上皮不典型增生程度的增加,分泌的黏液由硫酸性黏液变为唾液酸或中性黏液。肿瘤细胞表达胃型黏液标记M1和PGII,肠型黏液标记CAR-5和M3SI,胰腺型黏液标记DUPAN-2和CA19-9。另外,胰腺、肝、胆及腹膜后MCN具有相同的上皮内内分泌细胞表型。
间质成分表达vimentin、a-SMA、desmin。多数病例表达ER及PR。黄素化的细胞表达calrentinin,a-inhibin以及b-catenin。其中a-inhibin是提示性索间质分化的标记。
(五)预后及预测因素
如果肿瘤完整切除,无论肿瘤细胞异型到什么程度,MCN的预后都很好。浸润性黏液性囊腺癌的预后取决于肿瘤浸润的范围。肿瘤壁及瘤周组织出现浸润则肿瘤易复发并且预后不好。>50岁患者存活率相对较低。肿瘤的部位、大小、大体形态、分化程度、间质黄素化以及P53阳性率,与预后关系不大。
MCN中非整倍体罕见,多见于黏液性囊腺癌且提示预后差。10%的肿瘤细胞P53核阳性,P53是与黏液性囊腺癌预后显著相关的标记。
五、胰腺导管内乳头状黏液性肿瘤
它是起源于主胰管或其主要分支的一种分泌黏液的乳头状肿瘤(intrductal papillary mucinous neoplasms,IPMN)。乳头上皮的成分、分泌黏液的程度、囊性导管扩张及侵袭程度可以有很大差别。导管内乳头状黏液性肿瘤又分为良性、交界性和恶性非浸润性或浸润性病变4种。
(一)历史回顾及概述
乳头状胰腺肿瘤很多年以前就被认识了,但直至1982年才将黏液性囊性肿瘤和导管内乳头状肿瘤区分开。最初对导管内乳头状黏液性肿瘤的认识源于临床和内镜医生的观察,随后很快就有了病理描述。自从第一次报道以来,导管内乳头状黏液性肿瘤的发病率逐渐上升,这可能与采用新的诊断技术以及对该肿瘤的认识加深和分类的进展有关。10年前,导管内乳头状黏液性肿瘤很可能被归入了黏液性囊性肿瘤。至今分类和命名还存在很大差异,本文采用WHO的统一标准。
该肿瘤发病率低但具体数字不详,因为没有进行过大量人群的检测。估计其发病率占胰腺外分泌肿瘤的1%~3%,年发病率<1人/10万。发病年龄范围较大(30~94岁),平均诊断年龄在50~60岁。男性多发。导管内乳头状黏液性肿瘤最先在日本和法国报道,随后世界均有报道。两组研究显示,亚洲人比白种人发病率高,但还需进一步证实。复旦大学附属中山医院300例胰腺肿瘤中,导管内乳头状黏液性肿瘤44例,约占15%,其中男性28例,女性16例,平均发病年龄64岁(41~79岁)。
大多数肿瘤发生于主胰管或其胰头部的分支。常为单个囊性肿块或节段性侵犯导管,也有弥漫性分布的报道。由于手术切除导管内乳头状黏液性肿瘤后在残余的胰腺组织有可能复发,提示该肿瘤可能是多中心性发生。导管内乳头状黏液性肿瘤可以累及Vater壶腹,常与累及Wirsung管或胆总管有关。
(二)大体特征
由于导管扩张程度的不同,导管内乳头状黏液性肿瘤直径多为2~5cm,最大径可达8cm。呈囊性,如果分支受累,可以呈多灶性,当病灶广泛分布于近端胰腺导管系统时,甚至可以累及Vater壶腹。导管内乳头状黏液性肿瘤的黏液是黏稠或胶样的,可以使部分被覆正常形态上皮的导管扩张。囊腔内壁光滑,颗粒样或细绒状,后两者提示乳头状生长。如果有较大乳头时,扩张的导管内可见疣状赘生物或充满软乳头状肿块。
肿瘤周围胰腺组织及退化的间质常呈灰白色,实性,表现为慢性阻塞性胰腺炎的改变。有浸润时在纤维组织内可以见到胶冻样区域。
IPMN与常见的胰腺导管腺癌的区别在于后者不与主胰管相通,所包含的PanIN发生在<5mm的导管上皮。这就要求大体检查时对标本的仔细描述,包括囊肿的大小、有无肉眼可见的乳头、囊内容物的性质、囊肿与导管系统的关系,并需剖检整个胰导管系统,以除外存在阻塞性病灶。
(三)组织学表现
导管内乳头状黏液性肿瘤的瘤细胞常呈高柱状,含有黏液,衬于扩张的导管或导管分支的囊腔。典型病变上皮形成乳头状或假乳头状结构,部分肿瘤可以由非乳头状上皮构成,有些肿瘤没有上皮衬覆。导管扩张程度及黏液分泌量差异很大。在肠上皮化生的肿瘤上皮中多见杯状细胞和潘氏细胞,肿瘤细胞中也可见到一些神经内分泌细胞。
(四)分级
由于一个肿瘤内不同区域的差异很大,因此重要的是取好材,要特别注意乳头区域,因为它常是重度上皮内瘤变发生的区域,还要注意硬化区域,这区域常是浸润的表现。
根据出现的不典型增生最严重的程度,导管内乳头状黏液性肿瘤分为良性、交界性和恶性。
1.导管内乳头状黏液性腺瘤 上皮由含有黏液的高柱状细胞组成,有轻度或没有不典型增生,腺瘤内的上皮保持高级别分化。
2.交界性导管内乳头状黏液性肿瘤 伴有中度不典型增生的导管内乳头状黏液性肿瘤归入交界性病变。上皮具有不超过中等程度的异型性,细胞失去极性,核拥挤增大和异染色质。乳头状区域可见有间质芯的真乳头,也可见假乳头结构。
3.导管内乳头状黏液性癌 伴有重度不典型增生的导管内乳头状黏液性肿瘤,即使没有浸润也称为导管内乳头状黏液性癌。癌组织呈乳头或微乳头状结构。筛状和小片上皮向腔内出芽生长提示癌的诊断。重度不典型增生的主要细胞学表现为细胞失去极性,胞质黏液成分减少,细胞及核的多型性、核增大,并出现核分裂(尤其是基底上或腔面部位)。重度不典型增生细胞可以没有黏液。非浸润病变称为非浸润性导管内乳头状黏液性癌。如果有浸润,由于肿瘤已不仅仅是导管内病变,这时的导管内乳头状黏液性肿瘤则可称为乳头状黏液性癌。当导管内乳头状黏液性肿瘤为浸润性病变时,浸润成分可以类似于导管腺癌或黏液性非囊性癌,如果以浸润成分为主,就可以诊断为导管腺癌或黏液性非囊性癌,描述时应注明其与导管内乳头状黏液性肿瘤成分的关系。
4.嗜酸性导管内乳头状肿瘤 近年来描述的嗜酸性导管内乳头状肿瘤可能是一类与导管内乳头状黏液性肿瘤表型相关的肿瘤,肉眼形态与导管内乳头状黏液性肿瘤相似。嗜酸性导管内乳头状肿瘤由假复层嗜酸性上皮组成,胞质内含淡粉色颗粒,比潘氏细胞内的颗粒细得多。杯状细胞常混杂在嗜酸性细胞中。嗜酸性肿瘤的一个显著特点是形成“上皮内管腔”,即上皮内有大约相当于1/4细胞大小的空隙。
(五)组织化学及免疫组织化学
应用黏液及免疫组化染色可以检测到导管内乳头状黏液性肿瘤的多种异常改变。
大多数导管内乳头状黏液性肿瘤表达EMA及一些细胞角蛋白CK7、CK8、CK18、CK19。很多肿瘤中出现多种类型的内分泌细胞,但不超过肿瘤细胞总数的5%。
黏液类型的改变常作为肿瘤进展的提示性指标,因为正常导管细胞分泌硫酸型黏液,导管内乳头状黏液性腺瘤分泌中性黏液,交界性病变主要分泌唾液酸黏液。
最近有学者提出应用黏液素对导管内乳头状黏液性肿瘤进行分类。主要表达MUC2,CDX-2的属小肠型导管内乳头状黏液性肿瘤;表达MUC1的属于胰胆管型;既不表达MUC1也不表达MUC2,仅表达MUC5AC的归为裸型。肠型占30%~35%,以表达MUC2为主,对应的恶性者为侵袭性低的胶样型/黏液性非囊性腺癌,虽平均直径较大(5.5cm),但预后较好。胰胆型占20%~22%,多含胰腺上皮内瘤变,可进展为侵袭性强的管状腺癌,虽低表达MUC2(19%),但高表达MUC1(44%),这与肝外胆道的乳头状肿瘤相似。其余的IPMN被称为裸型(null-type),约占31%,细胞相似于胃隐窝上皮,有丰富的细胞内黏液,核位于基底侧。这型既不表达MUC2,也不表达MUC1,而且因肿瘤较小(平均直径2.6cm),几乎不会发展为癌。另外的少数病例为混合型或难分类的。
(六)肿瘤播散和分期
腺瘤、交界性和非浸润性癌可以通过导管内扩散到周围邻近的导管系统,扩散的病变常位于导管内乳头状黏液性肿瘤附近。导管内乳头状黏液性肿瘤扩散到切缘的患者有术后复发的报道。侵袭性肿瘤分期归入导管腺癌。
(七)鉴别诊断
组织学上,导管内乳头状黏液性肿瘤与黏液性囊性肿瘤容易混淆,因为两者都有囊,并且具有相似的上皮成分。然而,导管内乳头状黏液性肿瘤与黏液性囊性肿瘤是完全不同的两种病变,能够很容易地区分开(表5-7)。黏液性囊性肿瘤常见于女性,平均发病年龄在50岁左右,几乎所有病变位于胰体、尾部,典型病变为具有富于细胞的“卵巢”样间质的厚壁,并且与胰腺导管系统无关。
表5-7 IPMN与MCN的主要鉴别要点

(八)癌前病变
导管内乳头状黏液性肿瘤中胰腺上皮内瘤变(包括乳头状增生)分类标准尚未建立完善,需要进一步明确。PanIN主要发生在小叶间导管,肉眼看不到,无临床症状。Nagai等认为,导管内乳头状黏液性肿瘤的早期发生可能是从主胰管或其分支上皮具有黏液化生的扁平细胞逐步发展成乳头状病变的。因此,如果没有明确的分子标记,很难认清导管内乳头状黏液性肿瘤的早期病变。
(九)预后因素
腺瘤及交界性肿瘤的预后很好,3年生存率及5年生存率接近100%。非浸润性癌患者的生存率高于浸润性癌患者,两者都高于典型的导管腺癌。组织学分类及分期是最好的预后判断指标。还有报道表达MUC2和MUC5AC的肿瘤患者预后,比不表达这些黏蛋白的导管腺癌预后相对要好。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















