生化黄腐酸对3种肿瘤细胞体外增殖影响的初步研究
高金岗 陈 沫 何 滨
(海南师范大学生命科学学院热带动植物生态学省部共建教育部重点实验室 海口 571158)
摘 要:以人胃癌细胞株GSC、人肝癌细胞株SPCA和人肺癌细胞株BEL共3种肿瘤细胞为研究对象,用四甲基偶氮唑兰法(MTT法)研究生化黄腐酸对肿瘤细胞体外增殖得的影响。实验通过在3种不同肿瘤细胞培养液内分别加入6种不同浓度的生化黄腐酸,用酶标仪测定3种不同培养肿瘤细胞的OD值,计算每种肿瘤细胞各个浓度下的抑制率。实验结果表明:在各个浓度下,生化黄腐酸对3种不同肿瘤细胞的抑制率均低于50%,属于非肿瘤细胞敏感型药物。提示:生化黄腐酸对肿瘤细胞的体外增殖没有明显的直接抑制作用。另外,生化黄腐酸可能在某种浓度下对肿瘤细胞有促进生长的作用。
关键词:生化黄腐酸 肿瘤细胞 四甲基偶氮唑兰
The Preliminary Study of Biochemical Fulvic Acid on the Proliferation of Four Types of Tumor Cells in Vitro
Gao Jingang, Chen Mo, He Bin
(Co-constructing key Labs by Hainan Province and Ministry of Education for Tropical Animal and Plant Ecology, School of Life Sciences, Hainan Normal University, Haikou, 571158)
Abstract: In this experiment, we used four kinds of cancer cells, GSC, SPCA and BEL as the object of study.We use the MTT method to research if biotechnology fulvic acid has any infection in proliferation of tumor cell.In this experiment, by observing the growth of the four different tumor cells which add 6 different concentrations of biochemical fulvic acid, and The enzyme measured four different cultured tumor cells of OD values, calculate the concentration of each cell inhibition rate of each.The results show that: in all concentrations, biochemical fulvic acid on the inhibition of four different tumor cells were less than 50%, are not sensitive.Tip: biochemical fulvic acid on the proliferation of tumor cells no obvious direct inhibition.In addition, biochemical fulvic acid may be a concentration on the tumor cells has some role in promoting growth.
Key words: biochemical fulvic acid; tumor cell; MTT
肿瘤是危害人类健康的恶性疾病之一,统计资料表明[1],近几年来肿瘤的病死率有上升趋势。目前抗癌药在抑制癌细胞的同时对人体的正常细胞也有一定的损害,尤其是损害人体的免疫系统,造成多种并发症。由于化疗药物等毒副作用大,易耐药等缺点,故临床上多采用给予化疗药物的同时给予辅助用药或采用新型给药系统,其目的是为了产生最大的抑瘤效应,降低不良反应、避免产生抗药性。因此,寻找敏感的、毒副作用小的抗癌药就显得很有必要。
生化黄腐酸(Biotechnology Fulvic Acid,简称BFA)是以作物秸秆等有机物为主要原料,经过特种微生物发酵而产生的以黄腐酸为主要成分的多种生物活性物质的复合物。其来源天然,毒副作用极小,长期使用也不会产生抗药性。
有报道认为,BFA作为饲料添加剂能明显提高动物的抗炎能力[2-3]。临床实验也证明,BFA在止血、抗炎、止痛和调整肠胃功能等方面具有重要作用[4]。有关BFA在机体内的抗肿瘤作用也有报道。张覃沐等[5]在研究黄腐酸对小鼠肿瘤细胞的影响时发现黄腐酸在体内具有抗肿瘤作用。但BFA是否在体外对肿瘤细胞有直接的影响作用尚未见报道。因此,本文以人胃癌细胞株GSC、人肝癌细胞株SPCA和人肺癌细胞株BEL共3种肿瘤细胞为研究对象,初步研究BFA对肿瘤细胞体外增殖的影响,以探讨BFA对肿瘤细胞的生长是否具有直接的抑制作用,从而为BFA抗肿瘤作用的临床研究及应用提供参考依据。
1 实验材料、仪器、药品、试剂与方法
1.1 实验材料
人胃癌细胞株(GSC)、人肝癌细胞株(BEL)和人肺癌细胞株(SPCA),均购自中科院上海细胞库(ATCC)。
1.2 主要实验仪器
倒置显微镜(重庆光学仪器厂);酶联免疫检测仪(华东电子集团医疗装备有限公司);CO2恒温培养箱(日本SANYO公司);超净工作台(苏州净化设备厂);立式超低温冰箱(丹麦Heto公司);高压灭菌锅(日本森展企业有限公司);可调式移液器(BRAND公司);96孔细胞培养板(Pore公司)等。
1.3 主要药品与试剂
1.3.1 药品
生化黄腐酸(BFA),购自上海通威生物技术有限公司,纯度99%以上;胰蛋白酶(Gibco公司);四甲基偶氮唑兰(Sigma公司);二甲基亚砜(天津市化学试剂二厂);RPM1640培养基(Gibeo公司);优级新生胎牛血清(由兰州民海生物工程有限公司);青霉素(80万单位/瓶);链霉素(100万单位/瓶)。
1.3.2 试剂
RPM 1640血清培养基:RPM1640基础培养基1袋,NaHCO3 3.7 g,三蒸水1000 mL,磁力搅拌溶解,调pH=7.5。
胰蛋白酶(0.25%):胰蛋白酶0.5 g,MilliQ水200 mL,磁性搅拌至完全溶解,用直径为0.22 μm的双层滤膜过滤除菌,-20 ℃保存。
PBS缓冲液:NaCl 8.0 g(pH7.2~7.4),KCl 0.2 g,NaH2PO4 1.44 g,KH2PO4 0.24 g,三蒸水1000 mL,高压灭菌,室温保存。
胎牛血清:-20 ℃保存,取出室温融化,放入恒温槽中,56 ℃恒定30 min灭活,分装,-20℃保存。
抗菌素液(双抗液):用注射器吸5 mlPBS,注入链霉素(100万单位)瓶内,反复吹打,使其完全溶解,然后吸出4 mL再注入青霉素(80万单位)瓶内,反复吹打,使其完全溶解。吸出全部于一小烧杯,加PBS至100 mL,在超净台内用过滤器分装,每瓶5 mL,20 ℃保存备用。
四甲基偶氮唑兰(MTT):MTT 50 mg,加PBS 50 mL,搅拌溶解,用直径为0.22 μm的滤膜过滤除菌后,4 ℃避光保存,一周内使用。
1.4 实验方法步骤
1.4.1 冻存细胞的复苏
从液氮罐中取出冻存的GSC、BEL、SPCA和K562细胞株,迅速放入37 ℃水浴中使其在1 min内完全溶解,将细胞悬液移至含有10%胎牛血清的RPM1640培养基的离心管中,在4 ℃,1000 r/ min下离心3 min,弃上清液,将细胞重新悬浮于含10%胎牛血清的RPM1640培养基中,置于37℃,CO2培养箱内培养,24 h后观察细胞贴壁情况,并更换一次培养液。
1.4.2 细胞培养
将冻存复苏的3种细胞株分别装在有适量RPMI1640培养液(内含10%胎牛血清和双抗液)的培养瓶中,置于CO2培养箱中,在恒温37 ℃,5%CO2浓度,饱和湿度下培养。
每3~4天传代一次,传代时小心弃去旧培养液,用PBS缓冲液(pH7.4)冲洗2次,弃去PBS缓冲液,加入适量0.25%胰蛋白酶,37 ℃,消化1~2 min,倒置镜下观察细胞,若胞质回缩,细胞之间不再连接成片,表明此时细胞消化适度,加含10%小牛血清的RPM1640培养基终止消化,用吹打管将已经消化好的细胞吹打为细胞悬液。将细胞悬液由细胞培养瓶中吸入离心管中,1000 r/min离心5 min;离心后弃去上清液,加入新鲜的小牛血清的RPM1640培养基,用微量进样器轻轻反复吹打细胞悬液,使细胞重悬混匀后,分装于培养瓶中再培养。
1.4.3 细胞的冻存
在细胞培养的过程中,防止实验过程中操作不当造成细胞完全死亡,可以将一部分细胞冻存起来。冻存细胞时选用对数生长期细胞。冻存方法如下:将细胞制成细胞悬液,计数,离心,去上清,加入含10%二甲基亚砜(DMSO)的冻存液,用吸管轻轻吹打使细胞重悬,使细胞密度达到5×106/mL,分装入无菌冻存管中,置于4℃,45 min,然后置于-20 ℃,45 min,最后在-80 ℃下过夜,逐级降温冷冻,然后放入液氮罐中保存。
1.4.4 细胞铺板
铺板前处理:将对数生长期的细胞经0.25%胰蛋白酶消化后吹打成单个悬浮细胞,用血球计数板计数,将结果代入下式:细胞个数/毫升原液=(四角大格中细胞数之和/4)×104,接着用RPM-1640完全培养基调整细胞的浓度,使GSC细胞的浓度达4×104个/mL,BEL细胞浓度达7×104个/毫升,SPCA细胞浓度达2×104个/毫升,K562细胞浓度达1×104个/毫升。
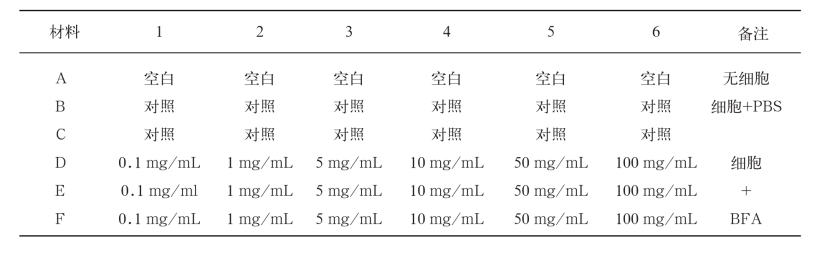
将调整好浓度的3种细胞分别加入到96孔细胞培养板B行到F行中,每孔180 μL,铺两行吹匀一次,A行每孔加200 μL RPM-1640培养液作为空白对照,分别置于37 ℃、CO2培养箱培养。
1.4.5 药品的溶解及稀释
用电子天平称量BFA 100 mg,在超净台内溶于1 mL的DMSO,用移液器混匀溶解后,将母液依次稀释为6个浓度:0.1 mg/mL、1 mg/mL、5 mg/ mL、10 mg/mL、50 mg/mL和100 mg/mL。将6个浓度的BFA药品分别依次加入到96孔细胞培养板的D、E、F行中;A行设置空白组(仅加入不含细胞的培养液),B、C两行是对照组(以培养液替代药物),然后置于37 ℃,5%CO2浓度培养箱中培养。各浓度BFA在96孔细胞培养板上的安排见表1。
表1 细胞板上各孔的浓度汇总
Tab.1 The concentration summary of each hole on the cell board
1.4.6 加MTT法[6]测吸光值(OD值)
加药44 h后,向3个细胞板中分别加入MTT,每孔50μL。4h后,将培养的3种细胞培养板中的液体倒掉。接着向其中加入DMSO,每孔150μL,震荡10分钟,使用酶标仪在570 nm波长下测定各孔OD值。
根据公式:抑制率(%)=[(对照组OD值-空白组OD值)-(实验组OD值-空白组OD值)]/(对照组OD值-空白组OD值)×100%[7],分别计算不同浓度的BFA对3种肿瘤细胞的抑制率。
各项实验均重复3次以上,用统计学软件SPSS处理:实验组与对照组间采用独立样本t检验法,以P<0.05为差异具有显著性意义。
2 结果与分析
2.1 BFA对3种肿瘤细胞的影响
实验过程中可以观察到BFA对3种肿瘤细胞有一定程度的影响,需进一步通过计算来探索。根据上述公式,分别计算不同浓度的BFA对3种肿瘤细胞的抑制率,绘制抑制率曲线,见图1~图3。同时依据吴舟锋[7]使用的判断药物是否是肿瘤细胞敏感型药物的标准(抑制率<50%为不敏感;50%~70%为中度敏感;>70%为高度敏感)进行判断。
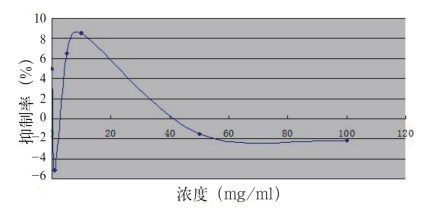
图1 生化黄腐酸对SPCA的影响
Fig1.The influence of biochemistry fulvic acid on SPCA
由图1可见,BFA对SPCA的抑制率在1 mg/ mL~10 mg/mL的范围内逐渐增加;至10 mg/ mL浓度时达到8.53%抑制率,接近最大抑制率(约8.85%,如图中所示),之后逐渐减少,在50 mg/ mL到100 mg/mL的浓度范围内趋于平稳。各浓度的BFA对SPCA细胞的抑制率远未达到50%。
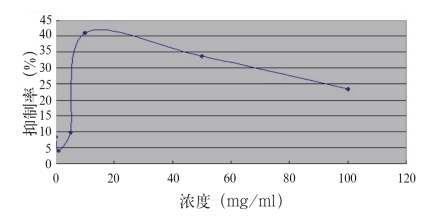
图2 生化黄腐酸对GSC的影响
Fig.2 The influence of biochemistry fulvic acid on GSC
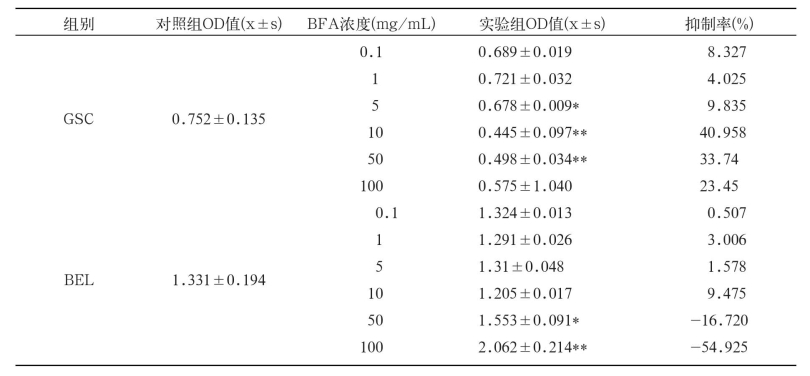
由图2可见,BFA对GSC的抑制率在1 mg/mL~10 mg/mL的浓度范围内逐渐增加;至10 mg/ mL浓度时达到40.96%抑制率,接近最大抑制率(约42.50%,如图中所示),之后逐渐减少,各浓度BFA对GSC细胞的抑制率均未达到50%。
由图3可知,BFA对BEL的抑制率在5 mg/ mL~10 mg/mL的浓度范围逐渐增大,至10 mg/ mL浓度时达到9.48%抑制率,接近最大抑制率(约9.90%,如图中所示),之后逐渐减少,各浓度BFA对BEL细胞的抑制率均未达到50%。
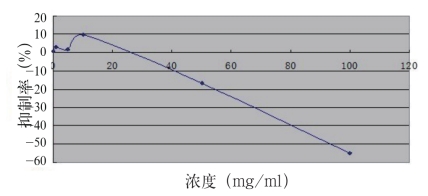
图3 生化黄腐酸对BEL的影响
Fig.3 The influence of biochemistry fulvic acid on BEL
2.2 BFA对3种肿瘤细胞抑制结果的分析
为进一步判断BFA对3种不同肿瘤细胞体外增值的抑制作用,根据上述OD值进行差异显著性分析[8](表2)。另外,计算出的抑制率也放入表2,用以对BFA的抑制作用进行辅助分析。可以看出,SPCA细胞组中6个浓度的实验组与对照组相比均没有显著差异(P<0.05);GSC细胞组中,3个浓度(5 mg/mL,10 mg/mL和50 mg/mL)的实验组与对照组相比有显著性差异(P<0.05)或极显著性差异(P<0.01),而BEL细胞组中,也有2个浓度(50 mg/mL和100 mg/mL)的实验组与对照组相比有显著性差异(P<0.05)或极显著性差异(P<0.01)。但是,这5个浓度的实验组对GSC和BEL细胞的抑制率都低于50%,表明BFA对这两种肿瘤细胞没有明显的抑制作用。
表2 BFA对3种不同肿瘤细胞的抑制作用(n=6)
Tab.2 Anti-proliferative activity of biochemistry fulvic acid on four tumor cells(n=6)
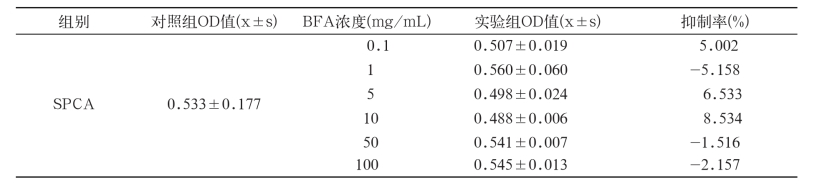
表2 续
注:*表示P<0.05,差异显著;**表示P<0.01,差异极显著。
3 讨论
本实验结果显示:BFA对GSC的抑制率,在10 mg/ml浓度时达到40.96%抑制率,其最大抑制率约42.50%(如图2所示),接近了50%的抑制率。统计学处理结果也表明:BFA对GSC的抑制率,其中有3个浓度(5 mg/mL,10 mg/mL和50 mg/ mL)的实验组与对照组相比有显著性差异。提示BFA对GSC的体外生长可能有一定的影响,但由于BFA的3个浓度的抑制率均小于50%,没有明显抑制肿瘤细胞增值的作用;而BFA对GSC和BEL两种肿瘤细胞抑制率更低,各6个浓度的抑制率均未达到10%。因此,认为BFA不是肿瘤细胞敏感型药物,对癌细胞本身没有直接的杀灭作用。
张覃沐等在研究黄腐酸对小鼠肿瘤细胞的影响时,发现黄腐酸在体内具有抗肿瘤作用,且口服比注射效果要好,认为黄腐酸可能是通过提高小鼠自身免疫系统的功能而发挥其抗肿瘤作用的,而不是直接抑制或杀灭肿瘤细胞。
本实验结果也显示:当BFA的浓度较高(>50 mg/mL)时,对SPCA和BEL细胞株的负面影响很小,如图1和图3所示:抑制率很低,甚至出现负值。推测:BFA具有一定的抑菌作用,本身又是一种营养添加剂,体外培养体系中,加入一定浓度的BFA,对肿瘤细胞的生长,可能有促进作用。
虽然本实验结果表明:BFA不是肿瘤细胞敏感型药物,对肿瘤细胞本身没有直接的杀灭作用。但由于BFA来源于天然,有毒副作用极小,长期使用不会产生抗药性的特点,因此,BFA应该可以作为肿瘤患者化疗时的辅助用药使用,以提高肿瘤患者的免役力。
致谢:
本论文在实验过程中得到了海南师范大学生命科学学院陈忠教授的指导和帮助,在此表示感谢!
参考文献
[1]顾琳娜,顾昊.天然抗肿瘤药物筛选方法的研究进展[J].药学导报,2009,28(4):496~498
[2]李红玉.生化黄腐酸在畜牧业中的应用[J].中国畜牧兽医,2006,33(2):18~19
[3]杨晓松,李良臣.生化黄腐酸对奶牛乳房炎和生产性能的影响[J].中国食草物,2008,28(2):31~33
[4]马庆凯,王 虹.黄腐酸钠灌肠治疗慢性非特异性结肠炎180例[J].中国冶金工业医学杂志,2002,19(5):285
[5]张覃沐,胡孟州,等.黄腐酸抗肿瘤作用的药理研究[J].河南医学院学报,1983,18(1):11~14
[6]司徒镇强.细胞培养[M].北京:世界图书出版社,2004
[7]吴舟锋.肿瘤化疗药物敏感性试验[J].国外医学:外科学分册,1988,25(3):153~155
[8]黄鸣清,蒋东旭.昆明山海棠抗肿瘤活性部位筛选研究[J].中国中药杂志,2009,34(20): 2633~2636
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。


















