第一节 大鼠心脏缺血-再灌注损伤
实验目的
(1)复制心脏缺血-再灌注损伤动物模型。
(2)观察再灌注过程中心功能的变化及再灌注性心律失常的表现。
实验对象及相关用品
1.实验对象
雄性健康SD大鼠(250~350g)。
2.实验相关用品
12%水合氯醛溶液、稀肝素(125U/mL),多功能生物信息采集仪(或多道生理记录仪),小动物人工呼吸机,心电图机,小动物常规手术器械,小拉钩,电烧灼器及其配件,气管插管,左心室导管(直径0.5~0.8mm的聚乙烯管),充气硅胶管(直径3mm、长2cm),小圆针,6-0号线。
实验分组
(1)假手术组。
(2)单纯缺血组。
(3)心脏缺血-再灌注组。
观测指标
(1)心电图。
(2)心功能指标:左室内压(LVP)、左室内压变化最大速率(±dp/dtmax)及左室舒张末期压(LVEDP)。
实验步骤
(1)动物称重后腹腔内注射12%水合氯醛(0.3~0.4mL/100g)麻醉,仰卧固定于小动物手术台上。
(2)剪去颈前及胸部手术部位被毛,作一长约2.5cm的颈前正中切口,分离气管并插入气管插管,接小动物人工呼吸机。
(3)分离右侧颈总动脉,结扎远心端,近心端用小动脉夹夹闭,在靠近结扎处剪口(朝向近心端成45°夹角剪开颈总动脉的1/3~1/2),插入左心室导管(预先充满稀肝素),用线轻扎固定后松开动脉夹,将导管缓慢插入左心室,双重结扎固定,并将导管另一端连接多功能生物信息采集仪(或多道生理记录仪)用于测定多项心功能指标,连接标准肢体Ⅱ导联记录心电图。
(4)在胸骨左侧旁约0.5cm处、第4肋间纵行切开皮肤与肌层,自切口处开胸后立即行呼气末正压呼吸,调整呼吸频率、吸呼比及潮气量(根据呼吸机使用指南及大鼠表现调节,参考值为呼吸频率60~70次/分,吸呼比1∶2,潮气量为0.4~0.5mL)。
(5)剪开心包暴露心脏,以左冠状静脉主干为标志(左冠状动脉主干和前降支始段大多与伴行静脉相伴行(静脉居左)或互相交叉),在左心耳根部下方2~3mm处进针,用6-0线从左冠状动脉的左侧进针,在穿过左冠状动脉下方的心肌表层后在肺动脉圆锥旁出针(图9-1),结扎后左室壁变苍白,并出现室壁运动减弱。将心脏放回原位,待心电图恢复稳定10min后描记正常心电图及LVP、LVEDP、±dp/dtmax等心功能指标。
注意:假手术组,仅在冠状动脉左前降支(LAD)下穿线;单纯缺血组除不松解结扎线外,其余均与缺血-再灌组相同。
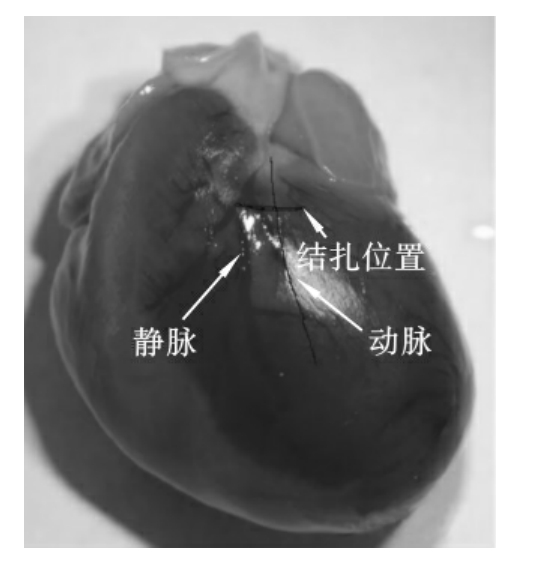
(6)结扎冠状动脉左前降支:静脉注入肝素100~200U,结扎时将充气硅胶管置于结扎线与血管之间,利用充气硅胶管的弹性压迫使冠状动脉闭塞5~10min。在冠状动脉闭塞期间,每隔2min记录一次心电图和心功能指标。
(7)剪开结扎线解除闭塞,移去硅胶管,恢复血液灌流,继续观察30~60min。记录解除结扎即刻及随后动态的心电图和心功能指标变化。
注意事项
(1)行左心室插管时要小心,防止出血,切勿刺破主动脉壁及心室壁;作冠状动脉穿线宜采用无创伤小圆缝合针,动作要轻,位置要准,且进针宜浅,否则易引起传导阻滞而导致动物死亡。
(2)有关潮气量的调整:①潮气量可以大鼠呼吸时胸廓的起伏程度作为参照,较麻醉状态下呼吸程度稍大即可;②观察大鼠心脏表面,左心室应该是鲜红色,如果暗红则应该加大潮气量;③如果潮气量过大,可以看到肺脏被气体撑得非常饱满,失去了原来的粉红色。
(3)严格掌握缺血时间,过长或过短均不易诱发再灌流性心律失常。
思考题
大鼠单纯心肌缺血与心肌缺血后再灌注有什么不同表现?为什么?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














