第五节 单相动作电位
单相动作电位(MAP)是心肌细胞群的局部电活动。1883年Rurdon-Sanderson等首先从蛙和乌龟心脏上记录到MAP。长期以来,记录MAP均采用吸附电极技术,其缺点是记录时间短,只有几分钟,并且易引起心肌细胞损伤、出血,且波形畸形、振幅下降,限制了其临床应用。Hoffman等在同一心脏上同时应用玻璃微电极记录到心肌细胞跨膜动作电位(TAP)和应用吸附电极记录MAP研究表明,MAP与TAP具有相同的形态和时程,能比较准确地反映心肌除极化过程和整个复极化时相,因此,是研究心肌复极化时相的可靠指标。1980年Frami和Miller等首次应用改进的特制导管,记录人和犬右心室心内膜的MAP,这种导管称为接触电极导管,容易而安全地记录心内膜MAP,其最大优点是同一部位可以长时间连续记录MAP,对局部心肌无损伤。由于这一技术的问世,MAP已广泛用于心血管病的基础理论和临床研究。

图64-7 银—氯化银泛极化电极的结构剖析图
二、MAP的形态和测量
图64-8为从右心室心内膜记录的MAP,其形态与使用玻璃微电极记录的心肌细胞TAP十分相似。典型的MAP包括除极化和复极化两个基本过程,并可将其分为0、1、2、3、4五个时相,平台期一般明显可见,尤其应指出的是,MAP在0时相常出现内部转折,常伴有较高的超射。
图64-8中数字0~4代表五个时相,MAP振幅定义为从平台期嵴部到达舒张期基线的垂直距离,MAPD90表示90%的MAP间期,它由复极化达到90%的一点到达MAP上升肢的水平距离,同样可测MAPD25、MAPD30、MAPD50、MAPD75。图中参考0电位是指心腔内图的等电位线,指接触电极插入心腔瓣膜,但尚未接触心内膜,非真正的0电位。有时根据需要亦测2、3两个时相的斜率及0时相最大上升速率(dv/dtMax)。
一、MAP记录技术
接触电极导管与普通电极导管不同,采用的双极导管为一常规单根尼龙心导管,内含2条直径为0.3~0.5mm银质或泛极化银—氯化银电极(图64-7),导管尖端镶进裸露的引导电极,尖端直径为1mm的光滑球面,直接与心内膜、心外膜接触。参考电极位于距尖端5mm的凹陷处,直径为0.5mm;导管全长为100~150cm。操作前将消毒好的电极置于0.9%生理盐水浸泡1小时,使短路以达到半电极电位的平衡,它可大大减少实验过程中直线偏移的发生,使整个实验中舒张期基线漂移至1mV以内。在无菌操作条件下,由外周静脉插管,在X线下将导管置于右心或左心,导管外端接一输入阻抗为10Ω的前置放大器,其频响范围为DC-100kHz,并将其输入生理记录仪。
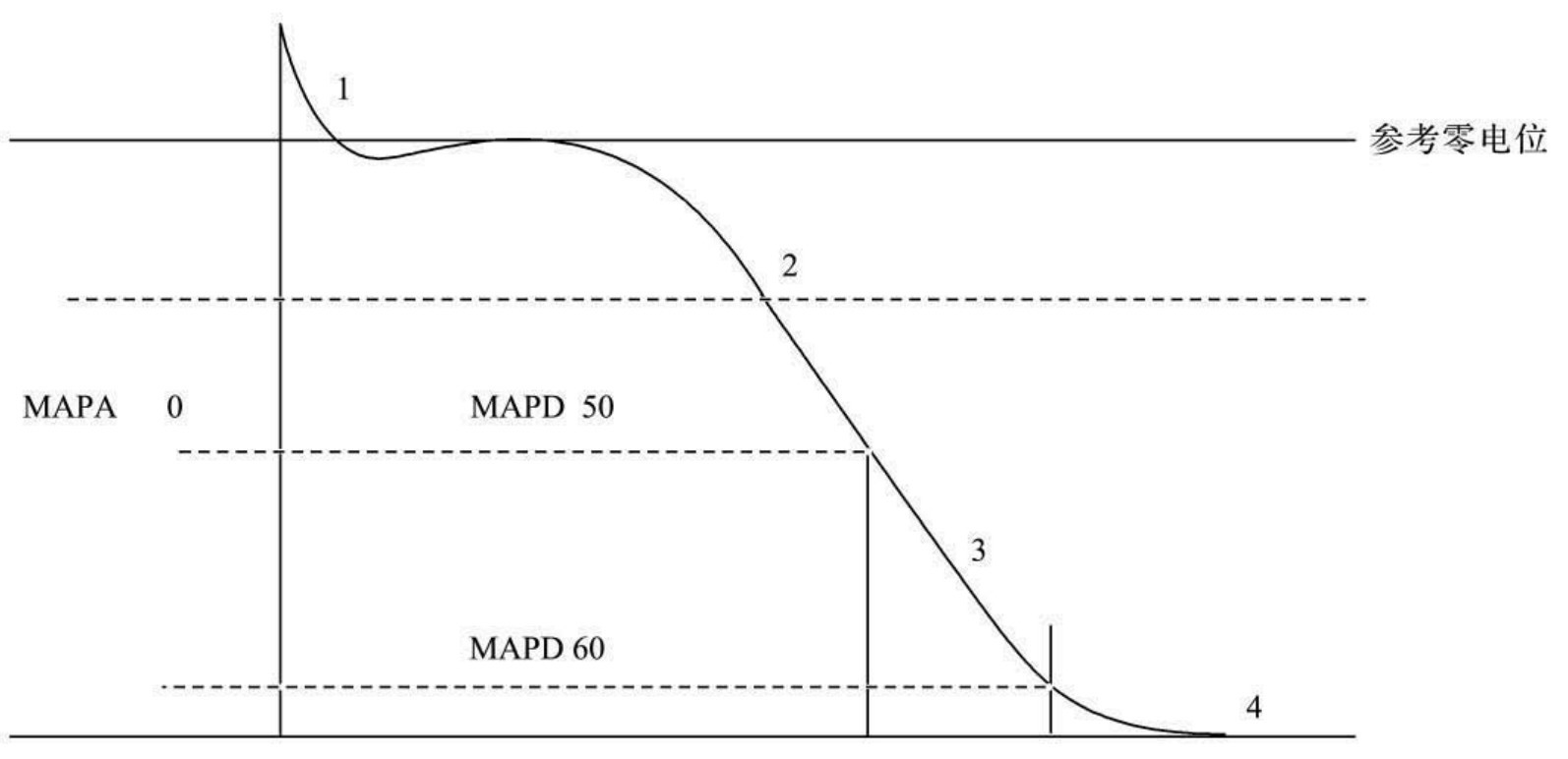
图64-8 右心室心内膜记录的MAP
三、MAP形成机制
目前,尚无实验证据精确地阐明MAP的机制。Franz等认为,在静息情况下,心肌细胞膜外为正,膜内为负,当接触电极顶端接触心肌细胞时,一定的压力使电极接触部位的心肌细胞群产生除极化,即膜电位降低,处于部分除极化状态的电极接触部位与正常静息电位之间的电位差而引起局部电流,这时电极部位呈负电位变化,而心肌细胞除极化时,细胞外呈负电位,两者产生的电流使心肌细胞除极化以及超射,邻近心肌复极化则相反,从而形成MAP的0~4五个时相。另外,除极化细胞的数量和所包含的启动电流的大小,接触电极下边缘细胞电紧张偶联的程度以及记录周围细胞内外之间电位变化的导管,都可影响MAP的振幅。
另一支持这一理论的证据是,缺血和高血钾时所记录到的MAP振幅的降低是由于舒张期电位和收缩期电位降低的结果。而在心肌坏死后瘢痕区域记录不到MAP,此外,长达30min记录也未见局部心内膜有损伤的迹象。尽管如此,Levine等认为MAP的产生是损伤电流所致,即接触电极导管下心肌细胞损伤所致部位的除极化与邻近心肌形成电位差。
心内膜含有丰富的浦肯野纤维,有人推测记录到的MAP可能是心肌细胞和浦肯野纤维两者的相互作用,但MAP的心肌周期依赖性变化,提示MAP
可能主要是由于普通心肌细胞电活动所致。
四、心率、心律及电解质对MAP的影响
MAP与TAP相比,MAP的振幅较低,人左、右心室内膜的MAP振幅为15~40mV,仅为TAP平均值的1/7左右;且心内膜多个部位的MAP间期不同,最大相差达60ms。因此,在长时间记录时应固定于同一部位,MAP与TAP相同,受诸多因素的影响,如心率、心律及电解质。
MAP间期随心率的改变而变化,随着自发频率或刺激的增加,MAP间期呈线性增加,但当心动周期增至1000ms,MAP间期便不再随心动周期的增加而增加。
MAP形态与心律亦有明显关系。期前收缩时2时相明显缩短,3时相坡度增加;室性心动过速与心室颤动时,二者的MAP完全不同,心室颤动时MAP极不规则,间期极短,无舒张期间期,室性心动过速时MAP间期虽短,但MAP仍然规则,且呈单形性。
电解质紊乱,如高钾、低钾、低钙等都可影响到MAP。例如,高钾时MAP振幅降低,间期缩短;静脉注射钙剂同样使MAP的2时相缩短。
五、MAP在评价局部心肌供血状态中的价值
MAP是反映局部心肌缺血的敏感指标。Franz等的动物实验研究表明,结扎犬左前降支,心内膜及心外膜的MAP改变表现为:MAP振幅降低;MAP的2时相平台期逐渐消失;0时相最大上升速度(Vmax)减慢;局部传导时间延长。8条实验性心肌梗死犬同时记录MAP与体表心电图,结果发现体表心电图的变化是一个很不精确的评价梗死面积的指标,且随时间而变化;而MAP能确定缺血区与正常心肌的界限,更精确地评估缺血区的范围,并能观察心肌再灌注后心肌局部MAP的变化。
Taggart等在冠状动脉旁路手术的患者中,采用手持压力接触电极测定MAP的参数,比较旁路充分灌流时和钳闭阻断90s时,血流灌注部位的心外膜MAP,发现MAP振幅和间期均有明显差别(P<0.005)。故认为MAP是冠状动脉搭桥时反映局部心肌缺血状态的高度敏感指标,方法简易、快速、无创伤,整个研究在4分钟内完成,很有实用价值,可望用于急性心肌梗死溶栓后心肌存活性的评估。
Donaldon等在7例冠心病患者行心房调搏发生心绞痛的研究中发现,冠状动脉内注射硝酸甘油0.1mg后,MAP并无改变;而静脉内注射硝酸甘油0.2~0.3mg,尽管激发心绞痛的起搏频率不变,但MAP振幅和时限随动脉血压的下降而改变,进一步证实了硝酸甘油对冠心病心绞痛的治疗作用主要在于扩张周围动脉和静脉。
六、MAP在评价抗心律失常药物中的价值
抗心律失常药物的抗心律失常作用主要是由于:①减慢自发性舒张期除极速率而降低自律性;②影响心肌细胞膜的反应性而改变传导,改变有效不应期(ERP)或动作电位时程(APD),使心肌细胞ERP更趋均一性,从而消除折返。由于MAP能准确地反映心肌的复极,因此,在评价抗心律失常药物中得到广泛的应用。
Echt等采用吸附电极研究发现,静脉注射Sotalol能明显延长MAP间期,与TAP相符,证明Sotalol的抗心律失常作用主要是延长复极所致。Platia等采用接触电极记录右心室MAP,发现奎尼丁、普鲁卡因酰胺能延长MAP,且与血药浓度相关性良好,可作为抗心律失常药物治疗的一种直接、定量性指标。最近Franz等又发明一种新的电极,即同时起搏和记录MAP的接触电极,在对6条犬及3例患者的研究中,发现奎尼丁能明显延长ERP/APD比值,即明显延长心肌的ERP。这使离体研究结果在整体上得到进一步论证。
最近研究劳卡胺(Lorcainide)2mg/kg静脉注射对心肌MAP的影响,结果发现劳卡胺明显缩短MAPD50、MAPD90,而使ERP/MAP比值增大。
七、MAP是研究心肌复极离散度的可靠方法
先天性长Q-T间期综合征常伴有猝死;心肌梗死后Q-T延长者发生心脏性猝死的危险性增高。最近大量临床和实验研究表明,延长心肌复极具有抗心律失常及致心律失常双重作用,因此,研究药物对复极的作用,可以指导治疗及预防其不良反应。临床上可用体表心电图的Q-Tc反映心肌复极,Q-Tc包含了心室肌最早动作电位到最迟的复极时间,但实际上不可能代表整个心室肌从开始激动到复极的时间总和。因为最后相对较小区域的心肌复极电流较小,往往不能在心电图上反映出来,而MAP接触电极能多部位记录,故能准确反映心肌的复极过程,因此,用MAP研究心肌复极较Q-Tc间期更可靠。
心肌复极离散度是指心肌复极过程中,各部位复极不均一性的程度。Bonatt等在人体研究发现,测量正常人和患者的右心室心尖部心内膜、流出道、间隔部及膈面四个部位的MAP间期,发现最长的MAP和最短的MAP相差在窦性心律时为0~4ms,心室率100次/min起搏时为0~35ms;另一组8例患者有心室复极延长不伴有室性心律失常,窦性心律时MAP相差为40~60ms,心室率100次/min起搏时,最长MAP缩短明显,MAP差反而减少;第三组10例Q-T间期延长伴有严重室性心律失常,其中1例为胺碘酮中毒,1例为心可定中毒。MAP相差100~270ms。Franz等在7例有左心室肥厚及心电图出现T波倒置的主动脉瓣病变患者中,在多部位记录MAP,发现MAP及局部复极时间有明显差异,说明肥厚心肌可增加心肌复极离散度。
Kingaby等在犬缺血标本中发现,发生心室颤动时,缺血区的激动延迟在40min内无改变或很少改变,MAP相差>100ms;在未发生心室颤动者,缺血区激动延迟逐渐缩短,MAP相差≤40ms,至≤5ms。认为MAP差异和激动差异对心室颤动发生起着主要作用。Amlie和Kuo等在动物模型上通过MAP技术研究表明,心房起搏时,心室表面的复极离散度主要是由于MAP间期变异而致;心室起搏时,复极离散度主要由于激动时间差异导致,并且在心房起搏伴有心室过早激动时,最大复极离散度比固定心室起搏时>25%,主要是起搏部位的MAP缩短;在另一类似动物模型中,在有较大复极离散度情况下,短MAP间期部位过早刺激,为传导延缓的发生、诱发持续性心律失常提供了条件。以上事实说明在研究复极离散度时,MAP为探讨心律失常的发生机制和药物治疗又提供了重要信息。
八、MAP在研究触发活动中的重要性
触发性心律失常以冲动起源异常为特征,近年来受到普遍重视。以往研究工作主要在离体标本上进行,整体标本上并没有得到公认。近年来,采用接触电极导管记录人或动物的心内膜、心外膜MAP的技术已经问世,为在整体上研究触发活动提供了可能性。
触发活动包括心肌细胞的后电位及其可能触发的心律失常,分为早期后除极(EAD)、延迟后除极(DAD)和早期后超极化(EAH)。Levine等最早在犬心内膜和心外膜标本上同时记录MAP和TAP。在氯化钡诱导的EAD试验中,TAP和MAP均能记录到EAD。在心内膜标本中,用乙酰毒毛旋花子甙元诱导DAD,TAP和MAP能同时记录DAD,证明MAP能记录离体EAD和DAD。国内解氏在在体心脏上同时用接触电极记录心外膜MAP和用漂浮微电极记录TAP,两者均能记录到EAD和DAD,并记录到其触发的室性心律失常,说明MAP能记录EAD和DAD,在体研究EAD和DAD是可行的方法。
目前MAP研究触发性心律失常仅限于动物实验,未见在临床上应用。Levine等最早用乙酰毒毛旋花子甙元(50~75mg/kg)诱发犬左心室内膜DAD,并触发室性期前收缩,随频率增加,期前收缩也增多,随后用氯化铯诱发EAD,8只犬出现室性心律失常,3只犬最终发展为尖端扭转型室性心动过速。Brachman等亦用同样方法诱发EAD及尖端扭转型室性心动过速。以上实验有以下几点支持后电位与室性心律失常相关:①室性心律失常发生于后电位后;②室性期前收缩的启动电位与后电位振幅密切相关;③后电位与室性期前收缩的配对间期是完全一致的;④后电位与室性心律失常在超速驱动时或一定时间内同时被消除;⑤静脉注射维拉帕米,DAD和室性期前收缩同时消除。提示这种室性心律失常由触发活动所致。
Hanich等和Priori等在整体动物研究中发现,左侧星状神经节刺激可增加EAD,并能使低剂量氯化铯诱发EAD,更有趣的是β受体阻断剂可防止室性心律失常发生,对EAD影响较小。
由于临床上未能证实EAD与DAD,探讨研究后电位不仅能进一步了解其发生机制,而且能指导药物治疗。
九、MAP在收缩—兴奋反馈中的应用
收缩—兴奋反馈(CEF)是指机械状态的变化,可以影响心肌的复极过程。离体实验已经证明,增加心肌张力可导致动作电位时间缩短及诱发后电位。Levine等在肺动脉狭窄成形术研究中发现,在球囊阻断右心室流出道时MAP时限明显缩短;肺动脉狭窄缓解后,MAP延长;并且在11例中7例有后电位产生并伴有室性期前收缩。Taggart等在体外循环研究中亦得到类似结果。
急性心肌梗死导致的局限性室壁运动障碍或矛盾运动,是否通过CEF机制引起心肌复极离散度的增加,进而诱发室性心律失常,还待进一步研究。
MAP记录作为一门新技术,已广泛用于心脏病的研究,在心肌缺血—再灌注、心律失常机制的探讨、抗心律失常药物的作用及致心律失常作用、收缩—兴奋反馈等方面,有着广阔的应用前景。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















