鉴于创面愈合在烧伤治疗中的重要作用,多年来烧伤学者一直致力于促进烧伤创面愈合的研究,许多药物制剂和方法在动物实验中都被发现可以促进创面愈合,然而能通过临床试验的却很有限。事实上,大多数创面都可以按照一定的进程和合理的速度愈合,并不需要药物或其他方法促进其愈合,只有感染、营养不良、糖尿病、细胞毒性治疗、大面积深度烧伤等愈合不良患者的创面才需要采用特殊的方法加速愈合。由于促进创面愈合的许多治疗方法,如营养治疗(特殊氨基酸、维生素)、高压氧治疗、创面处理等在本书其他章节都已有涉及,本节仅对生长因子、负压创面疗法、间充质干细胞治疗等方法作一概述。
一、生长因子在创面愈合中的作用
生长因子可以通过趋化作用、促细胞分裂、刺激血管生长和细胞外基质的生成及降解等机制促进创面的愈合。目前已知涉及创面修复的生长因子有PDGF、FGF、TGF-β、EGF和IGF等5个家族。
1.生长因子在创面中的表达 明确创面生长因子表达的规律将有助于理解正常愈合过程的规律。根据生长因子表达和反应的改变可以解释特殊创面难以愈合的原因,而从找到相应的治疗方案,也可以应用生长因子控制增生性瘢痕的形成。通过收集创面引流液、收集中厚皮片下和慢性溃疡积液以及皮下层放置带孔多聚四氟乙烯小包等研究伤口中生长因子的表达,发现创面液中PDGF、TGF-α、TGF-β和IGF含量显著升高,而有的学者仅发现EGF和bFGF增多。事实上,创面分泌物还不能完全反映创面愈合的真实情况。还有很多研究对创面组织细胞生长因子的基因表达水平进行了检测,发现急性创伤可诱导受伤上皮组织细胞中编码活性生长因子PDGF、TGF-β、FGF、IGF、IL-6、EGF等基因表达水平升高,创面愈合后,这些基因表达又受到抑制。当生长因子合成和分解达到平衡后,蛋白酶活性的增高参与了生长因子的降解,因此,许多研究还对降解细胞因子的蛋白酶含量进行了检测。Bermett等发现乳房切除术后引流液中蛋白酶含量较低,这些伤口愈合不成问题;而慢性不愈合溃疡中的基质金属蛋白酶(MMPs)水平升高,后者可以破坏胶原等细胞外基质蛋白。
另外,还有一些实验研究探讨难愈合创面中生长因子的机制,如愈合缓慢的糖尿病人创面中KGF、IGF-2和VEGF表达延迟。用多柔比星处理过的动物也见TGF-β1降低。利用定向破坏产生生长因子的基因技术进行研究发现,缺乏产生TGF-β1能力的小鼠均死于过度的炎症反应,这表明TGF-β1对炎症有很重要的调节作用。然而,这些动物在发生过度炎性反应之前伤口愈合良好,同时其他生长因子,如TGF-β2、PDGFAA、PDGF-BB和炎性细胞因子也见增加,这一发现说明若缺乏单一的细胞因子,组织仍可以正常修复。
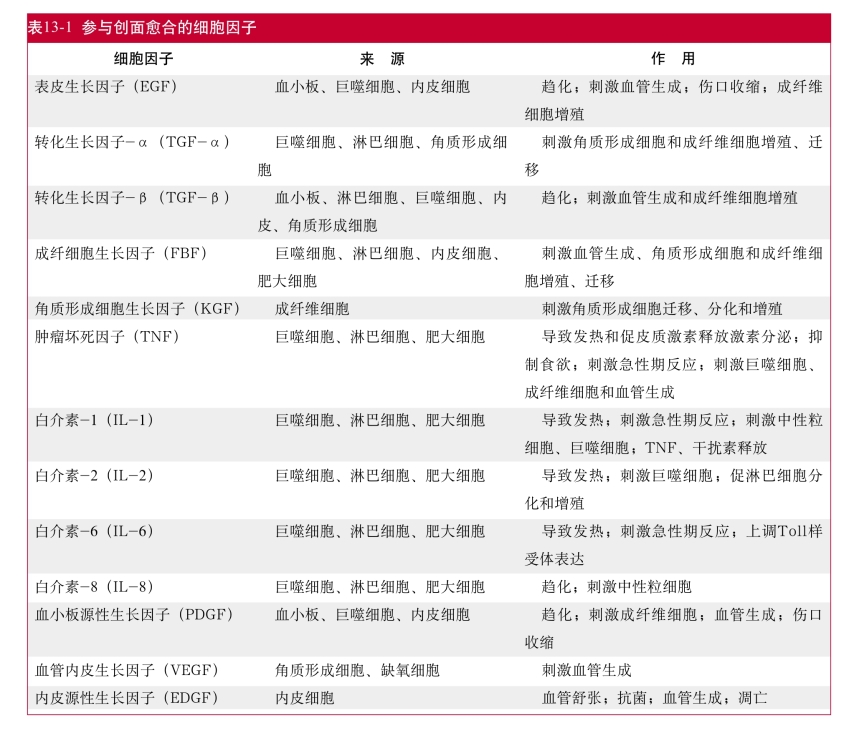
2.生长因子在创面愈合中的作用 生长因子可以促进几乎各种伤口的愈合,各种参与创面愈合的细胞因子来源及作用,见表13-1。大多数研究都集中探讨了生长因子在愈合受损的创面中的作用,发现生长因子可以加速糖尿病、营养不良、感染及使用类固醇、化疗药物及放射治疗等难愈合创面的愈合,其机制尚未完全明确,但与炎性细胞增生和“炎性相”有关,生长因子可发挥局部刺激细胞增生和对抗细胞毒素药物的抑制作用。另外,生长因子联合应用比单一生长因子能更有效地促进创面愈合。体外研究发现一个细胞进入细胞分裂周期需要一种以上的生长因子,例如单独使用PDGF、FGF或IGF-1处理的静止细胞不能进入分裂周期,而在IGF-1处理后再用PDGF或FGF则可出现细胞增生。Lynch等发现PDGF和IGF-1在不同的组织修复模型上具有协同作用。Hennessey等发现把胰岛素加入EGF中时也有相加作用。联合应用生长因子的另一个理论基础是伤口愈合涉及不同类型的细胞。应用PDGF刺激成纤维细胞增生,附加TGF-α则可刺激表皮细胞生长,其促进愈合的作用较单一生长因子强。生长因子也可与正常结合和调节其作用的蛋白联合应用,将IGF-1加入其结合蛋白(IGFBP-1)中可进一步加速组织修复。生长因子结合其他的治疗方法对促进组织修复也有意义,如Mustoe等报道用生长因子与高压氧联合治疗缺氧性创面有促进愈合的作用。
在实验研究的基础上,生长因子已在临床上用于加速各种创面组织的修复。解放军总医院第一附属医院杨红明等分别比较了从1982年1月到1999年12月期间1563例烧伤面积<10%的深 Ⅱ度烧伤患者,分别应用生长因子、Zn和胶原酶治疗的不同效果。1991年以前,由于无特殊的创面用药,深Ⅱ度创面愈合时间为(23.8±3.5)d;从1991年到1996年,随着局部使用SD-Ag-Zn,愈合时间为(20.6±3.2)d;从1997年到1999年,由于bFGF、EGF以及胶原酶结合SD-Ag-Zn的使用,创面的愈合时间缩短至(16.2±2.8)d,与以往相比有显著差异,而与单独使用SDAg-Zn相比,应用生长因子创面的愈合时间也明显缩短,也使后期整形的压力大大降低。付小兵等组织国内32家医院对bFGF促进创面愈合的作用进行了多中心临床试验,发现bFGF能显著加速肉芽组织的形成和创面再上皮化,即重组bFGF加速烧伤、供皮区创面的愈合。与对照组相比,浅Ⅱ度和深Ⅱ度烧伤创面的愈合时间分别为(9.9±2.5)d和(17.0±4.6)d,较对照组的(12.5±2.7)d和(21.2±4.9)d明显缩短;供皮区的愈合时间为(10.7±4.6)d,同样短于对照组(14.7±6.5)d,病理结果证实bFGF促进愈合的一方面显著增加了肉芽组织中毛细血管数量,同时再上皮化的表皮细胞增殖速度也较对照明显加速。其他的试验也证实,局部应用bFGF可缩短愈合时间3~4d,且改善愈合质量,减少住院日,减轻患者负担,而且长期的随访结果也未发现不良反应和毒副作用。对EGF促进创面愈合的作用,Brown等首先研究发现EGF对促进烧伤供皮区创面的愈合有重要作用,他们发现局部应用EGF可使中厚皮片供皮区愈合时间缩短大约1d。国内对此也进行了多中心临床试验,发现对浅Ⅱ度、深Ⅱ度、刃厚供皮区、中厚供皮区等急性创面愈合时间较对照组有明显缩短,中期愈合率明显提高,其综合有效率分别达90.3%、94.9%、96.1%和81.8%,无不良反应。其他的临床试验也得出了相似的结果。国外的临床试验结果表明,重组人PDGF-BB对促进糖尿病慢性溃疡有显著疗效,其伤口愈合率大约是对照组的2倍。同时,PDGF-BB也是唯一被美国食品药品管理局(FDA)批准用于临床的生长因子,主要用于慢性创面、压疮、糖尿病足等难愈合创面。其他细胞因子,如粒细胞-巨噬细胞集落刺激因子(GM-CSF)也被发现对促进创面愈合有利,Hu等通过荟萃分析发现,局部应用重组人GM-CSF可促进深Ⅱ度烧伤创面、慢性下肢溃疡、麻风病溃疡等创面的愈合;对其他慢性溃疡,如压疮、癌性溃疡等也可能有积极作用,但临床证据尚不足;对正常伤口愈合,如外科手术切口则无促愈合作用。
由于局部应用生长因子存在半衰期短、大剂量毒性反应和应用硅胶、乳剂等载体后生物利用度低等缺点限制其疗效和广泛应用,所以很多学者通过基因治疗的方法将编码促进创面愈合的生长因子基因导入体内外组织和细胞并使其稳定表达,它可克服局部应用生长因子的不足,使生长因子持续稳定释放,最大限度提高其生物利用度,又可降低其大剂量的毒性反应。大量的实验研究表明,将生长因子基因通过不同载体导入创面组织可以在动物模型上促进组织修复。然而,在临床试验中基因治疗用于人体疾病治疗时存在导致重大并发症的可能性。在一项研究中,2名小儿在采用反转录病毒转染他们的造血干细胞后出现淋巴组织增生异常;另1例18岁的病人采用基因治疗鸟氨酸氨甲酰基转移酶缺乏症发生全身系统性炎症反应综合征,最终发展为多器官功能衰竭而死亡。因此,通过基因治疗促进创面愈合的安全性仍有待进一步研究。
3.临床应用生长因子的原则 在实验研究的基础上,生长因子已用于临床上加速各种组织的修复,但应注意其特异性,不宜随意应用。生长因子的价格较贵,要注意掌握其适应证。生长因子不宜用于促进烧伤肉芽组织生长,因为可导致过度增生性瘢痕的形成。合理应用生长因子的原则包括:①生长因子促进组织修复的程度应明显,且有临床意义,如用于糖尿病、感染、营养不良或应用类固醇、放疗、化疗后创面愈合困难的患者;②生长因子促创面愈合的作用不应引起过度愈合或瘢痕形成;③应用生长因子的危险性应控制在最低限度;④生长因子只能在创面局部起作用;⑤生长因子的应用应有经济效益;⑥生长因子的应用应尽量简易实用。
目前生长因子的临床应用研究主要集中于中厚皮片供皮区、难愈性慢性皮肤溃疡(包括压疮、糖尿病溃疡、静脉淤滞性溃疡和其他类型的慢性创口)、急性烧伤创面等。
二、负压创面疗法
负压创面疗法(negative pressure wound therapy,NPWT),又称为封闭负压引流技术(vaccum sealing drainage,VSD),是一种通过使创面处于低于大气压状态,从而促进创面愈合的新颖且日趋完善的治疗方法。1993年德国外科医师Fleischmann等最先提出封闭负压引流,并用于四肢感染性创面的治疗,取得了明显效果。经过十余年的发展NPWT已成为外科创面治疗中越来越重要的一项治疗方法。采用该方法进行研究的报道越来越多,其适应证也逐渐扩大。
1.负压创面疗法的作用机制 其作用机制包括:①封闭使创面与外界隔绝,有效防止污染和交叉感染;②高负压可以持续引流创面渗出液、坏死组织和细菌等,创面能很快获得清洁的环境;③增加创面血供,改善创面微循环,促进肉芽组织生长;④减轻创周水肿、降低血管通透性;⑤封闭负压形成潮湿、缺氧、微酸环境,抑制创面病原微生物的生长,促进成纤维细胞的生长及刺激血管增生,使肉芽组织更快生长;⑥刺激多种相关细胞因子和酶类的基因表达和释放,促进创面再上皮化。
2.负压创面疗法对深Ⅱ度烧伤创面的治疗作用 NPWT对于烧伤创面治疗作用的研究是近几年才开始出现的。Morykwas最早将封闭负压疗法用于烧伤创面的治疗,猪烧伤后12h内应用-125mmHg负压治疗,与对照组相比炎症反应与皮肤死亡细胞均明显减轻。作者认为,负压治疗应持续至少6h以上才可起到减轻细胞死亡的作用,并且认为负压治疗需在伤后12h内应用。我国乔骋等研究表明,应用-90~-120mmHg负压治疗烧伤猪深Ⅱ度创面,提高了组织细胞的增殖活性,加速了创面的愈合。最早用负压创面治疗人烧伤创面的病例报道见于2005年,Molnar报道了1例患者被高压电烧伤右上肢和面部。由3位资深的烧伤科专科医师判断右手及右前臂创面深,需手术植皮治疗。伤后6h在右手与右前臂创面使用负压创面治疗40h,之后用磺胺嘧啶银(SDAg)等药物常规换药,右上肢未经手术创面愈合良好。出院后随访4周外观和功能恢复满意,与对照创面相比充血等表现更轻。作者认为取得满意效果的原因可能主要与以下三点有关:一是去除了创面的炎性介质如自由基、细胞因子;二是减轻了水肿,加速了创面愈合;三是负压封闭治疗给创面提供了理想的修复环境,使创面处于湿润的环境,从而防止创面脱水。Kamolz报道了一组双手烧伤的病人,将烧伤较重的一只手在伤后6h内进行负压创面治疗,另一只手以SD-Ag等常规治疗作为对照,负压创面治疗创面血流灌注好,渗出液引流充分,水肿明显减轻。Haslik等对11例双手烧伤的患者进行自身对照研究,负压创面治疗组在伤后6h内进行治疗,治疗时间不少于48h,通过荧光显色追踪观察发现,封闭负压治疗使微循环明显改善,水肿明显减轻,从而使愈合时间缩短,并发症减少,部分病例通过此项治疗避免了可能需要的手术治疗。由于目前国外认为组织淤滞区常在伤后48h内出现血流渐进性淤滞加重,造成创面的进一步加深,因此,国外封闭负压治疗均在伤后6~12h内开始,而超过伤后48h则认为封闭负压治疗无效。而解放军总医院第一附属医院的临床研究发现,在伤后48h以后使用封闭负压引流治疗也取得了较好的治疗效果,如典型病例(图13-1,图13-2):患者男,24岁,工人,右上肢被热碳灰烧伤后1d入院。查体可见右上肢创面腐皮大部分已脱落,创基渗出少,苍白色坏死组织附着。于伤后2d行NPWT 治疗,压力-125mm Hg,治疗6d(伤后8d),更换敷料,见创面坏死组织已全部脱落,其下创面清洁、湿润,部分创面已上皮化。之后采用磺胺嘧啶银隔日更换敷料,于伤后16d创面完全愈合。我们认为创面负压疗法对延迟治疗的深Ⅱ度烧伤创面有效的原因可能有以下几点:①清除创面坏死组织。我们在临床应用中观察到,尽管深Ⅱ度创面附着有一层坏死组织,当封闭负压治疗后,往往看到的组织均较新鲜,坏死组织被清除;当坏死组织较厚、呈痂皮状时,经封闭负压治疗后痂皮则极易取下,利于清除坏死组织。而坏死组织是引起创面过度炎症,加深创面的重要原因之一,因此,清除创面坏死组织可能是封闭负压治疗延迟的深Ⅱ度创面有效的最主要原因。②清除创面细菌及炎性介质,可以减轻创面的感染及炎症反应。③减轻创面的水肿。在我国深Ⅱ度烧伤患者往往不能在伤后及时就医,如果封闭负压疗法如对深Ⅱ度创面超过48h患者的治疗效果仍然显著,那么封闭负压疗法对于深Ⅱ度创面的治疗将具有更广阔的临床应用前景。
然而,循证医学综合了目前该方面的各项研究认为,虽然NPWT可能对深Ⅱ度烧伤创面的治疗效果显著优于常规治疗方法,但目前的研究由于种种不足如实验设计等方面原因,难以充分说明其有效性,仍需进一步的高质量的研究加以证实;目前对于负压创面疗法多项参数如使用时机、负压力的大小、海绵孔径等仍未有最优化的选择,仍需进一步研究加以明确;封闭负压治疗的机制目前尚未阐明。因此,研究NPWT对于深Ⅱ度烧伤创面的治疗作用及其机制将有助于探寻更好的方法来促进烧伤创面的愈合,预防与减轻瘢痕的产生,改善患者的预后,甚至可能会带来烧伤创面治疗方法上的一场革命。
三、间充质干细胞治疗

图13-1 上臂深Ⅱ度烧伤伤后2d(负压创面治疗前)
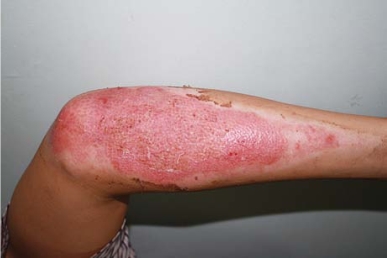
图13-2 负压创面治疗后于伤后16d创面愈合
目前用于创面治疗的干细胞包括胚胎干细胞(embryonic stem cells,ESCs)、诱导多向分化潜能干细胞(induced pluripotent stem cells,iPSCs)和成体干细胞。ESCs和iPSCs具有自我复制和多向分化潜能,因而可产生强大的治疗作用,但由于细胞调节、伦理学以及遗传调控等问题的存在限制了其实际应用。相反,成体干细胞由于其天然免疫耐受、不存在伦理学问题,因而具有非常广阔的应用前景。干细胞家族的重要成员——间充质干细胞(mesenchymal stem cells,MSCs)就是这种成体干细胞的代表。MSCs因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而日益受到人们的关注,如MSCs在体内或体外特定的诱导条件下,可以分化为脂肪、骨、软骨、肌肉、肌腱、韧带、神经、肝、心肌、内皮等多种组织细胞。连续传代培养和冷冻保存后仍具有多向分化潜能,可作为理想的治疗细胞用于衰老和病变引起的组织器官损伤修复。
目前,MSC已被广泛用于治疗神经退行性病变、充血性心力衰竭、血液病、糖尿病、系统性红斑狼疮等疾病。近年来,对MSCs治疗烧烫伤创面、慢性溃疡等难愈合创面进行了广泛的实验研究,并已逐步开展临床应用研究。
(一)间充质干细胞的生物学特性和功能
骨髓基质是MSCs的主要来源,尽管它只占骨髓细胞群的0.01%~0.001%。除骨髓之外,MSCs也可来源于人体的其他组织,包括脂肪组织、脐带血/Wharton胶、绒毛膜的绒毛、羊水、外周血、胎儿肝脏及肺脏,甚至脱落的牙齿。新生儿MSCs数量最多,随着年龄增长,其数量逐渐减少,到80岁时其寿命会下降一半。
根据国际细胞疗法间充质与组织干细胞委员会(the Mesenchymal and Tissue Stem Cell Committee of the International Society for Cellular Therapy)制定的最低标准,MSCs需满足以下条件:①MSCs在标准培养条件下呈贴壁生长;②MSCs表达CD105、CD73和CD90,不表达CD45、CD34、CD14或CD11b、CD79a或CD19和HLA2DR;③MSCs在体外至少能向成骨细胞、脂肪细胞和软骨细胞分化。
从细胞形态学、生理学和表面抗原的表达而言,人的MSCs是由混杂的细胞群组成,它们的性质和功能取决于局部微环境特征。研究表明,MSCs克隆包含多达3种类型的细胞,其中小的快速自我更新的细胞被认为是最早的前体细胞,具多向分化潜能。对该类细胞检测发现,它们直径约7μm,细胞核浆比值高,可通过细胞表面特定标志和表达不同的蛋白(血管内皮生长因子受体-2、酷氨酸激酶受体、转铁蛋白受体和膜联蛋白Ⅱ)而与其他成熟细胞区分。
MSCs在骨髓微环境中发挥重要作用,其中最主要的作用是它们可通过分泌大量的细胞外基质蛋白,包括纤维连结蛋白、层粘连蛋白、胶原及蛋白聚糖等来产生组织框架,这可对造血干细胞系统起到机械支持的作用。而且,MSCs还可分泌生长因子、趋化因子和细胞因子,从而参与造血系统的调节。如MSCs可产生基质衍生因子-1(stromal derived factor-1,SDF-1)、粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage colony-stimulating factor,GM-SCF)、干细胞因子(stem cell factor,SCF)、白介素-6(IL-6)等细胞因子使造血干细胞归巢、增殖和分化。此外,MSCs还具有免疫抑制功能。已经明确,各种组织来源的MSCs可通过抑制T淋巴细胞反应而产生广泛的免疫抑制作用。这种免疫抑制似乎不具有抗原特异性,既针对初次T细胞反应,也针对二次T细胞反应,主要是抑制T细胞增殖,而非促其凋亡,因而是一个可逆的过程。
(二)间充质干细胞治疗对创面愈合的促进作用
长期以来,已知正常皮肤中包含有骨髓来源的细胞,然而近年来人们才发现,它们不仅参与宿主防御和炎症反应,还可分化为皮肤角质形成细胞和成纤维细胞样细胞。当组织受损时,骨髓来源的干细胞/前体细胞可以迁移到受损局部,参与组织的修复重建。通过采用绿色荧光蛋白(GFP)标记骨髓干细胞,采用嵌合体小鼠模型的研究结果表明,正常皮肤中约有8.7%的成纤维细胞样细胞来源于骨髓干细胞,而在创面局部其比例可高达32.2%,纤维化病灶则高达59.7%,而且这些细胞半数以上不表达CD45,说明它们并非来源于造血系干细胞,不是炎性细胞。另外,人的正常皮肤中Ⅰ型胶原为胶原的主要形式,而在创面愈合早期Ⅲ型胶原的表达显著增加,说明Ⅲ型胶原对创面愈合具有重要作用。研究表明,Ⅲ型胶原为MSCs所产生,而非真皮内成纤维细胞所产生,提示MSCs在创面愈合中具有不可替代的作用。这些研究加深了我们对骨髓来源的MSCs在皮肤生理和病理学中作用的认识,为研究皮肤内环境稳定和创面愈合提供了一个新的思路,提示干细胞治疗对皮肤缺损,如慢性创面和烧伤创面等,可能具有广阔的应用前景。
大量的动物实验和临床试验结果表明,MSCs治疗可促进急性和慢性创面愈合、减轻炎症反应、改善创面愈合质量。目前常用于创面治疗的MSCs包括:骨髓MSCs、脂肪MSCs、脐带(血/Wharton胶)MSCs等。Azari等采用脐带Wharton胶来源的MSCs治疗全层皮肤缺损创面,发现治疗组伤后7d创面即可达到完全再上皮化,而对照组伤后12d仍未完全再上皮化。经组织学观察发现,MSCs治疗后炎症反应轻、肉芽组织较薄进而使瘢痕形成减轻。另有研究用纳米纤维支架/骨髓MSCs治疗皮肤缺损创面,发现可使创缘上皮化加速、促进胶原合成,使创面愈合时间提前8d。还有人用骨髓MSCs联合血小板、纤维蛋白胶和胶原基质在临床上对8例难愈合的糖尿病创面进行了治疗,发现治疗4周后3例创面完全愈合,而其余5例创面则明显缩小。局部应用脂肪MSCs也可促进正常和糖尿病大鼠皮肤缺损创面的愈合,组织学上表现为血管生成、肉芽组织形成和上皮化增加,而且愈合后瘢痕较轻。Rasulov等应用自体骨髓MSCs移植治疗烧伤创面,创面愈合动力学结果显示新生血管活跃,并可以加快创面再上皮化的速度。Luo等研究发现,无论创面局部应用还是静脉注射脐带血MSCs,均可促进创面愈合,并改善愈合质量。
(三)间充质干细胞治疗促进创面愈合的可能机制
MSCs治疗促进创面愈合的具体机制目前仍不完全清楚,其可能机制包括有以下几个方面。
1.长期的自我更新能力和多向分化能力 MSCs在创面局部可能增殖并分化为创面修复所需的细胞,如角质形成细胞、毛囊细胞、皮脂腺细胞、汗腺细胞等。Babiavas等从绿色荧光蛋白(GFP)标记的转基因鼠中获得骨髓MSCs,通过静脉注入无GFP标记的创伤小鼠中。他们观察到GFP标记的细胞分布在创伤皮肤的周围区域,表明移植的骨髓MSCs可移行至损伤的皮肤组织并通过分化为特定的皮肤细胞来修复局部损伤。还有学者发现,脐带血MSCs可以在小鼠体内向表皮(干)细胞分化。
2.促进皮肤网状嵴样结构形成 Aoki等在含MSCs、皮下脂肪前体细胞、成纤维细胞的胶原基质上接种角质形成细胞,发现三种MSCs均可促进角质形成细胞成活,但只有MSCs能促进表皮网状嵴样结构形成,并延伸到基质内。也有人在动物体内实验发现了相同的现象,但创面愈合后,这种结构就消失了。
3.旁分泌作用 许多研究表明,MSCs可分泌大量促进创面愈合的生长因子,如IGF-Ⅰ、FGF、KGF、EGF等。它也可分泌促血管生长的细胞因子,如VEGF、血管生成素、PDGF等。Lu等最近用自体骨髓MSCs(BM-MSCs)治疗糖尿病足溃疡,发现BM-MSCs除可促进溃疡创面愈合外,还可显著增加下肢血液灌注,经磁共振血管成像发现下肢血液侧支循环明显增加。另外,MSCs还能分泌大量的趋化因子,如巨噬细胞炎性蛋白(MIP)-1、MIP-2、单核细胞趋化蛋白(MCP)-5、基质细胞衍生因子等,说明间充质干细胞可通过释放趋化因子选择性募集单核细胞到伤口局部,减轻炎症反应,从而改善伤口愈合质量。最近,Heo等发现,肿瘤坏死因子-α活化的脂肪来源的MSCs可通过旁分泌IL-6和IL-8来促进皮肤创面愈合,而通过免疫沉淀使IL-6和IL-8缺失则可大大减弱其促创面愈合、血管生成、细胞增生和免疫细胞浸润的作用。
4.其他作用 MSCs可能还有促进内源性干细胞迁移到伤口局部、减轻纤维化、保持细胞外基质内环境平衡及减少细胞凋亡等作用。
(四)存在的问题与展望
由此可见,MSCs治疗对慢性难愈合创面具有非常诱人的治疗前景,但仍有一些不足之处限制其广泛应用。首先,已观察到移植的MSCs可与内源性已分化细胞融合形成四倍体细胞,尽管这种现象非常罕见。其次,自体和同种异体干细胞移植治疗均已有致瘤的报道。Janin等在同种异体骨髓移植后发现了供体细胞来源的口腔磷状细胞癌,还有干细胞移植后致皮肤恶性肿瘤、胃癌、成骨肉瘤等的报道。目前还不能明确是由于用于治疗的干细胞本身有致瘤作用,还是免疫抑制、化疗、放疗等其他的治疗措施导致其致瘤。而且,MSCs还可促进宿主体内已有肿瘤的生长,这可能与其产生促肿瘤生长的环境和免疫抑制有关。第三,还不清楚移植的MSCs能否持续在体内保持未分化状态,以支持其长期的治疗效果。此外,它还可能造成外源性致病因子的传播、不必要的免疫反应等。因此,对MSCs治疗风险的充分评价将有助于确定其治疗范围、发展方向和安全计划。
(柴家科 段红杰 尹会男)
参考文献
[1] Herndon DN.Total burn care.Third edition.Philadelphia:Saunders,2007:578-595.
[2] 黎鳌.黎鳌烧伤学.上海:上海科学技术出版社,2001:87-101.
[3] 杨宗城.中华烧伤医学.北京:人民卫生出版社,2008:407-448.
[4] 陆树良.烧伤创面愈合机制与新技术.北京:人民军医出版社,2003:60-85.
[5] 曹启栋,金曙雯,许伟石.表皮角质细胞在金颗粒呑噬玻片上迁移活动的观察.上海第二医科大学学报,1997,17(增刊):1-5.
[6] 陆树良.削痂对深Ⅱ度烧伤局部IL-8释放及创面炎症反应的影响.中华整形外科杂志,1998,14(4):255-257.
[7] 黄晓元,梁鹏飞.深度烧伤创面处理的现状与展望.中华损伤与修复杂志:电子版,2009,4(3):250-256.
[8] 冯永强,薛文君,王德昌,等.早期磨痂术治疗成批烧伤深Ⅱ度创面.中华损伤与修复杂志:电子版,2010,5(6):775-778.
[9] 王明青,李学川,孙元华,等.早期磨痂术治疗深Ⅱ度烧伤的实验观察及机制初探.山东医药,2002,42(33):5-7.
[10] 孙珍,肖玉瑞,杨丽英,等.烧伤创面加深机制的初步探讨.上海第二医科大学学报,1997,17(增刊):37-40.
[11] 史煜华,李利根,柴家科.深Ⅱ度烧伤创面早期加深的机制与防治.军医进修学院学报,2009,30(4):588-589.
[12] 孙永华,于东宁,陈旭,等.几种深Ⅱ度烧伤创面处理方法的回顾及改善创面微循环的初步实验研究.中华烧伤杂志,2005,21(1):17-20.
[13] 冯祥生,谭家驹,阮树斌,等.脱细胞真皮基质覆盖治疗人深Ⅱ度烧伤.第一军医大学学报,2002,22(9):844-848.
[14] Josson A,Brofeldt BT,Nellgard P,et al.Local anesthetics improve dermal perfusion after burn injury.J Burn Care Rehabil,1998,19(1 Pt 1):50-56.
[15] Kim DE,Phillips TM,Jeng JC,et al.Microvascular assessment of burn depth conversion during varying resuscitation conditions.J Burn Care Rehabil,2001,22(6):406-416.
[16] 杨新民,段贵宝.龙胆紫致烧伤创面加深现象分析.河南大学学报(医学科学版),1995,14(1):38-39.
[17] 孔祥伟,王惠兰.1%磺胺嘧啶银混悬液致烧伤创面加深3例.滨州医学院学报,1999,22(5):438.
[18] 史煜华,李利根,柴家科,等.利多卡因防治大鼠深Ⅱ度烧伤创面早期加深的作用.军医进修学院学报,2010,31(4):372-374.
[19] 陆树良,向军,金曙雯,等.烧伤后24h内削痂防治深Ⅱ度创面进行性加深的组织学观察.中华烧伤杂志,2002,18(4):235-237.
[20] 陈保国,乔群,黄渭清,等.高压氧促进供皮区创面愈合的临床研究.中国美容医学,2010,19(5):627-629.
[21] 陆树良,廖镇江.烧伤创面愈合难点问题的探索.上海第二医科大学学报,2004,24(9):693-696.
[22] Turhan V,Sacar S,Uzun G,et al.Hyperbaric oxygen as adjunctive therapy in experimental mediastinitis.J Surg Res.2009,155(1):111-115.
[
23] 王世筠,方培耀,许伟石,等.中性粒细胞在大鼠深Ⅱ度烧伤创面早期进行性损伤中的作用.中华烧伤杂志,2000,16(1):46-49.
[24] Janis JE,Kwon RK,Lalonde DH.Apractical guide to wound healing.Plast Reconstr Surg,2010,125(6):230e-244e.
[25] 段红杰,张延龄.生长因子在伤口愈合中的作用.国外医学·创伤与外科基本问题分册.1997,18(4):228-230.
[26] 段红杰,张延龄.基因治疗在组织修复中的应用.国外医学·创伤与外科基本问题分册.1998,19(4):224-226.
[27] 杨红明,柴家科,郭振荣,等.创面用药变革对深Ⅱ度烧伤创面愈合时间的影响.中国修复重建外科杂志,2001,15(3):162-164.
[28] Fu XB,Sheng ZY,Chen YL,et al.Randomized placebo controlled trial of use of topical recombinant bovine basic fibroblast growth factor for second degree burns.Lancet,1998,352(21):1661-1664.
[29] Hom DB,Thatcher G,Tibesar R.Growth factor therapy to improve soft tissue healing.Facial Plast Surg,2002,18(1):41-52.
[30] Declair V.The importance of growth factors in wound healing.Ostomy Wound Manage,1999,45(4):64-68,70-72,74.
[31] Hu XL,Sun HF,Han CM,et al.Topically applied rhGM-CSF for the wound healing:A systematic review.Burns,2011,37(5):729-741.
[32] Schrank C,Mayr M,Overesch M,et al.Results of vacuum therapy(V.A.C.)of superficial and deep dermal burns.Zentralbl Chir,2004,129 Suppl:1S59-61.
[33] Morykwas MJ,David LR,Schneider AM,et al. Use of subatmospheric pressure to prevent progression of partial-thickness burns in a swine model.J Burn Care Rehabil,1999,20(1 Pt 1):15-21.
[34] Molnar JA,Simpson JL,Voignier DM,et al.Management of an acute thermal injury with subatmospheric pressure.J Burns Wounds,2005:4e5.
[35] Molnar JA.Applications of negative pressure wound therapy to thermal injury.Ostomy Wound Manage,2004,50(4A Suppl):17-19.
[36] Kamolz LP,Andel H,Haslik W,et al.Use of subatmospheric pressure therapy to prevent burn wound progression in human:first experiences.Burns,2004,30(3):253-258.
[37] Haslik W,Kamolz LP,Andel H,et al.The use of subatmospheric pressure to prevent burn wound progression:first experiences in burn wound treatment.Zentralbl Chir,2004,129 Suppl:1S62-63.
[38] Banwell PE.Topical negative pressure wound therapy:advances in burn wound management.Ostomy Wound Manage,2004,50(11A Suppl):9S-14S.
[39] 尹会男,柴家科,李利根.负压创面疗法应用于深Ⅱ度烧伤创面的临床观察.中华损伤与修复杂志:电子版,2011,6(1):69-73.
[40] 乔骋,陈绍宗,许龙顺.负压促进猪深Ⅱ度烧伤创面愈合的实验研究.烧伤创疡杂志,2000:32-34.
[41] 刘政军,林才.封闭负压引流技术在烧伤创面的应用进展.中华烧伤外科杂志,2008,24(4):313-315.
[42] Wasiak J,Cleland H.Topical negative pressure(TNP)for partial thickness burns.Cochrane Database Syst Rev,2007,(3):CD006215.
[43] Ahearn C.Intermittentnegative pressure wound therapy and lower negative pressures-exploring the disparity between science and current practice:a review of the literature.Ostomy Wound Manage,2009,55(6):22-28.
[44] Giordano A,Galderisi U,Marino IR.From the laboratory bench to the patient's bedside:an update on clinical trials with mesenchymal stem cells.J Cell Physiol,2007,211(1):27-35.
[45] Dazzi F,Ramasamy R,Glennie S,et al.The role of mesenchymal stem cells in haemopoiesis.Blood Rev,2006,20:161-171.
[46] Colter DJ,Sekiya I,Prockop DJ.Identification of a subpopulation of rapidly self-renewing and multipotential adult stem cells in colonies of human marrow stromal cells.Proc Natl Acad Sci USA,2001,98:7841-7845.
[47] Luo G,Cheng W,He W,et al.Promotion of cutaneous wound healing by local application of mesenchymal stem cells derived from human umbilical cord blood.Wound Repair Regen,2010,18(5):506-513.
[48] Devine SM,Hoffman R.Role of mesenchymal stem cell in hematopoietic stem cell transplantation.Curr Opin Hematol,2000,7:358-363.
[49] Muguruma Y,Yahata T,Miyatake H,et al.Reconstitition of the functional human hematopietic microenvironment derived from human mesenchymal stem cells in the murine bone marrow compartment.Blood,2006,107:1878-1887.
[50] Glennie S,Soeiro I,Dyson PJ,et al.Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells.Blood,2005,105:2821-2827.
[51] Wu Y,Zhao RC,Tredget EE.Concise review:bone marrow-derived stem/progenitor cells in cutaneous repair and regeneration.Stem Cells,2010,28(5):905-915.
[52] Fathke C,Wilson L,Hutter J et al.Contribution of bone marrow derived cells to skin:Collagen deposition and wound repair.Stem Cells 2004,22:812-822.
[53] Kwon DS,Gao X,Liu YB,et al.Treatment with bone marrow derived stromal cells accelerates wound healing in diabetic rats.Int Wound J,2008,5(3):453-463.
[54] Azari O,Babaei H,Derakhshanfar A,et al.Effects of transplanted mesenchymal stem cells isolated from Wharton's jelly of caprine umbilical cord on cutaneous wound healing; histopathological evaluation.Vet Res Commun,2011,35(4):211-222.
[55] Ma K,Liao S,He L,et al.Effects of nanofiber/stem cell composite on wound healing in acute full-thickness skin wounds.Tissue Eng Part A,2011,17(9-10):1413-1424.
[56] Ravari H,Hamidi-Almadari D,Salimifar M,et al.Treatment of non-healing wounds with autologous bone marrow cells,platelets,fibrin glue and collagen matrix.Cytotherapy,2011,13(6):705-711.
[57] Mizuno H.Adipose-derived stem cells for tissue repair and regeneration:ten yearsresearch and a literature review.J Nippon Med Sch,2009,76(2):56-66.
[58] Rasulov MF,Vasilchenkov AV,Onishchenko NA,et al.First experience of the use bone marrow mesenchymal stem cells for the treatment of a patient with deep skin burns.Bull Exp Biol Med,2005,139(1):141-144.
[59] Wu Y,Chen L,Scott PG,et al.Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis.Stem Cells,2007,25(10):2648-2659.
[60] Sheng ZY,Fu XB,Cai s,et al.Regeneration of functional sweat gland-like structures by transplanted differentiated bone marrow messenchymal stem cells.Wound Rep Reg,2009,17(3):427-435.
[61] Aoki S,Toda S,Ando T,et al.Bone marrow stromal cells,preadipocytes,and dermal fibroblasts promote epidermal regeneration in their distinctive fashions.Mol Biol Cell,2004,15(10):4647-4657.
[62] Hocking AM,Gibran NS.Mesenchymal stem cells:paracrine signaling and differentiation during cutaneous wound repair.Exp Cell Res,2010,316(14):2213-2219.
[63] Lu D,Chen B,Liang Z,et al.Comparison of bone marrow mesenchymal stem cells with bone marrow-derived mononuclear cells for treatment of diabetic critical limb ischemia and foot ulcer:A double-blind,randomized,controlled trial.Diabetes Res Clin Pract,2011,92(1):26-36.
[64] Heo SC,Jeon ES,Lee IH,et al.Tumor necrosis factor-α-activated human adipose tissue-derived mesenchymal stem cells accelerate cutaneous wound healing through paracrine mechanisms.J Invest Dermatol,2011,131(7):1559-1567.
[65] Baraniak PR,McDevitt DC.Stem cell paracrine actions and tissue regeneration.Regen Med,2010,5(1):121-143.
[66] Janin A,Murata H,Leboeuf C,et al.Donorderived oral squamous cell carcinoma after allogeneic bone marrow transplantation.Blood,2009,113:1834-1840.
[67] Herberts CA,Kwa MS,Hermsen HP.Risk factors in the development of stem cell therapy.J Transl Med,2011,9:29.
[68] Lazennec G,Jorgensen C.Concise review:adult multipotent stromal cells and cancer:risk or benefit? Stem Cells.2008,26(6):1387-1394.
[69] Bobis S,Jarocha D,Majka M.Mesenchymal stem cells:characteristics and clinical applications.Folia Histochem Cytobiol,2006,44(4):215-230.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















