第一节 盐皮质激素
盐皮质激素(mineralocorticoid)是由肾上腺皮质球状带细胞分泌的类固醇激素,如脱氧皮质酮和醛固酮,主要生理作用是通过刺激钠的潴留和钾的排泄维持人体内水、电解质的平衡。
在天然皮质激素中,醛固酮是作用最强的一种盐皮质激素。其水盐作用是等量糖皮质激素(皮质醇)的500倍。在正常生理状态下,由于糖皮质激素的分泌量很大,故在人体总的水盐效应中由糖皮质激素承担的约占45%,醛固酮也承担45%,另一种盐皮质激素脱氧皮质酮承担10%。平时每日醛固酮的分泌量很少,如因某种情况引起醛固酮分泌过多,其显著的钠水潴留及排钾效应则可引起低血钾、组织水肿和高血压。若盐皮质激素分泌水平过低会导致水钠流失和血压降低的表现。本节主要讨论醛固酮的生化生理、肾素-血管紧张素-醛固酮轴的功能检查及原发性醛固酮增多症的定性诊断试验。
一、醛固酮的生物合成代谢途径
醛固酮主要由肾上腺皮质的球状带细胞合成、分泌。胆固醇在线粒体内由胆固醇侧链裂解酶(P450scc)催化转化为孕烯醇酮,新合成的孕烯醇酮转移到细胞质内,在内质网的一系列酶催化下,经脱氢和双键移位而转化为孕酮。在3β-羟类固醇脱氢酶(3β-HSD)的作用下,孕烯醇酮形成孕酮。在球状带细胞内,孕酮在21-羟化酶(CYP21)作用下羟化形成11-脱氧皮质酮,再经11β-羟化酶(CYP11B)羟化形成皮质酮。由皮质酮氧化形成醛固酮是醛固酮合成过程的最后一步。此过程需皮质酮甲基氧化酶(CMO)的作用,CMO有Ⅰ型和Ⅱ型两种,CMO-Ⅰ即是18-羟化酶,先使皮质酮在第18位上羟化成为18-羟皮质酮,再由CMO-Ⅱ(18-氧化酶)将18-羟皮质酮在18位上氧化,最后合成醛固酮(图8-1)。人类肾上腺皮质有两种细胞色素P450同工酶(CYP11B1和CYP11B2)具有11β-羟化酶活性,两种同工酶均能使11-去氧皮质酮和11-去氧皮质醇发生11β-羟化,分别催化皮质醇和皮质酮的合成。CYP11B1基因编码P450 C11,其分子量约为51×103 Da,在束状带呈高水平表达,主要参与皮质醇的合成,受ACTH调节。CYP11B2基因编码醛固酮合成酶,其分子量为49×103 Da,主要在球状带表达,受肾素-血管紧张素系统调控,CYP11B2具有11β-羟化酶活性,同时有18-羟化酶和18-氧化酶活性,参与醛固酮的合成。CYP11B1和CYP11B2均定位于8号染色体长臂8q21-22上,其氨基酸序列有95%的同源性。CYP11B1基因突变导致皮质醇合成的缺陷,并由于去氧皮质酮(DOC)的增多引起高血压等表现;CYP11B2基因突变导致醛固酮合成的缺陷并引起失盐表现,而CYP11B1基因的启动子与CYP11B2的结构基因融合后产生一嵌合基因,该基因可引起醛固酮合成调控的改变,使球状带变得对ACTH敏感而不再受肾素-血管紧张素的调节。在ACTH作用下分泌过量的醛固酮及其前体18-羟皮质醇和18-氧皮质醇。从而引起糖皮质激素可抑制性醛固酮增多症。
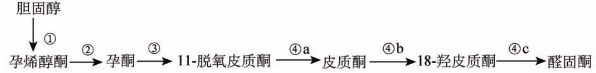
图8-1 醛固酮生物合成途径
在此反应途径中①表示P450scc:20,22-羟化酶,20,22-碳链裂解酶;②表示3β-羟类固醇脱氢酶,△5,△4异构酶;③表示CYP21:21-羟化酶;④表示P450C11:醛固酮合成酶,其中④a表示11β-羟化酶,④b表示18-羟化酶,④c表示18-氧化酶
二、醛固酮的生理作用和作用机制
醛固酮是人体内最主要的盐皮质激素,主要作用于肾脏远曲小管和肾皮质集合管,增加钠的重吸收和促进钾的排泄。也作用于髓质集合管,促进H+排泄,酸化尿液。另外,还可作用于多种肾外组织,调节细胞内、外的离子交换。醛固酮通过与醛固酮受体结合而发挥生理作用。用放射标记的醛固酮发现肾脏内有两种可结合醛固酮的受体;高亲和力的Ⅰ型受体和低亲和力的Ⅱ型受体,已证实Ⅰ型受体即盐皮质激素受体,Ⅱ型受体是GR。比较两者的氨基酸顺序发现,盐皮质激素受体的DNA结合区、激素结合区与GC相应区域分别有94%和50%的同源性,氨基端几乎没有同源性。盐皮质激素受体与GR之间的显著同源性提示GC可与盐皮质激素受体结合。
在20世纪80年代,曾发现盐皮质激素受体对GC和盐皮质激素的亲和力相同。肾脏中GC浓度是盐皮质激素的100~1000倍,但体内却没有盐皮质激素受体过度激活的现象;在盐皮质激素受体丰富的组织(如肾脏、胎盘、唾液腺、结肠等),盐皮质激素却能专一与其受体结合,并发挥生物学效应,这种差别是由11β-羟类固醇脱氢酶(11β-HSD)的作用所致。11β-HSD是一种微粒体酶,有11β-HSD1和11β-HSD2两种同工酶。在肾脏等组织器官有高度密集的11β-HSD,它能使皮质醇转变成皮质素,后者与盐皮质激素受体的亲和力仅为皮质醇的0.3%,而醛固酮结构上的半乙酰基结构避免了11β-HSD的作用,从而保证了醛固酮与其受体结合的专一性,使醛固酮受体免于与GC结合,而对其起保护作用的是11β-HSD2。11β-HSD抑制GC结合盐皮质激素受体有重要的生理意义。甘草和甘珀酸钠(生胃酮)是11β-HSD的强力抑制剂,它以竞争抑制方式或在转录水平抑制该酶活性,因而消除了11β-HSD抑制GC结合盐皮质激素受体的作用,故有致醛固酮增多的作用,可用来治疗醛固酮缺乏症。
醛固酮与盐皮质激素受体(MR)结合后,MR被激活,一般表现为单向性经上皮细胞的钠转运增加,出现保钠作用。非上皮细胞中的MR被激活后的作用尚未完全阐明,一般表现为血压升高(如中枢神经系统)、细胞肥大及纤维化(如心肌)。MR与GC可能存在交叉结合特点,故GC亦具有一定的盐皮质激素作用。生理浓度的GC(主要为皮质醇)在上皮细胞中具有盐皮质激素作用,但在心肌中,GC却可拮抗醛固酮的作用。
近年发现,除肾上腺皮质外,心肌细胞和血管内皮细胞和平滑肌细胞可表达CYP11B1和CYP11B2基因,在局部分别合成11β-羟化酶和醛固酮成酶,因而可合成皮质醇和醛固酮,而且其调节方式与肾上腺皮质相似,可能参与了细胞肥大、增生、血管硬化及组织修复与重建的调节过程,在心肌病变、高血压和动脉硬化的发生中有重要作用。新近有学者发现,用小剂量的螺内酯可提高晚期慢性心力衰竭的存活率,此可能与螺内酯抑制GC中介的纤维化和新生血管形成有关。醛固酮还可调节AT-2的作用,调节凝血酶原活化抑制因子(PAI-1)的表达。
盐皮质激素对血管张力也有作用。血管平滑肌细胞(为主)和内皮细胞(次要)可表达I型盐皮质激素受体(CYP11B2),AT-2可促进其表达,醛固酮可增加3 H-亮氨酸掺入平滑肌细胞的量,而盐皮质激素受体拮抗药(如ZK91587)可抑制CYP11B2的表达,故有降压作用。
在普通人群中,有一部分学者对摄入的氯化钠敏感(盐敏感性人群,salt-sensitive subjects,SSS),SSS易于发生高血压;而另一部分人群对摄入的氯化钠存在一定的抗性(盐抵抗性人群,salt-resistant subjects,SRS),SRS不易发生高血压。在肾脏11β-HSD2将11-羟类固醇灭活,使肾小管上皮细胞的盐皮质激素受体(MR,非选择性)不与GC结合。Lovati等用多态微卫星标志(polymorphic microsatellite marker)技术鉴定SSS和SRS者的HSD11B2基因的第3号外显子的多态性,发现SSS者的糖皮质类固醇与MR的结合明显增多,并发现12个多态性位点,A7/A7纯合子主要见于SSS人群(41%比28%),并伴有11β-HSD2活性下降,提示后者可能是盐依赖性高血压的重要原因。
醛固酮受体(MR)与醛固酮结合后,以受体二聚体形式与DNA上的反应元件结合,螺内酯与MR结合后,诱导受体分子变构,但阻抑基因转录,故表现出对醛固酮的拮抗作用。
除类固酮类激素的核受体(通过调节基因和蛋白质表达的经典途径)作用外,近年发现所有的甾体激素(包括醛固酮)均存在非核受体的快作用途径。醛固酮的非经典性膜受体(nonclassic membrane receptor)与醛固酮可进行高亲和性结合,胞质的显著变化是[Ca2+]的急速升高,在血浆醛固酮浓度为0.1nmol/L时达到生理效应的50%。可拮抗核受体作用的醛固酮拮抗药坎利酮(canrenone)不能阻滞醛固酮的膜受体活性;除胞质[Ca2+]升高外,还表现有肌醇磷酸水解和c AMP生成,但目前尚未阐明醛固酮膜受体的本质。
三、醛固酮分泌的调节
(一)肾素-血管紧张素系统
肾素-血管紧张素系统是醛固酮合成调控的最重要因素。肾素是由肾小球旁器分泌的蛋白酶,催化血管紧张素原的水解,形成血管紧张素Ⅰ(angiotensinⅠ,AngⅠ),后者在血管紧张素转化酶(angiotensin convening enzyme,ACE)的作用下,形成血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)和血管紧张素Ⅲ(angiotensinⅢ,AngⅢ)。
肾素的分泌受多种因素的调节。肾小球旁器细胞本身是一压力感受器,可感知入球小动脉和肾实质的压力,调节肾素分泌,致密斑则通过感受肾小管钠离子浓度来调节肾素分泌。当血容量减低,肾动脉压下降,交感神经兴奋,致密斑的钠负荷减少及前列腺素增加,低血钾时均可刺激肾小球旁器使肾素分泌增加,而AngⅡ通过短环负反馈直接抑制肾素分泌;醛固酮则通过增加钠重吸收,扩张血容量,间接抑制肾素的分泌。
(二)电解质
K+是调控醛固酮合成的另一重要因素。K+可直接作用于球状带,增加醛固酮合成,醛固酮也可通过刺激肾排泄K+来调节血钾浓度。而钠离子主要是通过调节肾小球旁器细胞合成肾素来影响醛固酮的合成。
(三)其他
ACTH可刺激醛固酮分泌,但作用较小且短暂。心房利钠肽(atrial natriuretic peptide,ANP)可直接抑制醛固酮的分泌。另外,AVP、多巴胺、5-羟色胺、生长抑素也有微弱的调节作用。
四、肾素-血管紧张素-醛固酮轴的功能检查
肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)由一系列激素和相关的酶组成,其通过控制血容量和外周阻力,调节人体血压、水和电解质平衡,从而维持机体内环境的稳定。
肾素主要由肾脏近球细胞产生、储存与分泌,是广泛存在于人类与哺乳动物中的一种特异性蛋白水解酶,分子量约为43 000。血循环中的肾素作用于血管紧张素原产生血管紧张素Ⅰ。AngⅠ在正常生理浓度下无生理活性,它在血管紧张素转化酶的作用下切去羧基末端9和10位的组氨酸和亮氨酸,生成具有生物活性的AngⅡ。AngⅡ是RAAS中最重要的成分,是由8个氨基酸组成的活性多肽,其分子量为1046Da,它直接作用于血管平滑肌的AngⅡ受体,使血管平滑肌收缩,血压升高。同时,AngⅡ又是刺激醛固酮分泌的主要激素,对肾上腺皮质球状带细胞的作用持久而剧烈,AngⅡ还能促进垂体释放血管加压素和ACTH,刺激交感神经分泌去甲肾上腺素。虽然AngⅡ具有强大的收缩血管作用,但在体内半衰期很短,只有0.5~1min。AngⅡ在氨基肽酶A的作用下失去氨基端的天冬门氨酸而变成AngⅢ,后者亦具有促进醛固酮和去甲肾上腺素分泌的作用,但较AngⅡ弱。
醛固酮属于21碳类甾体激素,分子量为364Da。醛固酮作用于远端肾小管,通过保钠排钾作用调节电解质平衡与体液容量。血管紧张素Ⅱ是激发醛固酮分泌的最大刺激剂,其次是血钾浓度和ACTH。醛固酮的分泌有昼夜节律,受体位、运动及钾摄入量的影响。醛固酮的半衰期约0.5h,经肝脏代谢,通过肾脏排出体外。醛固酮水平测定需在严格控制下采血或收集24h尿。
临床RAAS激素多采用放射免疫测定法(radioimmunoassay,RIA)测定,即用放射性核素标记待检测物质,通过仪器对放射性物质的接收来对待测物质进行定性或者定量测定。优点:灵敏、特异、简便易行、用样量少等,常可测至皮摩尔。缺点:方法中使用放射性核素,因而不可避免地存在核素试剂有效期短、放射性污染和操作等弊端。有时会出现交叉反应、假阳性反应,组织样品处理不够迅速,不能灭活降解酶和盐及p H有时会影响结果等。迄今,已有不少其他标记物用来代替放射性核素。其中以酶免疫测定法(ELISA)和免疫荧光法(IF)较为成功。ELISA和IF方法中试验条件已统一稳定并有成套试剂盒供临床应用。但是,这两种方法的灵敏度不如RIA。
(一)血浆肾素活性测定
1.原理 肾素是肾小球旁器产生的一种酶,催化一种特殊的α2球蛋白-血管紧张素原转化为血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)。
目前已可用单克隆方法克隆出抗肾素抗体,并建立了直接测定肾素含量的放射免疫分析方法。但国内大多数实验室测定血浆肾素活性(plasma renin activity,PRA)实际上是测定血浆中AngⅠ的产生速率。即同一样品(血浆)取双份,一份让其直接与抗体反应,测其AngⅠ的浓度,称为对照管;另一份则在37℃温育一段时间后再让其与抗体反应,测其AngⅠ的浓度称作测定管。测定管的AngⅠ的浓度减去对照管的AngⅠ的浓度被温浴时间除之,则为单位时间内AngⅠ的产生速率,称之为血浆肾素活性。
2.方法
(1)按取血5ml计,每支取血管中加0.3M EDTA 50μl,0.32M二巯基丙醇25μl,0.34M 8-羟基喹啉硫酸盐50μl抗凝。
(2)肘静脉取血5ml,拔出针头后注入到抗凝管中,将管口封好后上下颠倒数次,混匀后立刻放入冰水中或4℃冰箱中1~2h,取出后2500转/min,离心7min;或是混匀后立刻4℃离心,分离血浆。将血浆密封后放入低温冰箱保存(-20℃),可用2个月。
3.正常值 PRA正常值以[μg/(L·h)]表示。各家报道的正常值有所差异,我科实验室的正常参考值如下。
(1)正常人普食卧位:(0.07~1.47)μg/(L·h)。
(2)正常人普食立位:(1.50~5.00)μg/(L·h)。
受试者在采血时的各种状态都能影响肾素-血管紧张素的测定值,卧位时的PRA值约是立位状态时的50%,而坐位状态的PRA值约是立位的75%。每日钠的摄入量能直接影响PRA,故在测定PRA 3d前应适当减少食盐摄入量。病人应测定取血前24h尿钠含量,以供分析PRA结果时参考。在一天之内,生物钟对其影响很显著,即在同一状态下,2~8时肾素的分泌量最高,而12~18时其分泌达底限。在妇女月经周期中,卵泡期PRA最低,黄体期最高。妇女在妊娠期PRA的水平随妊娠延长而升高。
4.结果评价
(1)肾素活性升高见于:
①肾动脉狭窄及高肾素型原发性高血压、恶性高血压、肾素瘤、Bartter综合征、嗜铬细胞瘤、肾动脉硬化、肾盂积水、肾囊肿、肾功能不全、继发性醛固酮增多症、先天性醛固酮缺乏症、肾上腺皮质功能减退、甲状腺功能亢进、肝硬化、低钾血症、钠缺乏、充血性心力衰竭及特发性水肿等。
②药物如呋塞米、氯胺酮、螺内酯、米诺地尔、硝普钠、肼屈嗪、ARB、糖皮质激素、雌激素、睾酮及前列腺素等可使肾素活性增高。
(2)肾素活性降低见于:
①原发性醛固酮增多症、11-和17-羟化酶缺乏症、肾上腺皮质功能亢进、Liddle综合征、低肾素型原发性高血压、糖尿病及高容量血症等。
②药物如β受体阻滞药、L-甲基多巴、L-多巴、吲哚美辛、阿司匹林、可乐定、利血平、甘草制剂及血管紧张素Ⅱ、盐皮质激素、血管加压素等可使肾素活性降低。
5.临床意义 RAAS在高血压的发病机制中起重要作用,与某些肾脏疾病亦有密切联系,测定PRA,特别是联合血浆醛固酮测定对这些疾病的诊断、鉴别诊断和治疗有重要价值。PRA活性受抑制伴高醛固酮血症对原发性醛固酮增多症诊断有重要价值。
(二)血浆血管紧张素Ⅱ测定
1.原理 血管紧张素原在肾素的作用下转变为AngⅠ,AngⅠ是一种10肽,在肺经转换酶的作用变为8肽的AngⅡ。AngⅡ有强烈的收缩血管作用,使血压升高,同时兴奋醛固酮的分泌。AngⅡ在血液和组织中被血管紧张素酶迅速灭活。
测定原理为采用竞争机制原理,标准或样品中的AngⅡ和加入的125 I-AngⅡ共同与一定量的特异性抗体产生竞争性免疫反应。125 I-AngⅡ与抗体的结合量与标准或样品中AngⅡ的含量呈一定的函数关系。用免疫分离剂(PR)将结合部分(B)与游离部分(F)分离后,测定结合部分的放射性强度,并计算相应结合率B/B0。用已知标准AngⅡ含量与相应结合率作图,即得标准抑制曲线。从标准曲线上查知对应结合率的待测样品中AngⅡ的含量。
2.方法
(1)按取血5ml计,每支取血管中加0.3M EDTA 50μl,0.32M二巯基丙醇25μl,0.34M 8-羟基喹啉硫酸盐50μl抗凝。
(2)肘静脉取血5ml,拔出针头后注入抗凝管中,将管口封好后上下颠倒数次,混匀后立刻放入冰水中或4℃冰箱中1~2h,取出后2500转/min,离心7min;或是混匀后立刻4℃离心,分离血浆。将血浆密封后放入低温冰箱保存(-20℃),可用2个月。
3.正常值
(1)正常人普食卧位:11.8~95pg/ml。
(2)正常人普食立位:92.5~150pg/ml。
4.结果评价与临床意义
(1)在血管紧张素转化酶活性正常时,AngⅡ水平的变化和PRA一致,同时测定AngⅡ和PRA可提高诊断符合率。
(2)血管紧张素转化酶活性受抑制时,AngⅡ降低,PRA正常。血管紧张素转化酶活性增强时,AngⅡ增高,PRA正常。
(三)血浆醛固酮(aIdosterone,ALD)测定
1.原理 正常成年人在普食情况下24h的醛固酮分泌量约为100μg,在血中50%~60%的醛固酮与血浆白蛋白结合,其余部分是游离的,半衰期约0.5h。醛固酮的合成和分泌除受ACTH影响外,主要是通过RAAS的作用进行调节。
测定原理为应用均相竞争原理,标准或样品中的醛固酮和加入的125 I-Ald共同与一定量的特异性抗体产生竞争性免疫结合反应。125 I-AngⅡ与抗体的结合量与标准或样品中Ald的含量呈一定的函数关系。用免疫分离剂(PR)将结合部分(B)与游离部分(F)分离后,测定结合部分的放射性强度,并计算相应结合率B/B0。用已知标准Ald含量与相应结合率作图,即得标准抑制曲线。从标准曲线上查知对应结合率的待测样品中Ald的含量。
2.方法
(1)卧位:平卧过夜,次晨起床前取静脉血3ml,加肝素抗凝(1mg肝素可抗凝血5~10ml)送检。
(2)立位:即在卧位取血后,病人保持直立位2~3h,然后采血送检。
3.正常值
(1)正常人普食卧位:163.4~481.9pmol/L。
(2)正常人普食立位:180.1~819.9pmol/L。
4.结果评价
(1)血中Ald浓度与其分泌量和代谢清除率平衡,立位比卧位高。女性黄体期和妊娠15周后Ald升高,血容量降低时Ald升高。
(2)醛固酮升高见于:
①原发性醛固酮增多症:由于肾上腺皮质腺瘤或增生分泌Ald增多,患者表现为高血压、低血钾及神经肌肉功能障碍。同时PRA受抑制,甚或不能测出。
②继发性醛固酮增多症:肾素瘤、肾性高血压、Bartter综合征、充血性心力衰竭、肝硬化腹水、特发性水肿、低钠血症及17α-羟化酶缺乏等可使醛固酮分泌增多。与原醛症不同,血醛固酮基础值及PRA同时升高。
③口服避孕药和雌激素可使Ald分泌增高。
(3)醛固酮降低见于:
①Addison病:由于肾上腺皮质功能减退,醛固酮分泌减少。
②继发性醛固酮降低:垂体功能减退、Turner综合征。
③其他:Ald合成中所需的酶缺陷,肾素、血管紧张素分泌减少,某些肾脏疾病及糖尿病等均可使Ald分泌减少。
④药物:普萘洛尔、利血平、甲基多巴、可乐定、甘草等均可使肾素活性降低,Ald分泌减少。
5.临床意义 临床上,血浆Ald的测定为醛固酮增多症化学诊断的重要指标,同步测定PRA及AngⅠ、AngⅡ对鉴别原发性与继发性醛固酮增多症有重要价值。
(四)尿醛固酮测定
1.原理 血中的醛固酮在体内大部分被代谢降解为四氢醛固酮,从尿中排出,未被降解的醛固酮大部分与葡萄糖醛酸结合,小部分为游离形式,亦从尿中排出。尿醛固酮就是尿中游离醛固酮和葡萄糖醛酸结合醛固酮的总和。
放免测定原理与血清醛固酮相同。
2.方法
(1)收集24h尿,加冰醋酸10ml防腐,记录尿总量,混匀,取10ml送检。
(2)取尿标本0.5ml,加0.3N盐酸1.0 ml,于30℃水浴水解20~24h,此水解尿作为待测样品。
(3)取水解尿样品50μl,加到样品管中用缓冲液。
24h尿醛固酮总量=0.3A×D/V3μg。
A:从标准曲线上查得的醛固酮浓度(ng/ml)。
V3:水解尿加入的体积(50μl)。
D:24h总尿量(ml)。
注:摘自碘(125 I)醛固酮放射免疫分析药盒说明书,北京北方生物技术研究所,2010。
3.正常值 2.77~22.2nmol/24h。
4.结果评价 与血浆醛固酮测定,原发性及继发性醛固酮增多症时尿醛固酮均增高。
5.临床意义 由于血浆醛固酮的分泌有昼夜节律,且受体位等因素的影响,而收集24h尿醛固酮的排泄量可精确反映醛固酮的分泌情况。
(五)干扰因素的排除
1.纠正低血钾。
2.鼓励患者自由进食(不限制食盐)。
3.停用利尿药(包括螺内酯、氨苯蝶啶)和甘草制剂至少4周。
4.停用β受体阻滞药、α-甲基多巴、可乐定、NSAIDs、ACEI、ARB、肾素抑制药、二氢吡啶类钙拮抗药至少2周。
5.如需控制血压,选择对RAS系统影响小的降压药。
(1)盐酸维拉帕米缓释(缓释异搏定)90~120mg,每日2次。
(2)盐酸肼屈嗪10~12.5mg,每日2次,按需增加剂量。
(3)盐酸哌唑嗪0.5~1mg,每日2~3次,按需增加剂量。
甲磺酸多沙唑嗪1~2mg,每日1次,按需增加剂量。
盐酸特拉唑嗪1~2mg,每日1次,按需增加剂量。
6.了解口服避孕药和激素替代治疗情况,因含雌激素的药物可影响直接肾素浓度(direct renin concentration,DRC),引起假阳性结果,但在无其他可替换的措施前暂不停止口服避孕药的治疗。
五、原发性醛固酮增多症
原发性醛固酮增多症(原醛症,primary aldosteronism,PA)是肾上腺皮质球状带分泌过多醛固酮所致的临床综合征,主要表现为高血压、低血钾、尿钾排泄增多、肌无力、高醛固酮血症和血浆低肾素活性。PA是一种继发性高血压,占高血压中的0.05%~2%,近年由于筛查手段的广泛应用,尤其醛固酮肾素比(aldosterone-renin ratio,ARR)的应用,在高血压中原醛已达1.99%~13.2%。发病年龄高峰为30~50岁,女性较男性多见。
(一)原醛的病理亚型
1.肾上腺皮质腺瘤(aldosterone-producing adenoma,APA) 70%~80%。
2.双侧肾上腺皮质增生(特醛症,idiopathic hyperaldosteronism,IHA) 10%~20%。
3.糖皮质激素可抑制性醛固酮症(glucocorticoid suppressible hyperaldosteronism,GSHA)
1%~3%。
4.原发性肾上腺增生症(primary adrenal hyperplasia,PAH) <3%。
5.对肾素有反应的醛固酮分泌腺瘤(aldosterone-producing-rennin responsible adenoma)
<5%。
6.产生醛固酮的肾上腺皮质癌(aldosterone producing carcinoma) <1%。
7.异位醛固酮分泌(少数卵巢恶性肿瘤)<1%。
(二)原醛的筛查指标
![]()
注:血浆醛固酮(1ng/dl=27.7pmol/L)
1.方法 采血当日晨起保持立位2h后(站立或行走),坐5~15min,于上午9~10时取肘静脉血,保持标本在室温送达实验室(不放在冰上,因冰上会促进肾素从非活性向活性转化),优先离心,快速冰冻血浆成分检测。
2.结果评价 国外各家报道的ARR值为20~75[ng/dl∶ng/(ml·h)],差别甚大。由于PRA的测定结果受人种影响较大,国外实验室建立的ARR比值并不一定适用于我国人群,国内学者提出国人立位ARR≥24[ng/dl∶ng/(m·h)]为切割点,能较好地从高血压患者中筛选原醛。其敏感性93%,特异性94%。
影响因素:①药物。绝大部分降压药物对血浆肾素和醛固酮均有显著的影响。利尿药通过减少血容量、刺激交感神经使PRA升高;钙离子拮抗药降压后可反射性引起交感兴奋,刺激肾素分泌;ACEI和ARB则阻断了血管紧张素Ⅱ对肾素的负反馈抑制作用。这些药物均可升高PRA而造成假阴性。相反,β受体阻滞药抑制交感后减少肾脏JG细胞分泌肾素,同时也减少了醛固酮的生成,但醛固酮减少的程度不如肾素;可乐定通过抑制中枢交感而达到相似的效果;值得注意的是,非甾体类抗炎药物可引起水钠潴留而抑制肾素,这在高血压患者中尤为明显,这些药物都可降低PRA水平而导致假阳性。而利尿药(排钾和保钾)、ACEI、ARB、二氢吡啶类钙离子拮抗药(dihydropyridine calcium channel blocker,DHPCCB)都可升高PRA水平而导致假阴性。②体位。立位后,下肢的血流量增加,球旁细胞受到肾血流灌注减少的作用而分泌肾素,同时激活交感神经进一步升高肾素和醛固酮。肝脏对醛固酮的代谢速度由于血流量的减少而减慢,因此立位血浆醛固酮水平将随PRA水平的升高而升高。立位PRA检测能最大限度地区分原发性高血压中的低肾素者与原醛,而原醛患者的低肾素水平不被立位所激发。立位ARR值具有相对集中的趋势,直立位ARR值对以往容易漏诊的肾上腺双侧增生患者更为敏感,对原醛患者的分型有一定的帮助。③血钾水平。血钾和醛固酮两者存在相互调节,相互制约的关系。血钾升高时刺激醛固酮分泌增加,而低血钾则会抑制其分泌,降低醛固酮水平,造成假阴性。因此,ARR测定前必须纠正低血钾。若低血钾时测得醛固酮和ARR均显著升高,则强烈提示原醛可能。
(三)原醛的确诊试验
ARR阳性者仍需进一步确诊试验,即选择下述4种试验之一,并根据结果作为确诊或排除原醛症的依据。
1.口服钠负荷试验(oral sodium loading test)
(1)原理:大量钠盐进入远曲小管,促进钠、钾交换,使尿钾排除增加,血钾可随之降低。正常人及一般高血压的病人,高钠饮食后醛固酮的分泌受到抑制,肾远曲管对钠的重吸收减少,而原醛病人由于腺瘤能自主分泌醛固酮,即使高钠摄入,肾小管对钠的重吸收仍很高,通过钠钾交换使钾丢失,低血钾变得更明显。
(2)方法
①高钠饮食(钠摄入>6g/d)至少3d,通过24h尿钠进行验证。
②3d后留24h尿醛固酮、钾、钠,同时采空腹血测钾、钠。
③每天监测血压1次。
(3)临床意义
①原醛病人24h尿醛固酮>10~14μg/d(28~39nmol/d),尿钠>250mmol/d。
②正常人及一般高血压病人,尿钠可增加,血钾无改变。原醛病人血钾降至3.5mmol/L以下,原醛的临床表现及生化检查变得明显,血压有上升趋势,病情加重。
(4)注意事项:本试验适用于病情轻,血钾降低不明显的疑似醛固酮分泌过多的患者,作为激发试验。因为高钠后会使症状即病情加重,如原醛的临床及生化表现很典型,禁止行此试验。
2.盐水输注试验(saline infusion test)
(1)原理:正常情况下,盐水输注后,血钠及血容量增加,大量钠盐进入肾单位远曲小管,可抑制肾小球旁细胞肾素的分泌,从而抑制血管紧张素-醛固酮的分泌,使血中肾素-血管紧张素、醛固酮水平降低。
(2)方法
①实验前患者平卧至少1h,试验中保持平卧。
②试验起始时间应在清晨8:00~9:30。
③在0h和4h时取血测PRA、醛固酮、皮质醇、血钾。
④从清晨8:00~12:00均匀滴注0.9%氯化钠溶液500ml/h。
⑤试验全程应监测血压和心率。
(3)临床意义
①血浆醛固酮<5ng/dl(138pmol/L)排除原醛症。
②血浆醛固酮>10ng/dl(277pmol/L)确诊原醛症。
③血浆醛固酮介于5~10ng/dl(138~277pmol/L)可疑原醛症。
(4)注意事项:有心脏疾病和老年患者,大量盐水输注可能会加重心脏负担,引起心律失常和心力衰竭,需慎行此试验。
3.氟氢可的松抑制试验(fludrocortisone suppression test)
(1)原理:在原发性醛固酮增多症中,有一种特殊类型称为糖皮质激素可抑制性醛固酮增多症。具有以下特点:①临床表现与经典的原发性醛固酮增多症相同;②患者的年纪轻,大多数在20岁以前发病;③有家族性罹患的倾向;④病理基础为双侧肾上腺皮质增生;⑤醛固酮和18-氧皮质醇分泌增加且为ACTH依赖。小剂量氟氢可的松可使本病患者的肾素-血管紧张素-醛固酮系统恢复正常,临床症状消失。
(2)方法:口服0.1mg氟氢可的松,每6小时1次,共4d。期间不限制钠盐的摄入,保持血钾于正常范围。第4天上午10时取血测醛固酮和PRA值,患者应取立位。
(3)临床意义:4d后测定立位血浆醛固酮>6ng/dl(163.2pmol/L),同时PRA<1ng/(dl·h),血浆皮质醇在早上10时的值小于7时(排除ACTH混杂的影响),则确定为原发性醛固酮增多症。
4.卡托普利试验(captopril challenge test)
(1)原理:卡托普利是一种血管紧张素转化酶抑制药,可抑制血管紧张素Ⅰ向Ⅱ转化,从而减少醛固酮的分泌,降低血压。
(2)方法
①普食卧位过夜。
②次日8:00空腹卧位测血压并取血测血浆醛固酮、肾素活性及血管紧张素Ⅱ。
③取血后立即口服卡托普利25mg,继续卧位2h。
④于上午10:00卧位测血压并取血测血浆醛固酮、肾素活性及血管紧张素Ⅱ。
(3)临床意义
①在正常人或原发性高血压病人,服卡托普利后血浆醛固酮水平被抑制到416pmol/L(15ng/dl)以下,肾素活性升高。
②原醛病人的血浆醛固酮则不被抑制。如血浆醛固酮>416pmol/L(15ng/dl),醛固酮(ng/dl)与血浆肾素活性[ng/(ml·h)]比值>50,提示原醛。
(四)其他试验
1.卧立位试验
(1)原理:正常人在卧床过夜后,血浆醛固酮值为110~330pmol/L,保持卧位到中午12:00,血浆醛固酮浓度下降,和血浆皮质醇浓度的下降相一致。如卧床过夜后取立位,则血浆肾素-血管紧张素及醛固酮上升,因为站立后肾脏血液灌注量减少,刺激肾素-血管紧张素升高的作用超过ACTH的影响。特醛症患者(即增生型)上午立位4h后血浆肾素有轻度升高,由于此型对血管紧张素的敏感性增强,所以血浆醛固酮上升超过正常人。醛固酮瘤患者在此条件下,血浆醛固酮不上升,反而下降,因为此型患者肾素-血管紧张素系统受抑制较增生型更重,立位后也不能升高。肾素反应性腺瘤由于站立位所引起的血浆肾素变化使血醛固酮明显升高。
(2)方法
①平卧过夜,清晨卧位采血测肾素-血管紧张素、醛固酮。
②保持立位活动4h,不能坐下,再次采血测肾素、血管紧张素、醛固酮。
(3)临床意义
①正常人血浆醛固酮卧位163.4~481.9pmol/L,立位180.1~819.9pmol/L;血浆肾素活性卧位0.07~1.47μg/(L·h),立位1.5~5.0μg/(L·h);血浆血管紧张素Ⅱ卧位11.8~95.0ng/L,立位92.5~150.0ng/L。
②特醛症患者卧位血浆肾素-血管紧张素Ⅱ低,醛固酮增高,立位血浆肾素-血管紧张素Ⅱ有轻度升高,血浆醛固酮上升超过正常人。
③醛固酮瘤者,卧位醛固酮水平明显高于正常,肾素-血管紧张素水平明显低于正常,立位肾素-血管紧张素无明显改变,醛固酮降低。
④肾素反应性腺瘤者,立位后肾素-血管紧张素、醛固酮均较卧位升高。
(4)注意事项
①在行此试验前需纠正低血钾,尽量保持血钾和血钠在正常水平。
②避免利尿药和降压药。
③进食正常钠饮食(钠120mmol/24h),共4d。
2.呋塞米激发试验(furosemide provocation test)
(1)原理:呋塞米抑制肾小管髓襻升支对Na+、Cl-的重吸收,干扰了尿液的浓缩过程,使尿量增加;同时大量的Na+到达远曲小管和集合管,使K+-Na+交换增加。净效应是血Na+降低,血容量减少,刺激肾小球旁器分泌肾素,水平增高,从而兴奋醛固酮的合成及分泌。因此,在一定剂量的呋塞米的作用下,通过RAS的分泌反应,可以比基础状态下的激素测定更好地反映醛固酮释放增多的性质。
(2)方法
①平卧过夜,清晨卧位采血测定肾素-血管紧张素、醛固酮。
②肌内注射呋塞米40mg,保持立位走动2h,再次采血测定肾素-血管紧张素、醛固酮。
③临床意义:同卧立位试验。
④注意事项:同卧立位试验。
3.钾负荷试验
(1)原理:醛固酮作用于肾远曲小管,促进钠的重吸收和钾的排出,引起低钾性碱中毒。醛固酮分泌增多时,这种肾性失钾作用强大而持久,不因为钾的补充而得以纠正,表现对补钾的抗拒性。因此,在大剂量补钾的情况下,通过血和尿钾,血p H和HCO-3的变化可以间接地判断低血钾(肾性失钾)的原因是否为醛固酮释放增多。
(2)方法
①患者固定钠钾饮食(钠160Eq/d,钾60Eq/d),共9d。
②第2天留取24h尿测定钾、钠、氯,第3天早晨采血测定血钾、钠、氯作为对照。
③第3天开始口服10%氯化钾20ml,每日4次(相当于补充钾106.4mEq/d),共7d。
④服钾后分别于第5天和第7天留取24h尿测定钾、钠、氯,第6天和第8天早晨采血测定血钾、钠、氯。
(3)结果及临床意义
①原发性醛固酮增多症:血钾无明显上升,尿钾排泄显著增多。
②肾脏疾病和服用利尿药:血钾有明显回升。
4.低钠试验
(1)原理:原醛患者在低钠条件下到达肾远曲小管的钠显著减少,虽然醛固酮分泌增多,但钠钾交换减少,使尿钾减少,血钾上升。而失钾性肾炎有大量的失钠、失水,继发醛固酮分泌增多,即使减少钠的摄入,尿钠排出仍不减少,尿钾的减少也不明显。
(2)方法
①限制病人每日的摄入量在20mmol(1.2g氯化钠)内,而钾的摄入量正常(60mmol/24h)共6d。
②于试验前及试验的第5天、第6天留24h尿测钾、钠,同时采空腹血测钾、钠。
(3)临床意义
①正常人低钠饮食后血钾不上升。
②原醛病人于第5天、第6天尿钠明显减少,甚至无钠排出,尿钾明显减少,血钾上升,高血压减轻。
③失钾性肾炎,低钠试验后,尿钠排出不减少尿钾排泄减少也不明显,低血钾不易纠正。
5.螺内酯试验(spironolactone test)
(1)原理:螺内酯有对抗醛固酮在远端肾小管的排钾保钠作用,如果剂量充足,可使醛固酮增多引起的尿钾排量减少,血钾上升接近或达到正常血钾水平,血压降低,甚至降至正常水平。减轻病人症状。但血尿醛固酮含量明显增高。
(2)方法
①固定钠钾饮食(钠160mmol/L,钾60mmol/L)7d。每日测血压,第6天、第7天测血钾、钠、CO2 CP、p H,并留24h尿测钾、钠、p H。
②仍在上述饮食条件下服用螺内酯60~80mg,每日4次,共1~2周。每日测血压,每周最后2d重复上述实验室检查。
(3)临床意义
①原醛患者服药后尿钾排出减少,尿钠排出增加,血钾显著上升,接近或达到正常水平,部分原有高血钠及碱中毒的患者血p H下降,血钠降低,尿p H变为酸性,代谢紊乱得到初步纠正。血压下降满意者,提示术后容易恢复正常,血压下降不满意者,往往提示术后不易恢复正常。本试验有助于证明是否存在醛固酮增多症,但不能鉴别出原发性还是继发性醛固酮增多症。
②失钾性肾病患者服螺内酯后不起作用。
(闫文华 郭清华)
参考文献
[1]廖二元,超楚生.内分泌学.北京:人民卫生出版社,2001:4.839-841,873-875,908-920.
[2]王川,张少玲.盐皮质激素受体的结构和功能.国际内科学杂志,2009,36:730-733.
[3]Funder JW.aldosterone and mineralocorticoid receptors:orphan questions.Kidney Int,2000,57:1358-1363.
[4]Slight SH,Joseph J,Ganjam VK,et al.Extra-adrenal mineralocorticoids and cardiovascular tissue.J Mol Cell Cardiol,1999,31:1175-1184.
[5]Hatakeyama H,Miyamori I,Fujita T,et al.Vascular aldosterone biosynthesis and a link to angiotensin II-induced hypertrophy of vascular smooth muscle cells.J Biol Chem,1994,269:24316-24320.
[6]Lovati E,Ferrari P,Dick B,et al.Molecular basis of human salt sensitivity:the role of the 11 betahydroxysteroid dehydrogenase type 2.J Clin Endocrinol Metab,1999,84:3745-3749.
[7]Ferrari P,Lovati E,Frey FJ.The role of the 11βhydroxysteroid dehydrogenase type 2 in human hypertension.J Hypertens,2000,18:241-248.
[8]Ferrari P,Krozowski Z.Role of the 11β-hydroxysteroid hydrogenase type 2 in blood pressure regulation.Kidney Int,2000,57:1374-1381.
[9]Hellal-Levy C,Fagart J,Souque A,et al.Mechanistic aspects of mineralocorticoid receptor activation.Kidney Int,2000,57:1250-1255.
[10]Falkenstein E,Christ M,Feuring M,et al.Specific nongenomic actions of alosterone.Kidney Int,2000,57:1390-1394.
[11]Funder JW,Carey RM,Fardella C,et al.Case detection,diagnosis,and treatment of patients with primary aldosteronism:an endocrine society clinical practice guideline.J Clin Endocrinol Metab,2008,93:3266-3281.
[12]Litchfield WR,Dluhy RG.Primary aldosteronism.Endocrinol Metab Clin North Am,1995,24:593-612.
[13]Mosso L,Carvajal C,González A,et al.Primary aldosteronism and hypertensive disease.Hypertension,2003,42:161-165.
[14]Mulatero P,Stowasser M,Loh KC,et al.Increased diagnosis of primary aldosteronism,including surgically correctable forms,in centers from five conti-nents.J Clin Endocrinol Metab,2004,89:1045-1050.
[15]Nishizaka MK,Pratt-Ubunama M,Zaman MA,et al.Validity of plasma aldosterone-to-renin activity ratio in African American and white subjects with resistant hypertension.Am J Hypertens,2005,18:805-812.
[16]Ferrari P,Shaw SG,Nicod J,et al.Active renin versus plasma renin activity to define aldosterone-to-renin ratio for primary aldosteronism.J Hypertens,2004,22:377-381.
[17]Olivieri O,Ciacciarelli A,Signorelli D,et al.Aldosterone to Renin ratio in a primary care setting:the Bussolengo study.Clin Endocrinol Metab,2004,89:4221-4226.
[18]Hirohara D,Nomura K,Okamoto T,et al.Performance of the basal aldosterone to renin ratio and of the renin stimulation test by furosemide and upright posture in screening for aldosterone-producing adenoma in low renin hypertensives.J Clin Endocrinol Metab,2001,86:4292-4298.
[19]陈绍行,杜月凌,张瑾,等.在高血压患者中筛选原发性醛固酮增多症国人血浆醛固酮/肾素活性比值标准的探讨.中华心血管病杂志,2006,34:868-872.
[20]Gordon MS,Williams GH,Hollenberg NK.Renal and adrenal responsiveness to angiotensin II:influence of beta adrenergic blockade.Endocr Res,1992,18:115-131.
[21]Qi Z,Hao CM,Langenbach RI,et al.Opposite effects of cyclooxygenase-1 and-2 activity on the pressor response to angiotensin II.J Clin Invest,2002,110:61-69.
[22]Tunny TJ,Gordon RD,Klemm SA,et al.Histological and biochemical distinctiveness of atypical aldosterone-producing adenomas responsive to upright posture and angiotensin.Clin Endocrinol(Oxf),1991,34:363-369.
第二节 肾上腺髓质激素
一、肾上腺髓质激素的生理作用
肾上腺髓质激素——儿茶酚胺(catecholamines,CAs)包括肾上腺素(epinephrin,E)、去甲肾上腺素(norepinephrin,NE)和多巴胺(dpamine,DA)。人体内肾上腺素主要由肾上腺髓质分泌,肾上腺以外的嗜铬组织也能少量分泌肾上腺素,一般交感神经元不分泌肾上腺素。由肾上腺髓质合成和分泌的去甲肾上腺素只占儿茶酚胺总量的15%~20%。中枢神经系统、周围神经的交感神经细胞可分泌较大量的去甲肾上腺素。CAs既是人体内一类非常重要的神经递质,也是重要的激素物质,对人体的心血管系统、神经系统、内分泌腺、肾脏、平滑肌等组织器官的生理活动起着广泛的调节作用,同时还影响人体的代谢。儿茶酚胺在效应器官中与特异性的肾上腺素能受体结合,通过激活靶细胞信号系统发挥其生理效应。肾上腺素能受体分为两大类:α(α1、α2)受体和β(β1、β2)受体。
(一)对心血管系统的作用
1.对心脏的作用 肾上腺素和去甲肾上腺素均通过兴奋β受体使心肌收缩力增强,传导速度加快,心肌激惹性增强,易于发生心律失常。对心率的作用:肾上腺素使心率加快,去甲肾上腺素使血压升高引起反射性迷走神经功能亢进,心率减慢。儿茶酚胺使心肌收缩力增强,而心排血量是否增加,则根据对血管的作用不同而有差别。肾上腺素使血管扩张,故心排血量增加。去甲肾上腺素使血管收缩,心内血液排出的阻力增加,故虽然心肌收缩力增强,心排血量并不增加。
2.对血管的作用 肾上腺素对不同部位的血管起不同的作用,对皮肤、黏膜、肾脏的血管而言,肾上腺素使其α受体兴奋,血管收缩;对骨骼肌的血管,肾上腺素使其β受体兴奋,血管扩张。去甲肾上腺素使大多数血管收缩,包括皮肤、黏膜、肾脏、脑、肝、骨骼肌等血管,血管阻力增加,血流量减少。冠状动脉血流量增加,可能是由于冠状动脉和全身血压升高所致。
3.对血压的作用 肾上腺素使心排血量增加、收缩压增加,舒张压下降,脉压差增大。去甲肾上腺素使收缩压、舒张压均升高,对脉压差的影响不大。
(二)对其他系统、器官的作用
1.呼吸系统 肾上腺素有兴奋呼吸的作用,使呼吸频率加快,呼吸运动加深。使支气管平滑肌扩张。
2.胃肠道 肾上腺素使胃肠平滑肌张力及蠕动减弱,使胃肠道括约肌及胆道括约肌收缩。
3.泌尿系 肾上腺素使膀胱平滑肌松弛,使输尿管和膀胱括约肌收缩。
4.子宫 肾上腺素对子宫的作用因剂量大小、动物种类及是否妊娠而不同。肾上腺素使非妊娠子宫松弛,使妊娠子宫收缩。对于人类,在妊娠最后1个月及分娩时,肾上腺素有抑制子宫张力和收缩的作用。
5.中枢神经系统 肾上腺素对中枢神经系统起兴奋作用,提高警觉性。
6.眼 肾上腺素使扩瞳肌收缩,继而瞳孔扩大。使提睑肌收缩,眼显得突出、有神。
7.皮肤 肾上腺素使皮肤血管收缩,皮肤苍白。使立毛肌收缩,汗毛竖起。
8.外分泌 肾上腺素兴奋唾液、胃液、汗液和支气管的分泌,抑制胰液分泌。
(三)对其他激素分泌的影响
交感神经和肾上腺髓质是连接中枢神经系统和内分泌系统的重要通路。去甲肾上腺素和多巴胺是调节垂体激素分泌的重要因素,如多巴胺抑制泌乳素的分泌。下丘脑释放激素也是在交感神经系统的控制之下。血儿茶酚胺及肾内交感神经可调节肾小球旁细胞肾素的分泌。儿茶酚胺抑制胰岛素的分泌,增加甲状腺激素、甲状旁腺激素、降钙素、胃泌素等的分泌。
(四)对代谢的作用
儿茶酚胺促进肝糖原和肌糖原的分解,使血糖升高;促进脂肪分解,释放甘油和游离脂肪酸;增加耗氧及产热。
二、肾上腺髓质激素及代谢产物的测定
(一)检测方法概述
检测血浆、尿液中的儿茶酚胺和(或)儿茶酚胺的代谢产物对于嗜铬细胞瘤、副神经节瘤、肾上腺髓质增生、高血压病、心肌梗死等疾病的临床诊断具有重要意义。鉴于CAs检测在临床诊断和生理、病理、运动医学等研究上的重要性,要求对CAs水平进行特异、准确、快速、实时的测定。常用的CAs检测方法包括高效液相色谱法、荧光法、放射酶学法、电分析化学法、毛细管电泳法、色质联用法等。
1.高效液相色谱法 高效液相色谱法(HPLC)是目前最常用的测定CAs的方法,用不同类型检测器(电化学检测器、荧光检测器等)的HPLC检测CAs是目前研究最多的CAs检测技术,具有灵敏度高,经济、实用、兼容性强等优点。
2.荧光测定法 荧光法也是经常使用的检测CAs的方法,其中最常用的是三羟基吲哚法(THI)和己烯二胺法(EDA)。THI法只能测定总儿茶酚胺(E和NE),其原理是部分纯化的E和NE被氧化成相应的肾上腺素红和去甲肾上腺素红,在碱性条件下,重新排列成肾上腺素黄和去甲肾上腺素黄,在400nm激发后,在505nm处定量测定荧光。EDA法可分别定量E和NE,其原理是经纯化后的E和NE在被氧化后与己烯二胺反应生成有荧光的衍生物,在420nm激发后,测定E衍生物的荧光(510nm)和NE衍生物的荧光(580nm),分别测定E和NE。这两种方法都需要一个或多个纯化步骤(多用柱层析法),以分离甲基多巴、氨苄西林、复合维生素B和咖啡因等干扰物,并且灵敏度和特异性不高。
3.放射酶学法 放射酶学法是另一种常用的测定CAs的方法,可用于研究生理和病理状态下血浆和组织中的CAs的含量。用放射性核素氚标记的S-腺苷甲基甲硫氨酸作为甲基供体,在儿茶酚胺-O-甲基转移酶(COMT)的作用下,将E、NE、DA转变成相应的甲基衍生物,然后进行薄层层析分析,经液闪计数来测得血浆和组织中E、NE、DA的含量。本法的主要优点是灵敏度高,选择性好,可有效地分离并检测E、NE、DA。但本法在应用中受到许多因素的限制:要严格控制测定条件和操作条件,技术难度高;要注意放射性核素的保存和使用,以防止污染;检测速度较慢,结果滞后,难以满足临床诊断的需要。
4.电化学分析法 用于检测CAs的电化学分析法包括化学修饰电极法和光谱电化学法,大多只是用于检测多巴胺(DA)。
5.毛细管电泳法 毛细管电泳法是一种高效能的分离分析技术,具有省时、试剂成本低、样品用量少、适于痕量分析等优点。本法检测CAs的主要优点是不需要进行衍生,分离速度快(分离时间仅需6min),缺点是灵敏度较低难以满足临床诊断的需要。
6.色质联用法 色谱法具有分离效率高、定量分析简便等特点,但定性能力却较差;质谱法具有灵敏度高、定性能力强等特点,但进样要纯,才能发挥其特长。这两种方法联用可以取长补短,取得较好的分离分析效果。
(二)血儿茶酚胺测定
1.基础状态下血儿茶酚胺测定
(1)方法:高效液相色谱法。
(2)正常参考值
①肾上腺素:<480pmol/L(<88pg/ml)。
②去甲肾上腺素:615~3240pmol/L(104~540 pg/ml)。
(3)临床意义:嗜铬细胞瘤在发作时儿茶酚胺明显升高;在非发作时正常或轻度升高。
(4)注意事项
①测定基础状态下血儿茶酚胺时,受检者应放松身心,取仰卧位,不宜直接穿刺采血,而是先静脉插管,休息30min后,从静脉插管内采血。
②必须用装有适当还原剂(以免儿茶酚胺氧化)的冷冻试管盛血,盛血后立即将试管置于冰块上,迅速分离血浆,-70℃保存待测。
③很多药物尤其是与自主神经系统有关的药物影响血儿茶酚胺的水平,α受体和β受体阻滞药及可乐定影响最大,采血前应停用相关药物。
2.胰高血糖素刺激后血儿茶酚胺测定 见胰高血糖素激发试验。
(三)24h尿儿茶酚胺及代谢产物的测定
1.24h尿儿茶酚胺的测定
(1)方法:高效液相色谱法。
(2)正常参考值
①肾上腺素:50~80nmol/24h。
②去甲肾上腺素:40~780nmol/24h。
③多巴胺:200~3500nmol/24h。
(3)临床意义:嗜铬细胞瘤在发作期尿儿茶酚胺明显升高;在非发作期正常或轻度升高。
(4)注意事项:应激状态下尿儿茶酚胺水平升高。影响血儿茶酚胺水平的药物,如α受体和β受体阻滞药,可乐定也可影响尿儿茶酚胺水平。
2.24h尿VMA测定
(1)方法:VMA是肾上腺素和去甲肾上腺素的最终代谢产物,由尿中排出。常用高效液相色谱法检测。
(2)正常参考值:22~35μmol/24h(4~7mg/24h)。
(3)临床意义:嗜铬细胞瘤患者尿VMA升高3~5倍,但在非发作日可正常。
(4)注意事项:留取尿标本时要加浓盐酸防腐。避免影响因素,留尿标本前3d停用单胺氧化酶抑制药、降压药等。
3.24h尿甲氧基肾上腺素和甲氧基去甲肾上腺素的测定
(1)方法:甲氧基肾上腺素和甲氧基去甲肾上腺素分别是肾上腺素和去甲肾上腺素的中间代谢产物,由尿中排出。常用高效液相色谱法检测。
(2)正常参考值
①甲氧基肾上腺素:19~140μg/24h。
②甲氧基去甲肾上腺素:52~310μg/24h。
③总量:95~475μg/24h。
(3)临床意义:嗜铬细胞瘤患者尿甲氧基肾上腺素和甲氧基去甲肾上腺素排量大多高于正常;原发性高血压患者在正常范围。
三、与肾上腺髓质相关的功能试验
(一)激发试验
1.冷加压试验
(1)原理:正常人和原发性高血压病人受到寒冷刺激后,交感神经兴奋引起血压升高,嗜铬细胞瘤病人受到寒冷刺激后血压升高程度不如自身发作。
(2)方法
①试验前停用降压药1周,停用镇静药2d。
②患者卧床休息20~30min,每隔5min测血压1次,待血压稳定。
③将患者左手浸入4℃冰水中,水面至腕关节,停留1min取出。
④自左手浸入冰水开始,15s、30s、60s、90s,以及2min、5min、10min和20min各测右臂血压1次。
(3)结果及临床意义
①正常人血压升高约12/11mm Hg,最大升幅不超过30/25mm Hg。
②原发性高血压或血压不稳定者,在冰水的刺激下血压上升至平时波动的最高值,升高幅度超过药物激发试验。
③嗜铬细胞瘤的血压升高幅度低于正常人和原发性高血压患者,在冷加压试验中的最高血压低于其自身发作时和(或)药物激发试验时的最高血压。
(4)注意事项:血压超过170/110mm Hg者,不宜做此试验。
2.胰高血糖素激发试验
(1)原理:胰高血糖素能刺激嗜铬细胞瘤分泌儿茶酚胺,而不刺激正常的肾上腺髓质分泌儿茶酚胺,使处于发作间歇期的嗜铬细胞瘤患者出现人工诱导发作,予以一定量的胰高血糖素后,观察血压上升的程度及有无临床症状来协助诊断。为观察发作时的临床表现及血和尿的生化改变提供机会。
(2)方法
①试验前停止服用所有降压药7d,停用镇静剂2d。
②试验前空腹平卧休息,建立静脉通道,缓慢滴注生理盐水。
③每分钟测量血压1次,直至血压平稳,连续2~3次血压波动不超过10mm Hg。
④在患者不知情的情况下,迅速静脉推注胰高血糖素1mg。
⑤从注射后开始,每30秒测血压1次,连续3min,以后每分钟测血压1次,直至满15min。
⑥注射前及注射后3min分别取血测肾上腺素和去甲肾上腺素。
(3)结果及临床意义
①正常人或原发性高血压患者血压一般不升高或升高不显著。
②嗜铬细胞瘤患者在注射后15s左右血压急剧升高,比冷加压试验升高20/15mm Hg,或收缩压较基础血压升高50mm Hg为阳性。
③正常人或原发性高血压注射前后血儿茶酚胺无变化。
④嗜铬细胞瘤患者在注射后3min内血儿茶酚胺增加3倍以上,或去甲肾上腺素>11.8nmol/L(2000pg/ml)。
(4)注意事项
①本试验不适宜于血压>170/110mm Hg的患者。
②试验过程中血压上升过高时应立即静脉注射酚妥拉明5mg。
③该试验的阳性率较高,无假阳性,不良反应小,患者易于接受。试验的敏感性、特异性和诊断符合率分别为83.3%、96.3%和95.5%。
(二)阻滞试验——酚妥拉明试验
1.原理 酚妥拉明(即苄胺唑啉)是一种肾上腺素能α受体阻滞药,可阻滞儿茶酚胺的α受体效应,使因儿茶酚胺水平增高引起的持续性或阵发性高血压迅速下降。因此,通过对酚妥拉明的反应,可以判断高血压与嗜铬细胞瘤的关系。
2.方法
(1)试验前1周停用降压药,停用镇静药至少2d。
(2)试验前患者平卧休息,周围环境应安静。
(3)建立静脉通道,缓慢滴注生理盐水。
(4)每分钟测量血压1次,直至血压平稳,持续在170/110mm Hg以上,方可进行试验。
(5)在患者不察觉的情况下,从输液管中缓慢注射(在1min内)酚妥拉明5mg(儿童1mg)。
(6)注射完毕后,每30秒测量血压一次,共3min,以后每分钟测量1次,共10min,或直至血压恢复至试验前水平。于15min和20min再测量血压和心率。
3.结果及临床意义
(1)正常人在注射酚妥拉明后2min血压有所下降,但下降幅度不超过35/25mm Hg。
(2)嗜铬细胞瘤患者在注射2min后,血压明显下降,下降幅度>35/25mm Hg并持续3~5min,或更长时间。
4.注意事项
(1)本试验适宜于血压持续>170/110mm Hg的患者。
(2)本试验有一定危险性,个别病人会出现血压下降过度,甚至出现休克、心脑血管意外,试验前需准备好升压药品去甲肾上腺素,若血压下降过低可立即给予升压药。
(3)试验前应用降压药、镇静药、麻醉药可出现假阳性。试验前1周避免使用降压药或缩血管药,试验前48h停用所有药物。
(4)为避免静脉穿刺引起的应激反应,应先建立静脉通道,输注生理盐水,受检者卧床休息至少30min后才开始用酚妥拉明。
(5)肾功能不全者禁用。
(欧阳金芝)
参考文献
[1]陈敏章.中华内科学.北京:人民卫生出版社,1999:3092-3094.
[2]叶章群.肾上腺疾病.北京:人民卫生出版社,1997:96-99.
[3]刘明杰,朱业湘.儿茶酚胺类神经递质检测技术及研究进展.中国卫生检验杂志,2002,12(4):501-503.
[4]Comparison of diagnostic accuracy of urinary free metanephrines,vanillyl mandelic Acid,and catecholamines and plasma catecholamines for diagnosis of pheochromocytoma.Boyle JG,Davidson DF,Perry CG,Connell JM.J Clin Endocrinol Metab,2007,92(12):4602-4608.
[5]Plasma chromogranin A or urine fractionated metanephrines follow-up testing improves the diagnostic accuracy of plasma fractionated metanephrines for pheochromocytoma.Algeciras-Schimnich A,Preissner CM,Young WF Jr,Singh RJ,Grebe SK.J Clin Endocrinol Metab,2008,93(1):91-95.
[6]Comparison of Diagnostic Accuracy of Urinary Free Metanephrines,Vanillyl Mandelic Acid,and Catecholamines and Plasma Catecholamines for Diagnosis of PheochromocytomaJames G.Boyle,D.Fraser Davidson,Colin G.Perry,and John M.C.Connell J Clin Endocrinol Metab,2007,92:4602-4608,.
[7]Norlela Sukor,MD,MMed,Rashidi Saidin,MBBS,MMed,and Nor Azmi Kamaruddin,MBBS,MMed-Southern Medical Journal,2007,100(1):73-74.
[8]Pheochromocytoma Linda Kay Cook,AJN,2009,109(2):50-53.
[9]邢艳霞,余卫平,任慕兰,等.HPLC-FD法检测尿儿茶酚胺.东南大学学报(医学版),2004,23(3):188-192.
[10]邓向军.高效液相-荧光检测法测定尿液中儿茶酚胺类化合物的含量.安徽医药,2007,11(1):44-45.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















