脂肪组织衍生干细胞获取便利、来源丰富,并可向多种组织分化。它们为组织的再生修复治疗提供了有利条件。影响脂肪沉积中脂肪组织衍生干细胞的活性与产量的因素很多,例如脂肪组织的类型、手术方式、获取部位和培养条件(例如培养基、细胞密度、聚苯乙烯培养皿等)。有研究对比了手术切除和两种常用的抽脂术方法,发现相对于超声吸脂和切除手术,肿胀麻醉抽脂术取得的脂肪组织衍生干细胞产量和细胞倍增率更高。进一步的研究比较了通过肿胀抽脂的方法从不同脂肪沉积部位获取的脂肪组织衍生干细胞量,发现相对于大腿,腹部抽脂可以获得数量更多的脂肪组织衍生干细胞,但是从大腿收获的脂肪组织衍生干细胞还是要比从骨髓获得的骨髓干细胞(bone marrow stem cells,BMSC)更多。
脂肪组织中存在一种叫作基质血管碎片(SVF)的特殊细胞群体,基质血管碎片中含有未分化的干细胞和免疫细胞、内皮(血管内里)细胞、祖细胞(未分化或者未成熟的祖细胞)和基质(结缔组织)细胞。从基质血管碎片中制备干细胞的一般方法是采用胶原酶消化分解组织,离心并过滤碎片。人类间充质干细胞(MSC)应当具备以下特征:贴壁性、表达特定表面抗原和多向分化潜能。同一克隆来源的脂肪组织衍生干细胞应当能够在组织培养瓶中生长增殖,应用流式细胞仪检测可见细胞表达表面标志物(CD29、CD44、CD73、CD90和CD105)。
当前的细胞扩增和储存技术还存在着诸多根本性的挑战。为了着眼于未来的临床应用,我们就必须致力于发展良好的操作规范。目前的体外培养方法都需要应用来自不同种属的细胞因子和生长因子的混合物来促进干细胞的增殖和分化,这些添加剂和培养液具有引发感染的潜在风险,因而可能导致移植排斥反应。人们建议可以应用富含血小板的人自体血清,以期在未来代替胎牛血清。已有研究发现长期的体外培养会改变脂肪组织衍生干细胞的表型,从而在免疫缺陷小鼠体内形成肿瘤。人们正在对低温保存技术进行研究,以期改善新鲜分离或者冷冻的脂肪组织衍生干细胞的长期储存技术。这些成果都会为日后体外培养及临床应用提供大量的活性脂肪组织衍生干细胞。
(一)骨髓干细胞与脂肪组织衍生干细胞的对比
目前细胞治疗和组织工程所面临的最大挑战就是寻找合适的细胞来源,后者可以完成替换或重建特定组织的功能。因其同样具有多能分化、免疫抑制和血管生成特性,骨髓干细胞与脂肪组织衍生干细胞均为合适的候选细胞。人们对于骨髓干细胞的在体和体外研究已经进行得比较广泛和深入,这些细胞现已被用作骨组织、软骨、肌肉及造血细胞等组织的再生细胞来源。但是骨髓干细胞的收获方法使得获取大量细胞受到限制。并且,随着供者年龄的增长,细胞在体外培养所需的时间也相应延长。脂肪组织含有丰富的干细胞,利用微创技术,这些细胞可以从单一样品中衍生出来。另外,通过骨髓干细胞和脐带血干细胞的比较性研究发现,脂肪组织衍生干细胞与后两者不仅表达类似的表面标志物,还同样上调25种相同基因的水平。近期的研究表明,脂肪组织衍生干细胞、骨髓干细胞和声襞成纤维细胞(vocal fold fibroblasts,VFF)表达的标志物相同,并具有同样的多能分化性。研究结果指出间充质干细胞存在于声襞固有层。还有研究表明,脂肪组织衍生干细胞同骨髓干细胞一样对不相容的同种异体组织具有免疫抑制作用,从而防止移植物抗宿主反应的发生。
在单一的术式中把自体干细胞的获取、分离、分化和回输结合在一起,这种治疗方法还面临极大的挑战。与骨髓干细胞相比,脂肪组织衍生干细胞具有很大的优势,这是因为脂肪组织可从腹部轻易获取并能产生足够的脂肪组织衍生干细胞用于细胞治疗。然而,从基质血管碎片分离脂肪组织衍生干细胞必须要经过体外培养,或者应用流式细胞仪进行磁性分离,非常耗时。目前人们已经开发出成功的手术技术可以应用基质血管碎片和生物材料支架来定向分化这些脂肪组织衍生干细胞。有些研究发现基质血管碎片可以引起T细胞增殖反应,因此对基质血管碎片的免疫原性目前还存在争议。而且对于分离出来的脂肪组织衍生干细胞和基质血管碎片在临床疗效上的比较,还需要进一步的研究。
(二)多向分化
脂肪组织衍生干细胞凭借其巨大的临床潜能和多能分化能力,为耳鼻咽喉科学-头颈部矫形外科的修复重建治疗提供了有力的帮助。通过吸脂手术体外分离得到的人脂肪祖细胞表现出类似成纤维细胞的表型,并可定向分化为脂肪(脂肪细胞)、软骨(软骨细胞)和骨组织(骨细胞)(图19-1)。细胞表达组织发育、体内平衡和修复过程中需要的基因转录表型,包括以下的细胞表面受体:多能分化能力识别标记CD105、STRO-1和CD166;全能干细胞标记CD117;血管新生相关标记CD29;细胞黏着、迁移标记CD44和细胞黏着标记CD49。
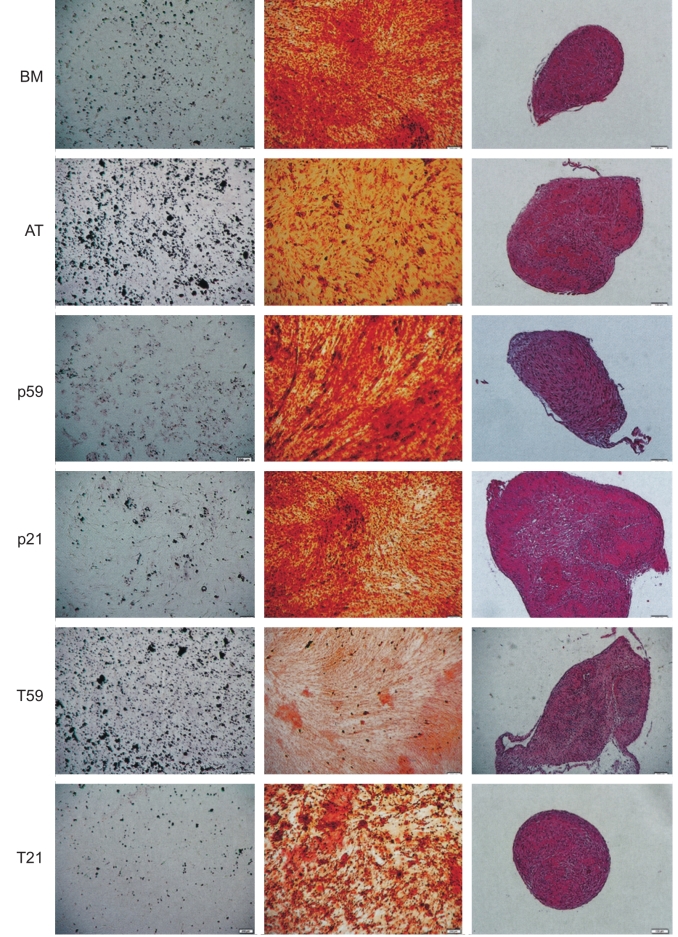
图19-1 ADSC的分化潜能。显微镜下图片观可见人声襞成纤维细胞(hVFF)细胞株p59、p21、T59、T21和骨髓(BM)以及脂肪组织(AT)衍生的间充质干细胞在成脂、成骨和软骨形成方面的比较。油红O染色显示脂肪空泡染色为红色,茜草色素染色显示钙结晶沉积染色为橘色或棕色,番红精染色显示软骨特异性黏多糖
1.脂肪细胞 脂肪组织衍生干细胞可在体外分化成为脂肪细胞,并可用于面部或声带缺损的填充治疗。尽管脂肪组织衍生干细胞的使用与目前临床应用的脂肪细胞填充有很多类似之处,但其在可靠性和有效性方面还是有所区别的。脂肪移植的效果可变性较大,易受到脂肪分离的方式、脂肪吸收和血管化受限等因素的影响。此外,由于脂肪组织是由同质细胞组成的群体,无法估算出单位组织内脂肪组织衍生干细胞的确切数量或在细胞基质中的构成比,因而也就无法得知一个成功移植所需的确切细胞数量。脂肪组织衍生干细胞可在体外经胰岛素、磷酸二酯酶抑制药(IBMX)、地塞米松和吲哚美辛的诱导分化为成熟的脂肪细胞,分化细胞的各种属性与正常脂肪细胞相比没有差异,包括用于脂肪分解、能量储存的三酰甘油以及脂肪特异性蛋白、瘦蛋白。此外,研究还发现供者的年龄与体重指数并未影响脂肪组织衍生干细胞的分化和功能。
2.软骨细胞 钝性创伤、慢性炎症、关节不稳或手术破坏所导致的软骨组织损伤,可在不破坏其整体完整性的情况下损伤关节基质。软骨组织可为耳、鼻、咽喉等区域提供支撑作用,其构成包括Ⅱ型胶原、蛋白多糖和软骨细胞。由于局部缺乏淋巴或血管组织,使得细胞很难迁移到软骨组织发挥合成修复活性。
目前唯一通过FDA认证的重建软骨的标准方法是从患者的肋骨、鼻或耳部收获自体软骨细胞,进行体外扩增。该技术的明显缺陷在于可获取组织的有限性以及对供区所造成的损伤。
脂肪组织衍生干细胞可以很容易地转化替代功能组织内的缺失成分。在标准细胞培养液中添加转化生长因子β(TGF-beta)和骨形态蛋白(BMP-6)以增加Ⅱ型胶原和软骨特异性糖蛋白的表达,可诱导脂肪组织衍生干细胞增殖分化为软骨细胞。当前的研究关注于建立针对分离同源性脂肪组织衍生干细胞的特异性细胞标志,以提高其分化效力。近来有报道称CD105阳性的脂肪组织衍生干细胞细胞群可能具有更强的体外软骨分化潜能。而细胞膜糖蛋白CD105在脂肪组织衍生干细胞上的出现,可为转化生长因子β提供受体复合物,从而提高其增殖、迁移和分化能力。
3.骨细胞 由于缺乏生长因子和蛋白及周围软组织的长入,颅面部骨组织的缺损很容易造成创伤的不全修复。而面部和鼻部的骨性部分是由Ⅰ型胶原、糖蛋白和蛋白多糖等组成的基质组织构成。当损伤发生后,骨质的重建需要调整成骨与溶骨之间的动态平衡,由成纤维细胞、软骨细胞和成骨细胞向缺损区迁移开启修复过程。这些未成熟细胞分泌纤维蛋白填充创伤缺损。在愈合后期,软骨驱动软骨内骨化及细胞外基质(extracellular matrix,ECM)矿化。
采用种植细胞进行骨骼重建的治疗方法对支架的生物材料有很高要求,后者必须具备内部的高度稳定性和体表的可附着性才有利于骨表层生长。人们已发现有多种方法可使脂肪组织衍生干细胞向成骨细胞分化。已经证实,经胰岛素样生长因子(insulin-like growth factor,IGF)和血小板衍生生长因子(platelet-derived growth factor,PDGF)的途径是增强人脂肪组织衍生干细胞体外成骨作用的关键信号转导途径。脂肪组织衍生干细胞在成骨化过程中可表达成骨细胞表型、ALP和骨钙蛋白,并伴有钙质的沉积增加,后者预示着细胞具有矿化细胞外基质的能力。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














