一、细菌移位的概念
1966年Wolochow等首先把肠道内细菌通过黏膜的迁移过程定义为“细菌移位”,目前公认的概念是寄生于肠道的肠道微生物及其毒素越过肠道黏膜进入正常是无菌的黏膜组织和肠壁内、肠系膜淋巴结、门静脉及其他远隔脏器或系统的过程为细菌移位。
早在20世纪50年代Fine等就提出细菌及内毒素可从肠道“漏出”,引起全身感染和不可逆休克。然而以上见解没得到重视,细菌移位的重要性被忽视了20余年。
20世纪70年代许多学者提出MODS的原因是体内存在未能控的感染灶,认为如临床未发现肯定发的感染灶,则应进行剖腹探查。嗣后,对MODS病人大量的探查却发现绝大多数病人无论在临床上还是尸检中体内均不存在感染灶。人们也注意到感染、创伤、烧伤及心力衰竭等各种不同原因发展到一定时期都表现为相同的可以预料的临床和病理过程,即导致MODS。为何不同病因时机体的临床过程如此相同呢?其共同的原因是什么呢?肠道革兰阴性杆菌内毒素引起感染性休克致MODS是临床上已知的事实,而且MODS病人易发生院内感染,且多来源于肠道微生物的自身感染。以上事实导致一种假设:各种打击可造成肠道屏障衰竭,肠道内微生物及毒素,尤其是细菌内毒素可侵犯肠腔外组织,这可能是MODS的共同原因。Goris从动物实验中证明了以上假设。由此,肠道屏障功能及细菌移位概念及其重要性为人们所认识。现已证实,机体在休克早期,但血流动力学指标如血压、脉搏和心排血量以及血氧尚正常时(休克代偿期),内脏血流量,尤其肠道黏膜血供首先受累,肠黏膜氧饱和度下降。现可用肠道测压装置测定胃肠黏膜内pH,判定黏膜缺氧程度:肠黏膜缺氧致黏膜损伤,进而细菌移位,激发机体反应,细菌移位数量大、机体免疫力低、机体反应失控时导致MODS。
二、细菌移位的原因
肠道屏障功能损伤是细菌移位的原因。肠道屏障可分为两部分见表18-1。
表18-1 肠黏膜屏障损伤原因

其一是肠黏膜以外防止细菌移位的支持系统,主要包括肠道正常菌群构成的生物屏障,健全的免疫系统构成的免疫屏障和合适的营养摄入。这些支持系统失常本身不直接损害胃肠黏膜的完整性,但使黏膜易于受损并降低黏膜更新、修复能力。
正常肠道菌群中专性厌氧菌占主导,其数量超过G-菌1 000~10 000倍,这种以肠道厌氧菌为绝对优势的肠道菌群在肠道内的定植性、繁殖优势及排它性大大限制了有致病作用的肠道微生物及其毒素与黏膜上皮接触,有人把这种生物屏障称之为“群集防御”。专性厌氧菌对抗生素敏感,医院内广谱抗生素的广泛应用致肠道菌群失调,从而损害了这种肠道的生物屏障。肠是人体最大的免疫奇器官之一,肠黏膜间质中存在的T、B淋巴细胞和浆细胞等在一定的免疫刺激下产生分泌型IgA(SIgA),它在肠内可选择性地包绕细菌或内毒素,形成抗原抗体复合物,防止细菌、毒素黏附于肠黏膜,而且这种免疫复合物可刺激肠黏液分泌,加速黏液层流动,有利于病原体和毒素排出。一旦细菌及毒素越过肠黏膜移位到肠壁内以至肠外,肠壁和肠系膜淋巴组织及肝、脾内网状内皮系统等防御机制起到吞噬、解毒的作用。免疫系统受损,侵入的细菌和毒素易于进入体循环及其他组织。不能正常从肠道摄食使胃肠道处于无负荷状态,黏膜缺少食物及消化道激素的刺激、因而胃酸、胆汁、溶菌酶、黏多糖和蛋白分解酶等物质分泌减少,肠液化学杀菌作用减弱,可促使肠道致病菌繁殖。有作者发现,胆汁内的胆盐可与内毒素结合成难以吸收的去污剂样复合物,有助于防止内毒素入侵。
此外,不能从肠腔或循环中摄入足够的营养底物,导致黏膜萎缩、黏膜群减少。黏膜变薄不一定造成黏膜完整性或通透性改变,但它使黏膜抵抗各种损伤因子能力下降,黏膜更新、修复能力下降,同时降低机体免疫力,故正常的营养支持是肠黏膜屏障的重要条件。
其二是胃肠黏膜本身,它是防止细菌移位的基础和主要屏障。各种理化和病理原因造成黏膜通透性证增加,结构破坏是细菌移位的基本原因。炎性肠道疾病,放疗及对黏膜有致伤作用的药物使黏膜破坏、脱落或溃疡,可造成细菌移位。
临床上最重要的是严重创伤、感染、烧伤、出血性休克等原因造成胃肠黏膜组织低灌注、低血氧,特别是内毒素休克导致黏膜氧耗增加。以上原因均使黏膜细胞缺氧、无氧代谢和黏膜组织酸中毒导致黏膜结构破坏。这是临床上细菌移位导致NODS的重要原因。
内脏循环血量占全身循环血量的30%,机体在应激状态下,存在有神经—内分泌介导的适应性反应,即选择性内脏血管痉挛以保持心脏、脑和骨骼肌等重要脏器的氧输送,但代价是内脏供血受损,其中又以肠黏膜受损最早。测定黏膜内pH是早期发现黏膜缺氧的最好指标。
Dogllo等发现,进入ICU病房时及12h后黏膜内pH均低者病死率达87%,进入ICU时pH降低12h后恢复正常者病死率是36%,进入ICU时及12h后pH均正常者病死率是27%,进入ICU时黏膜内pH正常但12h后发生黏膜内酸中毒者病死率是68%。以上证明黏膜内pH测定对判定危重病人预后比目前ICU应用的血流动力学指标可靠的多。黏膜内pH反映黏膜缺氧及损伤情况,黏膜损伤造成病人死亡显然和细菌移位有关。以上结果反过来证明应激状态下细菌移位的基本原因是黏膜缺氧和损伤。黏膜缺氧致黏膜破坏的机制有以下几方面。
1.缺氧,酸中毒本身可致细胞代谢障碍,组织损伤。
2.氧自由基介导的再灌注损伤是黏膜损伤最重要的原因。
上述缺氧期黏膜的表浅损伤仅限于一定程度,但再灌注期由氧自由基介导的损伤可逐渐加重,使黏膜严重损伤以至不可逆。
人体肠道黏膜内有丰富的黄嘌呤脱氢酶,缺氧时迅速转化为黄嘌呤氧化酶。缺氧情况下黏膜内ATP降解为次黄嘌呤并大量积累。一旦再灌注,在有氧的条件下,黏膜缺氧时大量积累的次黄嘌呤在黄嘌呤氧化酶催化下生成黄嘌呤,而O2变成超氧化物O2-,接着产生大量次生的细菌毒性物质氢氧根离子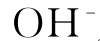 及过氧化氢H2O2。这些氧化物均有很强的细菌毒性,使黏膜细胞受损。
及过氧化氢H2O2。这些氧化物均有很强的细菌毒性,使黏膜细胞受损。
3.胃肠黏膜缺氧损伤情况下,正常存在于肠内的盐酸、胆盐、细菌、细菌毒素、蛋白酶及其他消化酶可增加肠黏膜及其他组织损伤。
4.细胞因子和炎性介质在引起黏膜损伤中的作用尚不清楚。内脏组织,特别是肠组织中存在丰富的巨噬细胞和淋巴细胞。巨噬细胞被内毒素激活产生肿瘤坏死因子(TNF),白介素(IL-I,IL-6),并激发血小板激活因子(PAF),激活血凝系统,激活中性粒细胞使与皮内细胞黏附,激活补体成分,以及产生前列腺素,白烯酸和血栓素等发生四烯酸的代谢物。以上细胞因子及炎性介质均有细胞毒作用,引起组织水肿、破坏。有报告显示在内毒素攻击下,动物肠组织TNF和PAF增加,肠缺血坏死。
Dritch等证实,黏膜损伤和细菌移位不是通过激活的补体,TNF及PAF等介导的,是由黄嘌呤氧化酶介导的。显然,细菌移位发展为全身炎症反应时,以上细胞因子,炎性介质及氧自由基均可造成肠及肠外组织如心、肺、肾等受损导致MODS。反过来多脏器,多系统损伤又加重肠黏膜缺氧、坏死和细菌移位,造成恶性循环。
氧自由基、细胞介质及炎性介质本身是机体应激产物,是机体清除入侵微生物及毒素,清除坏死组织的反应性产物。对抗体是有利的。机体存在自控机制使这些活性物质控制在一定水平。如体内存在内源性酶和非酶性氧化物清除剂。不断清除少量氧化物。但在严重创伤、感染、缺血时以上活性物大量产生,机体控制失调。且以上活性物质呈不断循环的逐渐加大的相互激发的瀑布样(cascad)反应。肠黏膜损伤逐渐加重,衰竭,终致不可逆损伤。黏膜缺氧程度及延续时间长短不同,造成的损伤程度各异,从黏膜血管通透性增加,黏膜上皮水肿,上皮通透性增加,上皮从绒毛顶开始的脱落到黏膜全层脱落和黏膜下断裂不等,细菌移位也随之加重。黏膜缺血也产生心肌抑制因子,加重MODS的进展。
三、细菌移位的预防和治疗
实际上,少量的细菌和毒素移位是经常发生的,可对机体保持经常的免疫刺激,对免疫系统是有利的。侵入的微生物和毒素不断被机体免疫系统清除。以上这种不影响机体平衡的细菌移位是正常的。即使黏膜有轻度或局部病变也不构成黏膜屏障功能衰竭。进入的细菌及毒素也是有限的。只有在特定情况下,内脏循环缺血,致肠黏膜广泛和严重通透性及结构改变时,加上肠内菌群失调,免疫功能受损,细菌及毒素得以大量侵入组织及循环造成内环境失调时才构成肠黏膜屏障衰竭。
黏膜屏障衰竭,大量细菌移位一旦发生,目前还很难阻断由活性物质激活的一系列连锁反应,所以黏膜屏障衰竭的预防是首要的,主要的预防措施有:
1.严重创伤时,迅速纠正休克,减少肠黏膜缺血时间,尽早清创,正确处理伤口,防止继发感染。
2.尽早发现和控制体内感染灶,及早引流脓肿,避免全身感染。全理使用抗生素,围手术期抗生素应在术后短期内停止,抗菌谱应尽可能窄,针对性强。
3.监测黏膜内pH,尽早发现黏膜缺氧,一旦黏膜酸中毒就应尽早纠正。Herndon认为烧伤后肠系膜血管痉挛,缺血致细菌移位是血栓素介导的,可用选择性地对抗内脏血管痉挛的硝基盐类药物对抗。Reilly等认为循环休克引起的肠血管收缩是由血管紧张素Ⅱ引起的,可用血管紧张素转化酶的抑制药对抗。
4.营养支持对增强黏膜抗损伤能力及修复能力极为重要。
一旦肠黏膜广泛缺氧、衰竭、大量细菌移位发生,则应尽早在黏膜发生不可逆损伤前采取对抗措施,终止恶性循环。按黏膜损伤机制,可采取的措施见表18-2。
表18-2 抗黏膜缺氧损伤措施

表列的特殊措施目前基本上仍处于动物实验阶段,虽不少以用于临床,但结果有待于总结。此外,从作用机制来看,需早期使用才能具备保护和阻断作用。如内毒素抗体只有尽早使用才能不断中和进入体内的内毒素,一旦内毒素大量入体已激发各种活性因子,用抗体对抗为时已晚。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















