蛋白质的功能不仅与一级结构有关,而且有赖于复杂的空间构象。蛋白质天然构象的轻微变动有时并不完全扰乱二、三、四级结构即可使其功能丧失。
(一)蛋白质变性与功能
蛋白质的变性即是一级结构不变,而破坏各种次级键导致蛋白质构象(二、三、四级结构)变化的过程。如核糖核酸酶在变性因素作用下,使分子内次级键破坏导致原本排列有序的空间结构破坏,整个分子处于伸展状态,丧失催化功能。如经复性处理,多肽链又可从伸展状态卷曲成天然构象,进而恢复其催化功能,这现象说明只有一级结构的正常氨基酸序列,而无正确的天然构象,也不能执行正常的生物学功能。
(二)蛋白质变构效应
蛋白质变构效应(allosteric effect of protein)是指一些小分子的配体与蛋白质非活性中心部位结合后导致其构象改变,进而引起功能改变的现象。由别构效应引起的蛋白质构象变化,可使该蛋白质更适合于功能的需要。有关结构及功能密切相关研究中,研究最多的两种球状蛋白质是肌红蛋白和血红蛋白。这里以血红蛋白为例说明其别构效应与功能的关系。
血红蛋白是由4个亚基α2β2组成的寡聚蛋白,α链由141个氨基酸残基组成,β链由146个氨基酸残基组成。每个亚基结构与肌红蛋白相似含有A、B、C、D、E、F、G、H 8个肽段。每个亚基中间有一个疏水口袋样区域,每个亚基有一个血红素,位于其疏水口袋中间,血红素上的Fe2+能与氧可逆结合。血红素是铁卟啉化合物,由原卟啉Ⅸ与Fe2+组成。它由4个吡咯环通过4个甲炔基相连成环状,Fe2+位于环中形成6个配位键,其中4个与吡咯环N原子相连,第5个电子与血红蛋白F螺旋段F8组氨酸咪唑基N配位,第6个电子则与氧配位结合,空间位置上接近血红蛋白的第64位组氨酸。血红蛋白亚基之间由许多氢键和盐键(8个)相连,使4个亚基紧密结合形成亲水的球状蛋白质(图3-18)。
血红蛋白与肌红蛋白都能可逆地与氧结合,氧饱和度(氧合血红蛋白占总血红蛋白的百分数)随O2浓度变化而改变。血红蛋白的氧结合曲线为S形曲线,肌红蛋白的氧结合曲线是矩形双曲线(图3-23)。该曲线说明肌红蛋白易与O2结合,而血红蛋白在O2分压较低时不易与O2结合,并且血红蛋白由4个亚基与氧结合时平衡常数不同,即第一氧分子与α亚基结合的平衡常数最小,而血红蛋白最后一个β亚基与氧结合的平衡常数最大。这说明当第一氧分子与血红蛋白结合形成氧合血红蛋白后,血红蛋白发生构象改变,促使第二、三和四氧分子与其他亚基结合速度大大增加,这种效应称为正协同作用。一个亚基与其配体结合后能影响寡聚体中另一亚基与配体的结合能力的现象称为协同效应(cooperative effect),如果是促进作用即称为正协同效应(positive cooperativity),反之则称为负协同效应(negative cooperativity)。血红蛋白之所以能出现此协同作用,是其亚基中血红素与氧结合引起血红素的构象改变而产生的,属于变构效应(allosterism)。Peruts等利用X线衍射技术分析血红蛋白和氧合血红蛋白结晶的三维结构图谱,提出血红蛋白与O2结合过程中结构变化的模型,并称这类结构变化为变构效应。这种变构效应也见于一些酶和其他蛋白质,是调节蛋白质功能的一种重要机制。如神经细胞膜上的特殊蛋白质大分子就是通过自身的变构作用完成学习机制的基本过程。另外,细胞膜蛋白质、酶蛋白质、受体蛋白、离子通道蛋白都具有变构效应,是学习、记忆过程的物质基础。
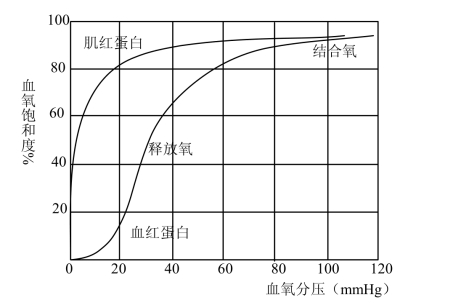
图3-23 血红蛋白和肌红蛋白的氧解离曲线
血红蛋白与氧结合时伴有血红素Fe2+的位置改变,脱氧血红蛋白分子中Fe2+半径比卟啉环中间的孔隙要大,因此Fe2+高出卟啉环平面0.075 nm,而靠近肽链F8肽段的His残基。当第一氧分子进入Fe2+的第6个配位时,使Fe2+半径变小,并进入卟啉环中间的孔隙内,使血红素平面变得平坦(图3-24),进而引起F肽段EF拐弯和FG拐弯等移位,使两个α亚基间离子键断裂,导致亚基间结合松弛利于第二氧分子与亚基结合,依次促进第三、四氧分子与亚基结合,最后使四个亚基由T型变成R型。血红蛋白与O2结合呈现的变构效应对运输氧的功能是十分重要的,它保证了血红蛋白在氧分压高的肺内可达95%氧饱和度,蛋白质空间构象利于氧的吸收;而在氧分压低的肌组织中氧饱和度仅达10%,利于氧的释放。

图3-24 血红素与O2结合
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















