如上所述,通常我们提到的药物相关基因分别编码:药物代谢酶、药物转运蛋白、离子通道和受体等。这些基因的多态性决定了药物最终会产生个体差异,如下以药物在体内代谢的过程来分析药物相关基因多态性对药物疗效的作用。
(一)药物在体内发生药效作用的过程
药物在体内发生药效的过程涉及“药动学”和“药效学”两个学科。药动学是研究药物或代谢产物在体内的转运及到达靶位点的过程,包括药物的吸收、分布、代谢及排泄。而药效学则是研究药物到达作用点后发挥其治疗作用或副作用的过程,包括药物作用的靶基因及其表达的蛋白质(酶或细胞膜受体)、信号传导途径等。
(二)药物作用的个体差异是上述两个过程综合作用的结果
药物进入体内发挥作用至被清除是一个复杂的过程,在这一过程中,会涉及许多与药物作用相关的基因。其中,药物代谢酶及药物转运体的多态性影响药动学过程,而药物靶目标及疾病相关途径的多态性则影响药物的药效学过程。个体对药物反应的最终差异可视为这两个过程结合的产物,也就由此产生了药物作用的个体差异。所以需要根据个人基因的不同,采取个体化的用药方式。
1.药动学过程 药物在体内的药动学过程包括吸收、分布、代谢和排泄过程。在该过程中涉及的代谢酶或者转运体的多态性,就会影响药物在体内最终的作用效果。
(1)药物代谢酶的基因多态性与药物效应:药物代谢过程也就是生物转化过程,该过程可分为Ⅱ相,在这Ⅱ相过程中对应的药物代谢酶,见表3-2。
表3-2 药物在代谢过程中对应的药物代谢酶
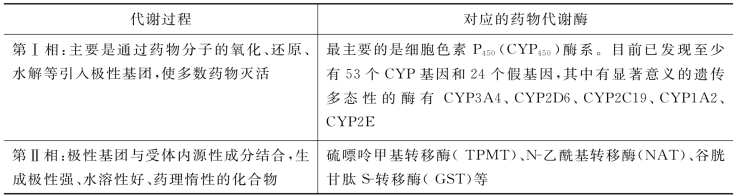
在第Ⅰ相过程中需有药物代谢酶的催化,其中最主要的代谢酶是细胞色素P450(CYP450)酶系。目前已发现至少有53个CYP基因和24个假基因,其中有显著意义的遗传多态性的酶有CYP3A4、CYP2D6、CYP2C19、CYP1A2、CYP2E。当药物在体内被某种CYP450氧化代谢时,CYP450基因多态性会导致临床上个体表型的差异,强代谢者对相应药物治疗可能出现抵抗性,而弱代谢者则可能因为过高的血药浓度而出现中毒。笫Ⅱ相为极性基团与受体内源性成分结合,生成极性强、水溶性好、药理惰性的化合物。这些药物代谢酶的基因差异影响酶的作用时,就会影响药物的疗效和不良反应。例如,抗高血压药异喹胍,由于基因变异会导致慢代谢,在英国一项临床试验中,使用异喹胍治疗高血压时引起一例死亡,其后发现这个病人对这种药物几乎不能代谢;β2受体阻滞药普萘洛尔,不同个体的血药浓度最多可相差20倍。
Ⅰ相代谢酶系(CYP450酶系):药物代谢过程中主要的CYP450酶有CYP3A4、CYP2D6、CYP2C19、CYP1A1、CYP2A1、CYP2C9、CYP2E1等。
A.CYP3A4:是代谢药物最多的一种代谢酶,它代谢目前市场上55%的常用药物,如乙酰氨基酚、卡马西平、洛伐他汀、硝苯地平、长春碱等。现已发现CYP3A4的变异体近20种,不过能导致个体对药物反应改变的不多。(表3-3)为由CYP3A4代谢的主要常用药物。
表3-3 CYP3A4代谢的常用药物

大多数临床口服药物在体内需经CYP3A4的代谢转化,而许多常用药物又是CYP3A4的强诱导剂或抑制剂。如地塞米松、利福平及卡马西平等是CYP3A4的强诱导剂,当它们与经CYP3A4代谢的药物合用时,能大大增加后者的代谢速率。相反,酮康唑、咪康唑、红霉素、硝苯地平等是其重要的抑制剂,当它们与经CYP3A4代谢的药物合并用药时,能减少后者的代谢速率。需要说明的是酶诱导促使药物代谢增加,但并不一定导致药物作用下降,作用维持时间降低。因为有些药物的代谢产物与原药的药理活性是相同的,也有些药物其代谢产物活性甚至大于原药的药理活性。这种情况下,酶促作用反而加强药物疗效。
CYP3A4存在多种诱导机制和抑制机制,CYP3A4的诱导剂与抑制剂,见表3-4。
表3-4 人体内CYP3A4的主要诱导剂与抑制剂

B.CYP2D6:它是代谢药物种数仅次于CYP3A4的代谢酶,是细胞色素药物代谢酶中较为重要的一种,由497个氨基酸组成。除参与代谢一些内源性物质某些环境中毒性化合物外,主要是参与多种重要药物的代谢,包括多种抗心律失常药、β1受体阻滞药、抗高血压药及三环类抗抑郁药等。CYP2D6参与代谢的药物占总P450代谢药物的30%。研究还发现CYP2D6对药物的代谢呈现明显的个体和种族差异。CYP2D6在人群中可分为弱代谢型(poor metabolism,PM)、中间代谢型(intermediate metabolism,IM)、强代谢型(extensive metabolism,EM)和极快代谢型(ultraextensive metabolism,UEM)四种表型。PM的发生是由于基因突变造成表达产物酶分子的改变,从而产生代谢缺陷,如CYP2D6*5。IM者应属于快代谢者中较慢的一部分,但又与慢代谢者差别很大,产生的原因是基因的突变导致酶的活性微略降低,如CYP2D6B(CYP2D6*10A)、CYP2D6J(CYP2D6*10B)。EM是正常人群的代谢表型,是纯合子正常等位基因产生的正常酶表达,但部分杂合子因为拥有一份正常等位基因,酶蛋白仍表达,也常表现为EM,如CYP2D6*1/*2的代谢能力较*1/*1野生型无统计学差异。UEM则是由于出现CYP2D6L(CYP2D6*2)。现已发现CYP2D6的变异体已超过80种。其中15种单核苷酸多态性可导致无功能的产物,8种引起移码突变,2种引起剪接缺陷,5种错义突变造成翻译提早终止或活性位点改变;但也有相反的,可引起酶活力增加。影响CYP2D6活性的因素有多种,饮食可能也是影响CYP2D6的重要因素。但年龄并不影响CYP2D6的活性。怀孕可以诱导CYP2D6,使酶活性升高,孕期使用由CYP2D6代谢的药物时会发生药物代谢和疗效改变的现象,要注意用药剂量的调整。经CYP2D6代谢的常用药物(表3-5)。
表3-5 CYP2D6代谢的常用药物

CYP2D6的底物均为其竞争性抑制剂,另外,有研究报道的较强抑制剂有20余种(表3-6)。这些药物可抑制CYP2D6的活性,使药物代谢消除减慢,血药浓度升高,不良反应发生率升高,甚至出现毒性反应。
表3-6 人体内CYP2D6的主要抑制药

C.CYP2C19:它位于第10号染色体q24.1~q24.3区带上,编码490个氨基酸,具有9个外显子,主要存在于肝脏微粒体内。现已证实CYP2C19为代谢S-美芬妥英的氧化酶,也称S-美芬妥英4’-羟化酶。根据该酶的活性大小,人群有强代谢者(EM)和弱代谢者(PM)之分。S-美芬妥英羟化代谢多态性不仅存在个体差异,而且存在种群差异。即不同种群之间,PM的发生率存在显著差异。白种人群中PM的发生率为3%~5%,而东方人中PM的发生率高达13%~23%。中国人的总PM发生率为14.32%。编码正常酶活性的基因是CYP2C19*1。目前发现CYP2C19至少存在14种突变基因,18种等位基因。中国人中CYP2C19PM表型几乎均为CYP2C19*2和CYP2C19*3,罕见突变基因仅发现CYP2C19*5。不同民族的CYP2C19酶活性差异相关,成为它们之间酶活性种族差异的遗传基础。影响CYP2C19活性的因素有多种,但CYP2C19基因对CYP2C19酶活性的影响起着决定性的作用,在不同的基因型个体中,酶含量也不相同,表现出正常基因纯合子>正常基因与突变基因杂合子>突变基因纯合子。酶活性的改变会发生药物代谢和疗效改变的现象,要注意用药剂量的调整。
CYP2C19底物主要有胺碘酮、卡立普多、西洛他唑、西酞普兰、氯巴占、去氧孕烯、依他普仑、美芬妥英、奥美拉唑、雷贝拉唑、华法林、甲苯磺丁脲、苯妥英、地西泮、甲琥胺、氯胍、普萘洛尔、阿米替林、丙米嗪、尼鲁米特、黄体酮等。其中美芬妥英、奥美拉唑、氯胍主要经CYP2C19氧化,可以作为探药。CYP2C19的主要诱导剂有氨鲁米特、卡马西平、利福平、炔诺酮、苯妥英等。CYP2C19的主要抑制剂有:地拉韦啶、氟康唑、氟伏沙明、吉非贝齐、异烟肼等。
CYP2C19基因突变不仅影响CYP2C19酶活性,也影响CYP2C19的抑制和诱导。在EM纯合子中,利福平对CYP2C19的诱导作用比EM杂合子的诱导作用强。此外,CYP2C19底物也是它本身酶活性的抑制剂,如奥美拉唑可强烈抑制吗氯贝胺的消除。
D.CYP2C9:它的基因位于染色体10q 24.2上,全长约为55kb,有9个外显子,8个内含子,表达于肝脏,负责10%~20%的药物代谢。
CYP2C9是一组具有高度遗传多态性的Ⅰ相氧化酶,其等位基因的分布具有显著的种族地域差异。CYP2C9基因的启动子和编码区存在着高度多态性,比较常见的突变是CYP2C9*2和CYP2C9*3,尤以白种人多见,这也是研究较为透彻的两类变异。
CYP2C9代谢的常用药物(表3-7)。
表3-7 CYP2C9代谢的常用药物

其中很多药物(特别是苯妥英、华法林和甲苯磺丁脲)具有很窄的治疗指数,所以酶活性成为确定上述药物在个体中的治疗效应和不良反应的重要决定因素。
甲苯磺丁脲是目前最常用的CYP2C9的探药之一,用于检测人体内的CYP2C9酶活性。对CYP2C9慢代谢者甲苯磺丁脲的用量应当降低60%。CYP2C9的三个主要等位基因突变体,CYP2C9*1、CYP2C9*2和CYP2C9*3对甲苯磺丁脲代谢确实存在差异,其中CYP2C9*3与前两者相比对甲苯磺丁脲的羟化活性较低。
CYP2C9的主要诱导剂有:苯巴比妥、苯妥英、扑米酮、司可巴比妥、卡马西平、乙醇、利福平等。CYP2C9的主要抑制剂有:胺碘酮、双羟基香豆素、氯霉素、西咪替丁、氟康唑、氟伐他汀、咪康唑、保泰松、磺吡酮、甲磺胺嘧啶、磺胺甲噻二唑、磺胺甲基异唑、磺胺苯吡唑、甲氧苄啶、扎鲁司特、氯霉素、异烟肼、氟西汀、诺氟西汀、丙戊酸钠等。
此外,该酶系还有CYP1A1、CYP2A1、CYP2E1等多种CYP代谢酶。药物在体内的代谢过程是多个代谢酶综合作用的结果,分析主要代谢酶的多态性有助于解释药物代谢的个体差异。除CYP450酶系外,Ⅱ相酶系对药物代谢也起着非常重要的作用。
Ⅱ相代谢酶系:影响药物代谢的Ⅱ相代谢酶主要有:硫嘌呤甲基转移酶(TPMT)、N-乙酰基转移酶(NAT)、谷胱甘肽S-转移酶(GST)等。
A.硫嘌呤甲基转移酶(thiopurine S-methyltransferase,TPMT):它在硫嘌呤类药物(如6-MP、AZA)的代谢过程中起关键作用。硫嘌呤类药物的疗效和毒性均与病人体内的TPMT活性有关。TPMT活性高的病人长期服用这类药会产生耐受性而且复发率很高,TPMT活性低的病人服用常规剂量的硫嘌呤类药物后会发生严重的骨髓抑制和肝损害等。因此TPMT的遗传多态性对指导临床用药具有重要意义。
TPMT的活性缺乏属于常染色体隐性遗传。TPMT的基因型分为野生型、杂合子和突变纯合子,相应的表现型为正常活性、中度活性、低活性或无活性。研究结果已显示,TPMT基因型和表型有很高的相关性。决定酶的高活性的等位基因TPMT*1为野生型等位基因,中度活性的为杂合子,低酶活性的为突变基因的纯合子。迄今为止已发现20种基因突变可引起TPMT酶活性的降低,这些基因分别被命名为TPMT*2~TPMT*18。对不同人种进行研究发现,TPMT*2、TPMT*3A、TPMT*3B和TPMT*3C这4种突变类型最为常见。TPMT*2、TPMT*3A、TPMT*3C可以代表人群中80%~95%的基因突变类型,检测这三种突变可以预测TPMT的表型,从而发现活性低下或缺失的个体,以降低此类药物的剂量减小毒性反应。
TPMT*3C可能是中国汉族人最主要甚至是唯一的TPMT基因突变类型,突变频率为1.33%。美国白种人和黑种人总的突变频率分别为3.7%和4.6%,日本人0.8%。
B.N-乙酰基转移酶(NATs):有NAT1和NAT2。NAT1的底物有对氨基苯甲酸和对氨基水杨酸等,其多态性形态至少有17种;NAT2的底物有异烟肼、普鲁卡因胺、肼屈嗪、磺胺类等,其多态性可导致2种代谢方式,即快乙酰化型和慢乙酰化型。
例如抗结核药异烟肼在体内必须先在N-乙酰基转移酶的作用下经乙酶化而失去活性后才能排泄。失活快型的肝细胞内有N-乙酰基转移酶,能将异烟肼迅速乙酰化并排出体外,异烟肼半衰期短,45~110min。失活慢型的肝细胞内缺乏N-乙酰基转移酶,口服异烟肼后半衰期可长达4.5h。失活慢型反复给予异烟肼后容易引起蓄积中毒,发生周围神经炎。系谱调查结果证明异烟肼失活缓慢属于常染色体隐性遗传,白种人与黑种人中约60%属于此型,黄种人中只占10%~20%。中国台湾省、香港地区居民以及新加坡的华裔中占22%左右。
(2)药物转运基因的多态性与药物效应:药物转运蛋白在决定药物吸收、分布和药物排泄中起着重要的作用。影响药物转运功能的转运蛋白数目还不清楚,目前研究最多的仍旧是多药耐药基因(MDR-1),多耐药基因位于第7号染色体,编码相对分子质量为170×103的膜糖蛋白(P-glucoprotein,P-gp)。P-gp作用类似一个泵,由ATP提供能量,可将细胞内药物泵出细胞外,其生理作用是保护细胞免受毒物及代谢产物损害;在肿瘤细胞,则造成对多种结构及作用机制不同抗癌药的耐受。MDR-1基因的多态性决定了不同个体的P-gp具有不同的转运能力,所以用药后,将出现个体用药差异。
目前在MDR-1基因至少鉴定出28个单核苷酸多态性,其中7个位于内含子上,有11个造成氨基酸改变,其余为静止突变。26位外显子C3435T静止突变虽然未改变氨基酸序列,但可能与其他位点多态性连锁,而影响氨基酸残基位置或其他增强子促进子基因组序列以及影响与mRNA修饰有关的功能等。TT型一般对肿瘤的易感性较高,而CC型往往预后较差。如果同时对多个位点的多态性以及与其他有关基因一起进行分析,结果会更有意义。
P-gp可识别和转运在结构、化学性质和药理学特性等方面均不同的广泛化合物。它的作用底物不仅包括抗癌药如长春新碱、蒽环类物质、表鬼臼毒素和紫杉醇,而且还包括其他许多种类不同的药物如:强心苷(如地高辛)、免疫抑制药(如环孢素A)、糖皮质激素等。
据研究报道,MDR-1基因的第26个外显子的多态性(C3435T)与MDR-1的表达水平显著相关,MDR-1纯合体的表达率最低,纯合子的病人在口服地高辛后,细胞内的地高辛浓度上升4倍或更高。
转运体的多态性会严重影响药物的分布,但转运体多态性只是影响药物疗效的因素之一,而且药物代谢(药物代谢酶和转运体)并不是决定药物疗效的主要因素。临床上我们经常会遇到这种现象,两个诊断相同的病人,给予同一药物治疗,血药浓度相近,但疗效却相差甚远。最近的研究表明,人群中由于与药效相关的基因突变产生的个体药物反应性差异与由药动学因素产生的这种差异相比,更为广泛、常见和显著。因此,当对药物疗效进行预测研究时还应强调药效动力学和候选基因的影响。
2.药效学过程 药效学过程中,受体起着重要的作用,大多数药物在体内需与特异受体相结合才能发挥作用。如β肾上腺素受体、胰岛素受体、血清素激活受体、血管紧张素转化酶(ACE)和HMG辅酶A还原酶等。大多数药物的受体具有多态性,因而对特定药物的敏感性不同。当药物的血浆浓度及其代谢产物的个体差异极小时,药物受体的多态性在药物最终效应差异中的作用就显得更重要。药物受体遗传基因的多态性与药物的作用密切相关。现已发现25种以上药物受体蛋白遗传变异型能影响药物效应。
(1)药物受体基因的多态性与药物效应:最重要的药物受体是G蛋白偶联受体,它的种类很多。这类受体结构大体上相似,其中β2肾上腺素受体是其中研究较多的一类,人β2肾上腺素受体由ADRB2基因编码,该基因定位于5q31~q32,长度为1.2kb,基因结构中无内含子,共表达413个氨基酸,ADRB2基因存在13个SNP,其中3个SNP多态性影响β2受体功能:Arg16Gly、Gln27Glu、Thr164Ile。Arg16Gly是ADRB2基因的第46位碱基点突变A→G导致受体蛋白第16位氨基酸发生Arg→Gly。具有16Gly多态性的哮喘病人,比具有16Arg的病人对支气管扩张药沙丁胺醇介导的受体下调脱敏感增加。与纯合的16Gly相比,纯合的16Arg和杂合的16Arg对沙丁胺醇的反应分别高5倍和2倍。Arg16Gly在人群中发生率较高,Gly16纯合子可以达57.3%。
Gln27Glu是ADRB2基因在第79位碱基的C→G,引起β2受体蛋白第27位氨基酸由Gln→Glu。这一多态性在人群中也很普遍,Glu纯合子可达28%。与Arg16Gly相比,Gln27Glu的功能改变刚好相反,Glu27突变型受体阻止β2受体表达下调。Glu27受体能减弱支气管收缩因素对支气管的影响,例如,具有Glu27受体的哮喘病人对甲基胆碱所诱发的支气管收缩作用减弱,同样对β2受体激动药(如异丙肾上腺素)具有较低的血管反应性。
β2受体基因的第三种突变是由于491C→T,导致受体蛋白第164位氨基酸由Thr→Ile。该突变在人群中的发生率较低,突变等位基因的频率大约为2.5%,人群中罕见突变的纯合子。Thr164Ile不影响激动剂所致的受体下调,但它使β2受体与一些激动药的亲和性下降,也影响受体与腺苷酸环化酶的偶合。
遗传背景不同的种族对β受体阻滞药或激动药的敏感性可存在明显差异,如东方人对β1和β2受体阻滞药普萘洛尔的敏感性远较西方白种人高,然而这种差异长久以来只能部分地从药动学差异如药物代谢酶的遗传多态性得到解释。后来发现Arg16Gly和Gln27Glu在人群中的发生率有种族差异。例如,中国人Gly16纯合子的发生率低于美国白种人和黑种人,同时中国人中Glu27纯合子稀少。考虑到Gly16和Glu27对β2受体调节的影响,受体遗传多态性也有助于综合分析普萘洛尔等药物效应的种族差异。
(2)药物受体反应性的遗传多态性与药物效应:药物受体按照药理学分为两类受体:一类是作用部位在细胞核内的受体,另一类是嵌入细胞表面且横跨细胞膜的受体。细胞表面受体因能与生物胺类、蛋白质和多肽激素、内分泌物质、神经递质和环境化学物质结合,从而可介导绝大多数药物和内源性第一信使的作用;而核受体则与相对较少的但很重要的第一信使相互作用。细胞表面受体按其跨膜信号转导机制可分为3类:第一是离子通道和例子转运蛋白;第二是涉及第二信使的通过酶级联对第一信使应答的受体;第三是依赖整合酶活性而起作用的受体。
①胰岛素受体:胰岛素受体是一种细胞表面糖蛋白。其对靶细胞的生物活性都是通过一种蛋白质-胰岛素受体介导的。2型糖尿病受遗传因素和环境因素影响的关系更密切,其发病机制与胰岛素分泌功能异常和靶器官的胰岛素抵抗有关。临床研究表明,对2型糖尿病的治疗存在显著的个体差异。1985年人类胰岛素受体cDNA首次被成功克隆,至今已报道了约170余种基因异常突变形式,大致分为以下几类。
突变使胰岛素受体(INSR)表达水平低下:如Asn15Lys、His209Arg、Leu233Pro和Phe382Val等。
INSR的结构基因改变:其突变多发生在编码区,不但使受体的结构不完整,还可使受体表达数目减少,严重影响受体与INS的亲和力。当突变发生于TK区域时,则会导致INS抵抗。
突变加速受体的降解:正常组织细胞胞质内的酸性环境(pH 5.5)可促进INS与其受体解离,而某些胰岛素受体基因突变可破坏此酸性条件,使INS不易从受体上解离而抑制受体再循环,同时受体-配体复合物引发吞饮作用使INSR降解,造成INS严重抵抗。
磺脲类的作用靶点是胰岛B细胞ATP敏感性钾通道,该通道由内层4个整流钾通道(Kir6.2)和外层4个磺脲类受体1(SUR1)组成。黄脲类药物主要与SUR1结合,通过关闭钾通道刺激胰岛素释放。SUR1由17个跨膜螺旋组成,至少有两个不同的药物结合位点,分别为在胞内侧连接跨膜螺旋25和跨膜螺旋26的肽段(也称B位点),且还连接跨膜螺旋-15和跨膜螺旋-16的肽段(也称A位点)。不同的药物作用位点也不同:甲苯磺丁脲、那格列奈作用于A位点,瑞格列奈作用于B位点,格列本脲、格列美脲共同作用于A、B位点。S1237Y突变位于A位点,该突变使得甲苯磺丁脲和那格列奈与SUR1的结合力几乎丧失,同时格列本脲的结合力也被削弱;而瑞格列奈的作用位点为B位点,所以少受影响。S1369A突变对磺脲类药物也比较敏感。还有一种核苷酸突变gag/aag引起蛋白质变化E23K,使得钾通道功能轻度改变,增加磺脲类药物继发治疗失效的风险。
②阿片受体:阿片受体也是G蛋白偶联受体家族的成员之一,阿片受体主要有3种类型:μ受体、δ受体和κ受体。阿片受体与痛觉形成和传导、镇静催眠、精神活动、循环及呕吐等多种生理功能和反应有关。同时阿片类药物可也是临床上十分重要的镇痛药,并有成瘾性的问题。不同人群对疼痛的刺激和阿片类药物的反应存在显著的个体差异,阿片受体的遗传多态性对了解阿片类药物的临床效应和解决阿片类药物及毒品的成瘾问题均有重要的价值。
吗啡等临床重要的阿片类镇痛药主要由μ受体介导其药理效应,因此μ受体遗传多态性受到了相对较多的关注。目前μ受体上发现有2个位点可发生导致氨基酸改变的突变,这两个突变均在第1外显子上,一个为Ala6Val,另一个为Asp40Asn。Asp40Asn不改变μ受体对大多数阿片肽和阿片类生物碱的亲和力;但Asn40与β内啡肽的亲和性可较Asp40受体大3倍,与此相对应,β内啡肽对Asn40受体中的G蛋白偶联钾离子通道的激活强度也大3倍,所以Asp40Asn突变可能因为改变受体的结合特性和影响信号传导而具有一定的生理、病理和治疗意义。
在许多情况下,临床上药物使用的最佳剂量受个体对这些药物反应的限制,这些药物反应包括药效和不良反应,不同个体对药物反应的差异明显。许多非遗传因素可以导致药物反应的个体差异,如肾、肺、心血管及肝脏等器官的功能状态,病人的年龄和性别,药物间的相互作用,环境和营养因素,疾病的发生机制及其严重程度等。除这些因素外,越来越多的证据表明众多遗传因素也起着重要的作用。多因素间的相互作用可以造成药效出现个体差异。如华法林治疗血栓栓塞出现的个体差异就包括非遗传因素和遗传因素。
已知的非遗传因素如下。
药物的相互作用:别嘌醇、荷包牡丹碱(痛可宁)、利福平等药物能够抑制CYP酶的活性;考来烯胺、硫糖铝与非甾体消炎药,雄激素、磺胺甲基异唑等相互作用,能够抑制消化道吸收,与清蛋白结合,提高血中游离华法林的浓度。
饮食:提高食物中维生素K的摄入量,会降低华法林的疗效。
饮酒:慢性乙醇摄入时能够促进肝脏的代谢,降低华法林疗效。
③肝肾功能不全:肝肾功能不全导致代谢清除率降低,华法林效果增强。
已知的遗传因素如下。
清蛋白:清蛋白的变异,导致其与华法林亲和力下降。
醛酸糖蛋白:醛酸糖蛋白的变异,导致其与华法林亲和力下降。
CYP2C9:CYP2C9多种等位基因变异使华法林代谢减少,效果增强,在CYP2C9*3的纯合子和杂合子中,S-华法林口服清除率分别下降了90%和66%。
CYP2C19:CYP2C19能够代谢华法林,但其多态性对华法林代谢的影响不够明确。
需要综合考虑这些因素,能辅助临床人员在预测某一特定药物时,根据病人属于何种反应人群,为其选择疗效最佳的药物和最佳药剂。通过对病人的基因检测,再开出“基因合适”的药方,即“基因处方”。这种最恰当的药方,可使病人得到最佳的治疗效果,达到真正“用药个体化”的目的,增加药物的有效性和安全性,减少不良反应,改善公众健康,实现个体化、可预测及可预防的医疗。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















