实验九 构建pET-GFP高效表达载体
一、实验目的
学习重组质粒载体的构建。
二、实验原理
质粒pET-28a上有单一酶切位点NcoⅠ和EcoRⅠ,通过双酶切,将质粒pET-28a线性化,经过电泳、切胶回收酶切大片段,作为载体备用。
质粒pMD-GFP上也有酶切位点NcoⅠ和EcoRⅠ,通过双酶切,将质粒pMD-GFP切
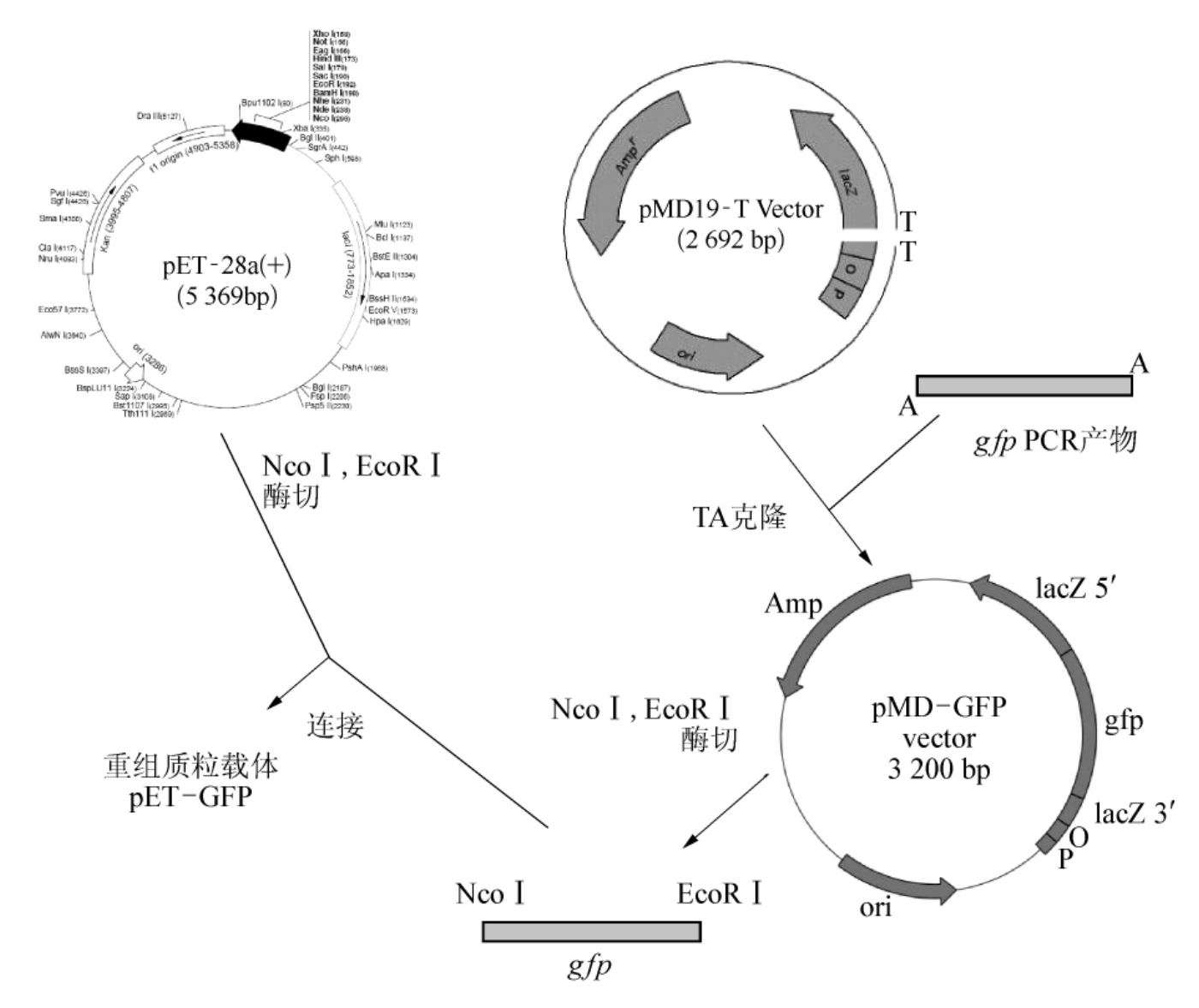
图3-7 重组质粒pET-GFP的构建过程
割成3个片段,通过电泳,切胶回收小片段(750bp),作为供体备用。
由于载体和供体经过相同的酶切后,产生相同的黏性末端,因此在T4DNA连接酶的作用下,重组DNA分子两端的黏性末端又共价结合,自身环化成一个重组的环形DNA分子。
通过酶切、连接、转化,产生重组子,构建出的pET-GFP质粒可以通过碱变性法提取出来,再经过酶切、测序、PCR、表达等多种方法得到验证。
三、器材和试剂
水浴锅、凝胶成像仪、微波炉、恒温培养箱、恒温振荡器、漩涡振荡器、台式高速离心机、微量移液器、移液器吸嘴、无菌1.5mL离心管、水平电泳槽、电泳仪、制胶槽、加样梳
质粒pET-28a、质粒pMD-GFP、限制性内切酶NcoⅠ和EcoRⅠ及相应的缓冲液、T4DNA连接酶及相应的缓冲液、琼脂糖、1×TAE电泳缓冲液、6×DNA上样缓冲液、GoldViewTM核酸染料、DL2000DNA Marker,Lambda DNA/Eco130Ⅰ(StyⅠ)Marker、DNA片段回收试剂盒、质粒提取的相关试剂
四、操作步骤
1.酶切
按照下列体系进行酶切
无菌去离子水 7μL
10×酶切缓冲液 3μL
10×BSA 3μL
质粒pMD-GFP 15μL
限制性内切酶NcoⅠ和XhoⅠ 各1μL
无菌去离子水 4μL
10×酶切缓冲液 2μL
10×BSA 2μL
质粒pET-28a 10μL
限制性内切酶NcoⅠ和EcoRⅠ 各 1μL
样品混匀后,瞬时高速离心,37℃水浴2h以上
2.电泳
先取酶切反应液2μL电泳,观察酶切情况,若已酶切完全,则将酶切反应液全部上样电泳。
3.纯化DNA片段
切胶回收载体和供体DNA片段。参照实验三的操作步骤。
4.连接
按照下列体系连接
无菌去离子水 1μL
10×连接酶缓冲液 1μL
载体DNA片段 2μL
供体DNA片段 5μL
T4DNA连接酶 1μL
样品混匀后,瞬时高速离心,16℃反应1h以上。
5.转化
连接产物转化大肠杆菌DH10B。参照实验五的操作步骤。
6.重组子的筛选
(1)菌落PCR法 以转化平板上的单菌落为模板,以GFPf和GFPr为引物,进行PCR扩增,参照实验一中的操作步骤,电泳检测,若存在750bp左右的单一条带,则初步鉴定为重组转化子。
(2)测序法 从平板上挑取单菌落,接种于5mL LB液体培养基中(含卡那霉素),37℃,200r/min振荡培养过夜,取1mL菌液送测序公司测序。
(3)酶切法 从平板上挑取单菌落,接种,提取质粒后,酶切,参照实验八操作步骤,若单酶切后片段大于pET-28a的线性化片段,双酶切后有小片段(750bp)出现,则为重组转化子。
7.重组质粒载体的提取
挑取转化平板上的单菌落,接种于液体LB培养基(含卡那霉素)中,37℃,200r/min振荡培养过夜,取菌液提取质粒。参照实验七操作步骤。
五、参考文献
[1] 〔美〕奥斯伯,等.精编分子生物学实验指南.4版.马学军,等译校.北京:科学出版社,2005.
[2] 〔美〕J.萨姆布鲁克,等.分子克隆实验指南.3版.黄培堂,等译.北京:科学出版社,2008.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















