一般而言,培养方式可分为“现场培养(In Situ Incubation,IS)”和“模拟现场培养(Simulated In Situ Incubation,SIS)”两种方式。下面分别就两种方式的优缺点进行论述。
一、现场培养法
如图2-1所示,从调查船或悬浮装置上放下一根绳子,将培养瓶按采样深度固定在绳子的不同位置,最下端缀上重物,一同放入海水中。由于培养瓶与垂直主绳之间有一定的活动余地,因此海水不断带动培养瓶一起晃动,使得培养瓶内的海水可以避免呈静止状态;此外,培养瓶处于原设定深度,温度和光照条件与原水环境更加接近,因此现场培养法是比较理想的培养方法,所得结果也较为准确。但缺点是需要船舶抛锚直到培养结束,因此在实际操作中易受到天气、海况和人力物力资源的限制。
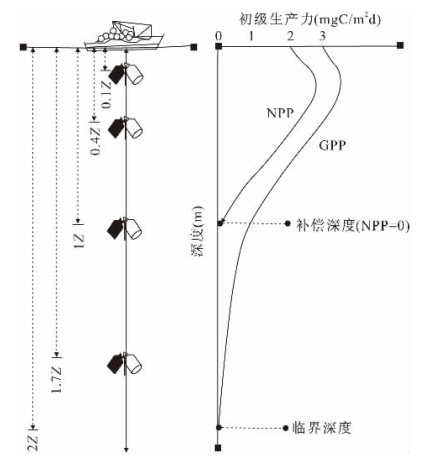
图2-1 初级生产力原位现场培养(船舶抛锚)
二、模拟现场培养法
模拟现场培养法是指将海水样品从原设定的深度取出后,在船上模拟海水中的环境(温度、光照、波浪晃动等),从而进行模拟培养。相对于原位培养,模拟培养的优点是比较灵活,能够节省考察船的时间。但由于温度、光照和海洋动力环境难以完美模拟,所以其缺点是可能与实际生产力有一定的误差。尤其对深水层进行模拟时,在岸上提供相似的温度、光照和动力条件往往具有一定的难度,使得模拟培养与原位培养总会有一定的不可控制误差。
图2-2(a)所示为静置模拟培养法,只需要将培养瓶放置在甲板上,用流动的海水控制温度。其缺点是:缺乏摇动,温度和阳光与原环境有一定差距,导致与原位培养结果可能有较大误差。
图2-2(b)为改进后的旋转培养法,增加了晃动。彭兴跃等(1997)的实验表明,培养过程中的搅动非常重要,该图的设计所得结果比静置培养方式更好。
在辽河三角洲的实际调查中,如条件允许,我们一般将培养瓶注射NaH14CO3示踪剂后密封,并置于原水层中随海水波动而晃动,这样的培养方式在一定程度上更贴近周围水体的实际温度、光照和水动力环境。当海况较差时,受限于现场条件,我们偶尔也使用模拟现场培养法,其培养方式介于上述两种方式之间,一般用人为的周期性晃动来模拟现场动力条件,用流动海水从培养瓶外侧模拟原水层温度。
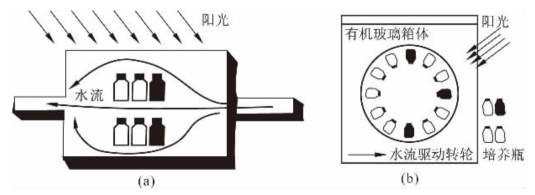
图2-2 静置培养法(a)与旋转培养法(b)
三、取样和培养
在辽河三角洲开展的调查中,用南森采水器对表层水和底层水进行现场采样(图2-3),并对各项水文参数进行实时测定和分析,包含温度、盐度、pH值等。盐度通过盐度计测定,透明度和透光层深度(Z)使用Secchi disk测定,溶解氧(DO)使用YSI多参数水质分析仪(美国,型号NC41-Pro 20)现场测定。

图2-3 现场采取水样并进行初步过滤
采取水样时,避免污染是开展后续实验的关键。且不可用真空泵抽取各层水样,这在很多国际操作规程中是被禁止的。透明合成树脂采水器或Van Dorn采水器等都是比较理想的选择。
为减少后续培养过程中浮游动物对浮游植物的捕食作用,在将水样加入培养瓶前,最好能用尼龙筛网过滤,筛网孔径根据浮游动物密度和大小来决定,一般0.3mm孔径可以过滤掉大部分的浮游动物。根据实际情况,筛网孔径可减至更小,在本调查中,我们使用37μm孔径筛网对水样进行过滤,以减少浮游动物的影响。在准备培养实验的同时,使用GF/F滤膜过滤部分水样,取滤膜冷冻保存,以测定叶绿素含量。该叶绿素含量可结合后期14 C培养结果来计算碳同化系数。
如图2-4所示,将经筛网过滤后的水样注入3个容积为300mL的透明BOD培养瓶和3个外壁漆黑的BOD培养瓶,每瓶加入1~5μL CiNaH14CO3示踪剂后,密封。将6个培养瓶平行置于预定的水层中或模拟水层的流动水体培养器具中,并记录培养时间。

图2-4 开展14 C培养实验室取样、标记和培养过程
关于培养时间的长短,一直是学术界比较有争议的话题。Marra等(2007)曾推荐24h昼夜培养,因为这样经历了白天光合作用和夜晚呼吸作用的过程,似乎更符合生态系统规律。然而在很多实际培养中,并非一个完整的昼夜,如Karl等(1998)针对Hawaii Ocean Time-Series(HOT)站点ALOHA开展的培养便是从早晨太阳升起至晚上太阳落下(约12h),而早期则出现过从0.5~24h不同时间段的培养。根据以往研究经验,培养时间可以灵活选取,一般在生产力较高的沿海水域,培养时间可以为2~6h之间,不超过10h,考虑到氧浓度的变化和细菌生长,一般采用4h;而在生产力较低的外海水域或湖泊中,则可以适当增加培养时间。一般情况下,若条件允许,适当延长培养时间有利于提高最后计算结果的精度,因为在光照条件下随着培养时间的增加,碳吸收量也会增加。
关于培养瓶的体积,Gieskes等(1997)曾指出培养瓶的大小对14C方法测定结果有影响,然而Laws等(2000)的现场测定则表明,不同大小的培养瓶结果相近,并不存在所谓的“bottle-size effects”。根据以往的培养经验,瓶子体积在250~500mL之间既能满足基本的培养后取样要求,也比较方便操作。
培养结束后,为测定每个培养瓶中溶液的总14 C放射性活度(ATC),从每瓶中取3个5mL平行水样分别置于闪烁瓶中,加入0.5mL 1NNaOH(或苯乙胺)用于固定溶解态14 C;类似地,为测定总有机碳(TOC)的放射性活度(ATOC),另取3个5mL平行水样分别置于闪烁瓶中,加入0.5mL 1NHCl,移入通风橱中放置24h以排出无机碳,如图2-5所示。
随后,立即从每个培养瓶中抽取50mL水样,过滤,取滤膜置于闪烁瓶中,用于测定颗粒有机碳(POC)的放射性活度(APOC);并移取5mL滤液置于闪烁瓶中,用于测定溶解有机碳(DOC)的放射性活度(ADOC)。如此重复取样3次。同时,在放置滤膜和滤液的闪烁瓶中均加入0.5mL 1NHCl,置于通风橱中24h以排出无机碳。如过滤后,滤膜不能立即进行酸化处理,则需要将滤膜置于-20℃冷冻,直至能进行酸化和通风处理。
在所有闪烁瓶中加10~15mL闪烁液(Ultima Gold LLT),并用超低本底液体闪烁谱仪(QUANTULUS 1220,PerkinElmer Inc.)(或液体闪烁计数仪)测定14 C放射性活度。为消除海水中14 C本底的影响,利用以上类似步骤分别过滤海水水样,以相同步骤取GF/F滤膜和滤液,测定14 C放射性活度,并做空白校正。研究表明,将用闪烁液固定的闪烁瓶放置30d后,再测定放射性强度能够得到一个更好的结果,但须注意应避光保存。

图2-5 原位培养试验后对14 C样品的处理和测试
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















