PCR的基本工作原理就是以拟扩增的DNA分子为模板,以一对分别与模板互补的寡核苷酸片段为引物,在DNA聚合酶的作用下,按照半保留复制的机制沿着模板链延伸直至完成新的DNA合成。通过不断重复这一过程,可以使目的DNA片段得到扩增。另一方面,新合成的DNA片段也可以作为模板,因而PCR技术可使DNA的合成量呈指数型增长。
PCR技术实际上是在模板DNA、引物和4种脱氧核糖核苷酸存在的条件下依赖于DNA聚合酶的酶促合成反应。PCR的特异性取决于引物和模板的特异性结合。
PCR反应分为3个步骤。
(1)变性(denaturation):通过加热使DNA双螺旋的氢键断裂,双链解离成单链DNA。
(2)退火(annealing):当温度降低时由于模板分子结构较引物复杂得多,而且反应体系中引物DNA量大大多于模板DNA,使引物和其互补的模板在局部形成杂交链,而模板DNA双链之间互补的机会较少。
(3)延伸(extension):在DNA聚合酶和4种脱氧核糖核苷三磷酸底物及Mg2+存在的条件下,5'→3'的聚合酶催化以引物为起始点的DNA链延伸反应。
以上3个步骤为一个循环。每一循环的产物可以作为下一个循环的模板,数小时以后,介于两个引物之间的特异性DNA片段得到了大量复制,数量可达2×106~7拷贝。
如图7-1所示,经过高温变性、低温退火和中温延伸3个温度的循环,模板上介于2个引物之间的片段不断得到扩增。每循环一次,目的DNA的拷贝数加倍,随着循环次数的增加,目的DNA以2n-2n的形式堆积。

图7-1 PCR原理示意图
在反应的最初阶段,原来的DNA担负着起始模板的作用,随着循环次数的递增,由引物介导延伸的片段急剧地增多而成为主要模板。因此,绝大多数扩增产物将受到所加引物5'末端的限制,最终扩增产物是介于两种引物5'末端之间的DNA片段。
PCR实验流程:
![]()
一、PCR引物的设计
引物是PCR特异性反应的关键,PCR 产物的特异性取决于引物与模板DNA互补的程度。理论上,只要知道任何一段模板DNA序列,就能按其设计互补的寡核苷酸链做引物,利用PCR就可将模板DNA在体外大量扩增。使用不合适的PCR 引物容易导致实验失败:表现为扩增出目的带之外的多条带(如形成引物二聚体带),不出带或出带很弱……现在,PCR 引物设计大都通过计算机软件进行。可以直接提交模板序列到特定网页,得到设计好的引物,也可以在本地计算机上运行引物设计专业软件(具体可参见第5章相关内容)。
(一)引物设计的基本原则
1.引物与模板的序列要紧密互补。
2.引物与引物之间避免形成稳定的二聚体或发夹结构。
3.引物不能在模板的非目的位点引发DNA 聚合反应(即错配)。
(二)具体因素
1.引物长度(primer length)。
2.产物长度(product length)。
3.序列Tm 值(melting temperature)。
4.引物与模板形成双链的内部稳定性(internal stability, 用∆G 值反映)。
5. 形成引物二聚体(primer dimer)及发夹结构(duplex formation and hairpin)的能值。
6.在错配位点(false priming site)的引发效率。
7.引物及产物的GC 含量(composition)。
8.必要时还需对引物进行修饰,如增加限制性内切酶位点,引进突变等。
(三)引物设计需遵循的一般原则
1.引物应在核酸序列保守区内设计并具有特异性 DNA序列的保守区是通过物种间相似序列的比较确定的。在NCBI上搜索不同物种的同一基因,通过序列分析软件(如DNAman)比对(alignment),各基因相同的序列就是该基因的保守区。引物与非特异扩增序列的同源性不要超过70%或有连续8个互补碱基同源。
2.产物不能形成二级结构 某些引物无效的主要原因是扩增产物单链二级结构的影响,选择扩增片段时最好避开二级结构区域。用有关软件(如RNA structure)可以预测估计mRNA的稳定二级结构,有助于选择模板。实验表明,待扩区域自由能(△G°)<58.6l kJ/mol时,扩增往往不能成功。若不能避开这一区域时,用7-deaza-2'-脱氧GTP取代dGTP对扩增的成功是有帮助的。
3.引物长度一般为15~30碱基 引物的有效长度:Ln=2(G+C)+(A+T),Ln值不能>38,因为>38时,最适延伸温度会超过Taq DNA聚合酶的最适温度(74℃),不能保证产物的特异性。引物过短也会使特异性降低。
4.引物GC含量在40%~60% GC含量过高或过低都不利于引发反应。上下游引物的GC含量不能相差太大。
5.Tm值最好接近72℃ 上下游引物的Tm值(melting temperature)是寡核苷酸的解链温度,即在一定盐浓度条件下,50%寡核苷酸双链解链的温度。有效启动温度一般高于Tm值5~10℃。若按公式Tm= 4(G+C)+2(A+T)估计引物的Tm值,则有效引物的Tm为55~80℃,其Tm值最好接近72℃以使复性条件最佳。
6.碱基要随机分布 引物中4种碱基的分布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。尤其3'端不应超过3个连续的G或C,因这样会使引物在G+C富集序列区引发错误。
7.引物自身不能有连续4个碱基的互补 引物自身不应存在互补序列,否则引物自身会折叠成发夹状结构影响引物本身复性。这种二级结构会因空间位阻而影响引物与模板的复性结合。若用人工判断,引物自身连续互补碱基不能大于3bp。
8.引物之间不能有连续4个碱基的互补 两引物之间不应存在互补性,尤其应避免3′端的互补重叠以防引物二聚体的形成。一对引物间不应有多于4个连续碱基的同源或互补。
9.引物5'端可以修饰 引物的5'端限定着PCR产物的长度,它对扩增特异性影响不大。因此,可以被修饰而不影响扩增的特异性。引物5'端修饰包括:加酶切位点;标记生物素、荧光、地高辛等;引入蛋白质结合DNA序列;引入突变位点、插入与缺失突变序列和引入一启动子序列等。
10.引物3'端不可修饰 引物的延伸是从3'端开始的,不能进行任何修饰。3'端也不能有形成任何二级结构的可能,除在特殊的PCR(allele-specific PCR, AS-PCR)反应中,引物3'端不能发生错配。
11.引物3'端要避开密码子的第3位 如扩增编码区域,引物3'端不要终止于密码子的第3位,因密码子的第3位易发生简并,会影响扩增特异性与效率。
(四)常用的引物设计软件
1.Primer Premier (自动搜索) 具体操作可参见第5章相关内容。
2.Oligo 6 (引物评价)
3.Vector NTI Suit
4.Dnasis
5.Omiga
6.Dnastar
7.Primer3(在线服务)
二、PCR反应体系
标准的PCR反应体系(50~100µl体积)如下。
(1)10×缓冲液
KCl 50mmol/L
Tris-HCl(pH 8.4~9.0) 10~25mmol/l
MgCl2 1.5mmol/L
明胶或牛血清白蛋白(BSA) 100µg/ml
注意:不同扩增模板或引物,其浓度有所差异,因此商家提供的缓冲液中一般不含MgCl2,另单独提供一管25 mmol/L MgCl2溶液,供研究者根据需要添加。
(2)其他成分
4种dNTP混合物 各200µmol/L
2种引物 各0.25µmol/L
模板DNA 0.1µg
耐热DNA聚合酶 2.5U
注意:①引物一般用TE配制成较高浓度的母液(约100µmol/L),保存于-20℃。使用前取出其中一部分用ddH2O配制成10µmol/L或20µmol/L的工作液;②加入的模板DNA浓度与模板种类、纯度、扩增目的等有关;③酶量过多将导致产生非特异性产物。当降低反应体积时(如20µl或50µl),一般酶的用量仍不小于2U,否则反应效率将降低。
(3)PCR反应条件
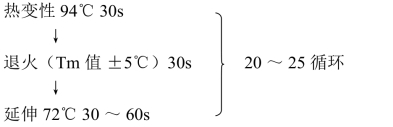
注意:①热变性时间过短,可能导致变性不充分,但时间过长,易使酶失活;②引物的Tm值影响着PCR退火温度的设置。比Tm值低或高很多的退火温度都不能获得满意的扩增。
(一)引物
PCR反应中引物浓度一般为0.2~1µmol/L。引物浓度不宜偏高,浓度过高有两个弊端:一是容易形成引物二聚体(primer-dimer);二是当扩增微量靶序列并且起始材料又比较粗时,容易产生非特异性产物。一般说来,用低浓度引物不仅经济,而且反应特异性也较好。
(二)反应缓冲体系
PCR反应中缓冲液是一个重要的影响因素,提供PCR反应所必需的合适的酸碱度和某些离子,特别是其中的Mg2+能影响反应的特异性和扩增片段的产率。一般随Taq DNA聚合酶供应。
目前最常用的缓冲液是10~50mmol/L的Tris-HCl(pH 8.3~8.8,20℃),在72℃(通常PCR反应延长阶段的温度)时,其pH为7.2左右,故在实际的PCR反应体系中,其pH于6.8~7.8之间变化。Tris-HCl用于调节反应体系pH,使Taq酶在偏碱性环境中发挥活性。
Mg2+对PCR扩增的特异性和产量有显著的影响,在一般的PCR反应中,各种dNTP浓度为200µmol/L时,Mg2+浓度为1.5~2.0mmol/L为宜。Mg2+浓度过高,反应特异性降低,出现非特异性扩增,浓度过低会降低Taq DNA聚合酶的活性,使反应产物减少。
KCl有利于引物与模板退火,高于50mmol/L 的KCl对Taq DNA聚合酶有抑制作用。
(三)耐热DNA聚合酶
最早用于PCR反应的酶是大肠杆菌DNA聚合酶Ⅰ的Klenow酶,由于此酶对高温耐受性差,每次变性时绝大部分酶失活,所以每经过数个循环则需要重新添加新酶,致使实验操作复杂化且增加实验成本。以后人们曾使用T4 DNA聚合酶和T7 DNA聚合酶,两者虽使扩增特异性增加和DNA合成速度提高,终因热稳定性差而未得到广泛应用。直到发现Taq DNA聚合酶有很高的耐热性(经95℃持续高温仍有活性),加酶一次可完成整个PCR反应。
Taq DNA聚合酶是从一种水生栖热菌(thermus aquaticus,简称Taq)yT1株分离提取的。yT是一种嗜热真菌,能在70~75℃生长。该菌是1969年从美国黄石国家森林公园火山温泉中分离的。Taq DNA聚合酶的分子量为94kd,这种酶不显示任何3'→5'核酸外切酶活性,它的最适反应温度在75℃左右,在95℃的高温中具有良好的热稳定性。
在100µl PCR反应体系中,一般加入2~4U的酶量,足以达到每分钟延伸1 000~4 000个核苷酸的掺入速度。酶量过多将导致产生非特异性产物。但是,不同的公司或不同批次的产品常有很大的差异,由于酶的浓度对PCR反应影响极大,所以应当做预试验或使用厂家推荐的浓度。当降低反应体积时(如20µl或50µl),一般酶的用量仍不小于2U,否则反应效率将降低。
1.酶活性与热稳定性 该酶基因全长2 496个碱基,编码832个氨基酸,酶蛋白分子为 94kd。其比活性为200 000 U/mg,75~80℃时每个酶分子每秒钟可延伸约150个核苷酸,70℃延伸率大于60个核苷酸/秒,55℃时为24个核苷酸/秒。温度过高(90℃以上) 或过低(22℃)都可影响Taq DNA聚合酶的活性,该酶虽然在90℃以上几乎无DNA合成,但确有良好的热稳定性,在PCR循环的高温条件下仍能保持较高的活性。在92.5℃、95℃、97.5℃时,PCR混合物中的Taq DNA聚合酶分别经130min、40min和5~6min后,仍可保持50%的活性。实验表明,PCR反应时变性温度为95℃ 20s,50个循环后,Taq DNA聚合酶仍有65%的活性。Taq DNA聚合酶的热稳定性是该酶用于PCR反应的前提条件,也是PCR反应能迅速发展和广泛应用的原因。Taq DNA聚合酶还具有反转录活性,其作用于类似反转录酶。此活性温度一般为65~68℃,有Mn2+存在时,其反转录活性更高。
2.离子依赖性 Taq DNA聚合酶是Mg2+依赖性酶,该酶的催化活性对Mg2+浓度非常敏感。以活性程度很低的鲑鱼精子DNA为模板,dNTP的浓度为0.7~0.8mmol/L时,用不同浓度Mg2+进行 PCR反应10min,测定结果为MgCl2浓度在2.0mmol/L时该酶催化活性最高,此浓度能最大限度地激活Taq DNA聚合酶的活性。Mg2+过高就会抑制酶活性,当MgCl2浓度在10mmol/L时可抑制40%~50%的酶活性。由于Mg2+能与dNTP结合而影响PCR反应液中游离的Mg2+浓度,所以MgCl2的浓度在不同的反应体系中应适当调整,优化浓度。一般反应中Mg2+浓度至少应比dNTP总浓度高0.5~1.0mmol/L。适当浓度的KCl能使Taq DNA聚合酶的催化活性提高50%~60%,其最适浓度为50mmol/L,高于75mmol/L时明显抑制该酶的活性。
3.忠实性 Taq DNA聚合酶具有5'→3'聚合酶活性和5'→3'外切酶活性,而无3'→5'外切活性,它不具有Klenow酶的3'→5'校对活性。因而,在PCR反应中如发生某些碱基的错配,该酶是没有校正功能的。Taq DNA聚合酶的碱基错配概率为2.1×10-4。
4.抑制剂 低浓度的尿素、甲酰胺、二甲基甲酰胺(DMF)和二甲基亚砜(DMSO)对Taq DNA聚合酶的催化活性并无影响。极低浓度的离子表面活性剂,如脱氧胆胺酸钠(小于0.06%)、十二烷基肌氨酸钠(小于0.02%)、十二烷基磺酸钠(SDS,小于0.01%),几乎可完全抑制该酶的活性。而非离子表面活性剂在较高浓度(如>5%)时方能抑制该酶的活性。
(四)脱氧核苷三磷酸(dNTP)的质量与浓度
dNTP的质量与浓度和PCR扩增效率有密切关系,dNTP粉呈颗粒状,如保存不当易变性失去生物学活性。dNTP溶液呈酸性,使用时应配成高浓度后,以1mol/L NaOH或1 mol/L Tris-HCl的缓冲液将其pH调节到7.0~7.5,小量分装,-20℃冷冻保存。多次冻融会使dNTP降解。在PCR反应中,dNTP应为50~200µmol/L,尤其是注意4种dNTP的浓度要相等(等摩尔配制),如其中任何一种浓度不同于其他几种(偏高或偏低),就会引起错配。浓度过高可加快反应速度,同时增加碱基的错误掺入率和实验成本。浓度过低会导致反应速度的下降,但可提高实验的精确性。dNTP能与Mg2+结合,使游离的Mg2+浓度降低。
(五)模板(靶基因)
PCR对模板的要求不高,单、双链DNA均可作为PCR的样品。虽然PCR可以用极微量的样品(甚至是来自单一细胞的DNA)作为模板,但为了保证反应的特异性,一般还宜用微克水平的基因组DNA或104拷贝的待扩增片段作为起始材料。原材料可以是粗制品,某些材料甚至仅需用溶剂一步提取之后即可用于扩增,但混有任何蛋白酶、核酸酶、Taq DNA聚合酶抑制剂以及能结合DNA的蛋白,将可能干扰PCR反应。
传统的DNA纯化方法通常采用SDS和蛋白酶K来消化处理标本。SDS溶解细胞膜上的脂类与蛋白质,从而溶解膜蛋白而破坏细胞膜,并解离细胞中的核蛋白;SDS还能与蛋白质结合而沉淀。蛋白酶K能水解消化蛋白质,特别是与DNA结合的组蛋白,再用有机溶剂酚与氯仿抽提除掉蛋白质和其他细胞组分,用乙醇或异丙醇沉淀核酸。提取的核酸即可作为模板用于PCR反应。一般临床检测标本,可采用快速简便的方法溶解细胞,裂解病原体,消化除去染色体的蛋白质使靶基因游离,直接用于PCR扩增。RNA模板提取一般采用异硫氰酸胍或蛋白酶K法,要防止RNase降解RNA。
三、PCR循环参数设置
PCR反应条件包括温度、时间和循环次数。
温度与时间的设置:基于PCR原理三步骤而设置变性-退火-延伸3个温度点。在标准反应中采用三温度点法,双链DNA在90~95℃变性,再迅速冷却至40~60℃,引物退火并结合到靶序列上,然后快速升温至70~75℃,在Taq DNA 聚合酶的作用下,使引物链沿模板延伸。对于较短的靶基因(长度为100~300bp)可采用二温度点法,除变性温度外、退火与延伸温度可合二为一,一般采用94℃变性,65℃左右退火与延伸(此温度时Taq DNA酶仍有较高的催化活性)。
(一)变性温度和时间
变性温度低,解链不完全是导致PCR反应失败的最主要原因。一般情况下,93~94℃ l min足以使模板DNA变性。变性不完全,DNA双链会很快复性,因而减少产量。在变性中,温度太高或反应时间过长,会导致酶活性的损失。Taq DNA聚合酶活性的半寿期:92.5℃为2h以上,95℃为40min,97℃为5min。
(二)复性温度和时间
退火温度是影响PCR特异性的较重要因素。变性后温度快速冷却至40~60℃,可使引物和模板发生结合。由于模板DNA 比引物复杂得多,引物和模板之间的碰撞结合机会远高于模板互补链之间的碰撞。退火温度与时间取决于引物的长度、碱基组成及其浓度,还有靶基因序列的长度。对于20个核苷酸,G+C含量约50%的引物,55℃为选择最适退火温度的起点较为理想。可通过以下公式帮助选择合适的引物的复性温度:
Tm值(解链温度)=4(G+C)+2(A+T)
复性温度=Tm值-(5~10℃)
在Tm值允许范围内,选择较高的复性温度可大大减少引物和模板间的非特异性结合,提高PCR反应的特异性。复性时间一般为30~60s,足以使引物与模板之间完全结合。
(三)延伸温度和时间
Taq DNA聚合酶的生物学活性如下。
● 70~80℃ 150核苷酸/s/酶分子
● 70℃ 60核苷酸/s/酶分子
● 55℃ 24核苷酸/s/酶分子
● 高于90℃时, DNA合成几乎不能进行。
PCR反应的延伸温度一般选择在70~75℃,常用温度为72℃,过高的延伸温度不利于引物和模板的结合。PCR延伸反应的时间可根据待扩增片段的长度而定,一般1kb以内的DNA片段,延伸时间1min是足够的。3~4kb的靶序列需3~4min;扩增10kb需延伸至15min。延伸时间过长会导致非特异性扩增带的出现。对低浓度模板的扩增,延伸时间要稍长些。
(四)循环数
循环次数决定PCR扩增程度。PCR循环次数主要取决于模板DNA的浓度。一般的循环次数选在25~30次之间,循环次数越多,非特异性产物的量亦随之增多。需要进一步增加产量时,可将第一次PCR产物稀释后再扩增,而不要盲目增加循环数,以免增加非特异扩增。
(五)PCR仪的使用
以美国PE GeneAmp PCR System 2 400或9 700扩增仪为例。
模板温控式PCR仪是大多数研究者使用的机型,通过对金属模块温度的调控,进而控制插于金属模块中PCR管的温度。
1. 打开主机电源,进入主菜单( Main Menu)。
2. 按箭头键“←↑→↓”选择文件(File) 菜单,对原有程序进行编辑或新建新程序。
3. 新建扩增程序:在文件菜单 Standard 中选择标准程序,分步设置温度和反应时间等参数。
4. 按 Enter 键,输入程序名称,保存程序。
5. 返回主菜单,调出所设计的扩增程序,按 Start,运行程序。
6. 运行程序结束后,取出扩增管,冷却热盖装置,关闭电源。
四、PCR结果的检测分析
PCR扩增反应完成之后,必须通过严格的鉴定,才能确定是否真正得到了准确、可靠的预期特定扩增产物。
(一)凝胶电泳
凝胶电泳是检测PCR产物常用和最简便的方法,能判断产物的大小,有助于产物的鉴定。凝胶电泳常用的有琼脂糖凝胶电泳和聚丙烯酰胺凝胶电泳,前者主要用于DNA片段大于100bp者,后者主要用于检测小片段DNA。
1.琼脂糖凝胶电泳 这是实验室最常用的方法,简便易行,只需少量DNA即可进行实验。其原理是不同大小的DNA分子通过琼脂糖凝胶时,由于泳动速度不同而被分离,经溴化乙锭(EB)染色,在紫外光照射下DNA分子发出荧光来判定其分子的大小。
用于电泳检测PCR产物的琼脂糖浓度通常为1%~2%,应该使用纯度高的电泳纯级琼脂糖,这种琼脂糖已除去了荧光抑制剂及核酸酶等杂质。
2.聚丙烯酰胺凝胶电泳 聚丙烯酰胺凝胶电泳比琼脂糖凝胶电泳繁琐,但在引物纯化、PCR扩增指纹图、多重PCR扩增、PCR扩增产物的酶切限制性长度多态性分析时常用到。
它与琼脂糖凝胶电泳比较具有如下优点:①分辨率很强,可达1bp;②能装载的DNA量大,达每孔10µgDNA;③回收的DNA纯度高;④其银染法的灵敏度较琼脂糖中EB染色法高2~5倍;⑤避免了EB迅速褪色的弱点,银染的凝胶干燥后可长期保存。
3.酶切分析 根据PCR产物中限制性内切酶的位点,用相应的酶切、电泳分离后,获得符合理论的片段,此法既能进行产物的鉴定,又能对靶基因分型,还能进行变异性研究。
(二)分子杂交
分子杂交是检测PCR产物特异性的有力证据,也是检测PCR 产物碱基突变的有效方法。
1. Southern印迹杂交 在两个引物之间另合成一条寡核苷酸链(内部寡核苷酸)标记后做探针,与PCR产物杂交。此法既可作特异性鉴定,又可以提高检测PCR产物的灵敏度,还可知其分子量及条带形状。
2. 斑点杂交 将PCR产物点在硝酸纤维素膜或尼龙膜上,再用内部寡核苷酸探针杂交,观察有无着色斑点,主要用于PCR产物特异性鉴定及变异分析。
(三)核酸序列分析(测序)
是检测PCR产物特异性的最可靠方法。PCR产物电泳后,为了保证产物是真正的目的片段而非假阳性,必须割胶回收后进行测序。PCR技术与自动测序技术相结合,成为一种最快、最有效的测定核苷酸序列的方法。
(四)PCR产物克隆
当PCR产物过少影响测序结果,或者需要大量的PCR产物用于后续实验时,需要对实验得到的PCR产物进行扩增(即克隆)。其通用的方法是把PCR扩增后的产物连接到相应的载体后,再转移到相应的细菌菌株中扩增。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















