【摘要】:例如,对NaF晶体来说,U就是下列反应的焓变:上述反应的焓变不能直接测量,但是可以通过玻恩-哈伯循环,利用热化学实验数据计算得出。以NaCl为例,通过波恩-哈伯循环来计算其晶格能:晶格能的大小常用来比较离子键的强度和晶体的牢固程度。离子化合物的晶格能越大,表示正、负离子间结合力越强,晶体越牢固,因此晶体的熔点越高,硬度越大。
7.1.3 离子键的强度
在离子键的模型中,可以近似地将正、负离子的电荷分布看为球形对称的。根据库仑定律,两种带相反电荷的离子间的静电引力与离子电荷的乘积成正比,而与离子间距离的平方成反比:
式中,q+、q-分别为阳离子、阴离子的电荷,d为阳离子与阴离子核间距。
由此可见,离子的电荷越多,离子间的距离越小(在一定的范围内),则离子间的引力越强。
离子键的强度通常用晶格能U(lattice energy)的大小来衡量。晶格能表示相互远离的气态正离子和负离子结合成1mol离子晶体时所释放的能量,或1mol离子晶体解离成气体离子时所吸收的能量。在热化学计算中,正向反应释放的能量和逆向反应吸收的能量,数值相同、符号相反,取其绝对值称为晶格能。例如,对NaF晶体来说,U就是下列反应的焓变:
Na+(g)+F-(g)→NaF(s)
上述反应的焓变不能直接测量,但是可以通过玻恩-哈伯(Born-Haber)循环,利用热化学实验数据计算得出。以NaCl为例,通过波恩-哈伯循环来计算其晶格能:
该反应的热效应即NaCl(s)的生成热,可以由实验求得: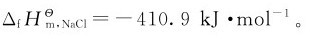
反应的波恩-哈伯循环为:
晶格能的大小常用来比较离子键的强度和晶体的牢固程度。离子化合物的晶格能越大,表示正、负离子间结合力越强,晶体越牢固,因此晶体的熔点越高,硬度越大。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。













