Preparation of Ethyl Acetoacetate
【目的要求】
1.了解Claisen(克莱森)酯缩合制备乙酰乙酸乙酯的原理和方法。
2.学习金属钠的取用和残留物的处理方法。
3.学习无水操作及减压蒸馏操作。
【基本原理】
含有α-H的酯在碱催化下能发生克莱森(Claisen)酯缩合反应,生成β-酮酸酯。在实验室,利用乙酸乙酯在醇钠作用下发生此类反应可以制备乙酰乙酸乙酯。其中,乙醇钠可以由金属钠和乙酸乙酯中残留的乙醇作用得到。反应过程如下:
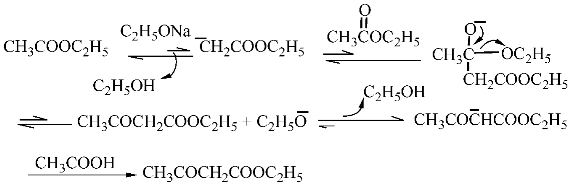
乙醇钠夺取乙酸乙酯的α-H产生碳负离子,该碳负离子对另一分子酯的羰基进行亲核加成,然后消除乙氧负离子得到乙酰乙酸乙酯。由于乙酰乙酸乙酯亚甲基氢的酸性(p K a≈11)明显强于乙醇(p K a≈17),在乙氧负离子的作用下几乎不可逆地发生质子交换生成乙酰乙酸乙酯的钠盐。最后,用乙酸酸化得乙酰乙酸乙酯。总反应为:

乙酰乙酸乙酯在有机合成上有重要应用。工业上主要由乙烯酮的二聚体通过乙醇醇解得到。
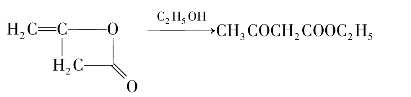
【仪器与试剂】
仪器:回流装置,减压蒸馏装置(见实验2中图2-5)。
试剂:乙酸乙酯(沸点:77℃,相对密度0.89);Na(熔点:97.5℃),二甲苯(沸点:140℃;相对密度:0.8678),50%醋酸,饱和NaCl溶液,无水Na2 SO4,1%三氯化铁溶液。
【操作步骤】
在50 mL干燥的圆底烧瓶中,放置2 g(0.087 mol)金属钠[1]和10 mL干燥好的二甲苯。装上回流冷凝管,在冷凝管上端装上一个氯化钙干燥管。加热回流使钠熔融,停止回流,迅速拆除冷凝管,用橡皮塞塞住烧瓶,趁热用力振摇[2],得到细粒状钠珠。
倾出二甲苯,快速加入22 mL(0.227 mol)乙酸乙酯[3],重新装好带有干燥管的冷凝管,通冷凝水。反应立即开始,逸出氢气。如果反应慢,可以稍微加热。待激烈反应过后,缓缓加热,保持微沸,直到金属钠全部反应[4](约需1 h),此时生成的乙酰乙酸乙酯钠盐为桔红色透明溶液,有时因溶液饱和析出淡黄色沉淀。待反应液冷至室温后,在振摇下缓慢滴加50%醋酸直到溶液为弱酸性(约需15 mL),此时固体全部溶解[5]。
将反应液移入分液漏斗中,加入等体积的饱和氯化钠溶液,用力振摇,静置分层,分出乙酰乙酸乙酯层,用无水硫酸钠干燥。然后滤入烧瓶,用少量乙酸乙酯冲洗干燥剂。先水浴常压蒸馏除去未发生反应的乙酸乙酯后,将剩余液移入干燥的25 mL烧瓶中,安装减压蒸馏装置进行减压蒸馏,收集一定压力下的馏分[6](减压蒸馏时必须缓慢升温,待残留的低沸点物蒸出以后,再升高温度),收集产品,称重,产量约4.8 g。
纯净乙酰乙酸乙酯的沸点180.4℃,无色透明液体,具有水果香味。折射率![]() 1.4192。
1.4192。
乙酰乙酸乙酯的沸点与压力关系如下表:
![]()
1 mmHg≈133 pa
本实验约需6 h。
【注释】
[1]钠遇水即燃烧、爆炸,使用时严禁与水接触!实验中,所有钠碎片及沾有钠碎片的滤纸或瓶塞均需置于专用的烧杯中,待用乙醇处理。用镊子取金属钠块,滤纸抹干,在垫有木板的滤纸上用小刀切取,并称重。动作应迅速,钠块可切成较大的块状,以免氧化。钠的用量可酌予增减,其幅度控制在1.8~2.2 g。产率按钠用量计算。
[2]如果用玻璃塞,须在瓶口夹一纸条,否则塞子难以打开。振摇时注意安全,可用布手套或干布裹住瓶颈,要握紧烧瓶并护住塞子,快速而有力地来回振摇,往往最初的数下有力振摇即可达到要求。钠珠的颗粒大小决定着与酯反应的速度,钠珠越细越好,应呈小米粒状,否则须重新加热熔融再摇。
[3]乙酸乙酯必须绝对无水(可以含1%~3%乙醇),如果含较多水或乙醇,必须进行提纯:将需提纯的乙酸乙酯用饱和氯化钙溶液洗涤数次,再用焙烧过的无水碳酸钾干燥,蒸馏,收集76~78℃馏分。
[4]如果还有少量钠,不影响下一步操作,但酸化时须小心操作。
[5]酸化时,开始有固体乙酰乙酸乙酯钠盐,继续酸化,固体逐渐转化为游离的乙酰乙酸乙酯而成为澄清的液体。如果最后还有少量固体未完全溶解,可加少量水溶解,但不要加过量的醋酸,否则会因为乙酰乙酸乙酯的溶解度增加而降低产量。
[6]可以用磁力搅拌代替毛细管法进行减压蒸馏。乙酰乙酸乙酯在常压蒸馏时易分解,产生“去水乙酸”。本实验最好连续进行,间隔时间太久再减压蒸馏,也会由于去水乙酸的形成而使产量降低。反应式如下:
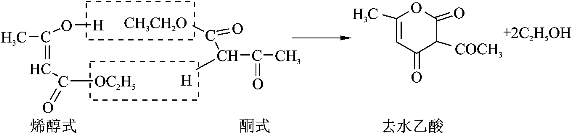
关于“去水乙酸”名称的由来可参看:张本才.化学通报.1991.12.51-54。
实验指导
【预习要求】
1.复习Claisen酯缩合反应及其反应机理。
2.认真阅读实验注释,熟悉安全使用金属钠的操作方法和注意事项。
3.参看“实验2”,了解减压蒸馏基本操作。
【思考题】
1.为什么与羰基相连碳上的氢有酸性?如何用实验方法证明乙酰乙酸乙酯是两种互变异构的平衡混合物?
2.制备钠珠时,为什么使用二甲苯做溶剂,而不用苯或甲苯?
3.为什么用醋酸酸化,而不用稀盐酸或稀硫酸酸化?酸化时,为什么要调至弱酸性,而不是中性?
4.分离提纯时,使用饱和氯化钠溶液的目的是什么?
(编写:陈国辉 校核:罗一鸣)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















