第二节 原子光谱与玻尔理论
卢瑟福的原子模型
19世纪,人们已经知道物质是由原子组成,其线度大约是10-10m,人们不禁要问,原子是否不可再分割了。但是这个问题一直无法解决,直到19世纪末,由于伦琴射线、放射性和电子的发现,才使人们开始进入到比原子更小的微观世界的研究。此时,研究带负电的电子和带正电的物质是如何构成原子的已经成为物理学的一个重要课题。卢瑟福等人采用了利用高能粒子与原子碰撞,观察与分析所发生的一些现象,由此可以探索原子内部的结构的实验方法。
1909年,卢瑟福做了著名的α粒子散射实验,他用α粒子穿射金箔。发现入射束中多数粒子仍保持其原来的方向,但也有不少粒子偏转了很大角度。
卢瑟福认为,只有原子中的绝大部分质量和正电荷集中在一个体积很小的范围内(直径约为10-12—10-13 cm,约为原子直径的1/104—1/105),才有可能出现大角度散射。原子中这个集中了绝大部分原子质量并带正电荷的粒子被称为原子核。于是,原子是由原子核和绕核旋转的电子组成。带负电的电子则在很大的空间里绕核运动,它看起来就像行星绕太阳的运动。所以把卢瑟福的原子有核模型又称作“行星模型”。卢瑟福获得了1908年度诺贝尔化学奖。
原子光谱的实验规律
在原子理论建立以前,人们已经积累了有关原子光谱的大量实验数据。每种原子都有各自的特征光谱,原子光谱的规律是:①光谱是线状、分立的,谱线一定位置有确定的波长值;②谱线间有一定的关系,它们的波长可以用一个公式表达出来;③每一谱线的波数可以表示为二光谱项之差。例如,氢原子光谱的波数可以表达为
![]()
式中,R为里德伯常数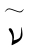 为波数(波数是指单位长度内所含波的数目);m和n为正整数,对每一个m,n=m+1,rn+2,m+3,…构成一个谱线系。
为波数(波数是指单位长度内所含波的数目);m和n为正整数,对每一个m,n=m+1,rn+2,m+3,…构成一个谱线系。
玻尔理论
按照经典电磁场理论,电子绕原子核旋转就必然辐射电磁波,随着能量的辐射,电子的半径必然越来越小,速度也越来越小,则辐射的就不会是线状光谱而是连续谱,这与原子线状光谱的实验事实不符。同时由于辐射的缘故,电子的能量就会减少,电子逐渐接近原子核,最后落到核上。
可见,经典理论不能解释原子有核模型。这一难题被丹麦物理学家尼耳斯·玻尔解决了,他把光谱实验规律和光量子说结合起来,建立了原子结构的量子理论,被后人称为玻尔理论。
1.玻尔理论的三条基本假设
玻尔理论的三条基本假设如下。
(1)定态假设
原子系统只存在一系列不连续的能量状态,处于这些状态的原子,其相应的电子只能在一定的轨道上绕核作圆周运动,但不辐射能量。这些状态称为原子系统的稳定态(简称定态),相应的能量分别取一系列不连续的量值。
(2)跃迁假设
当电子从一个定态轨道跃迁到另一个定态轨道时,伴随着光子的发射和吸收。如果原子从高能态跃迁到低能态,原子发射光子;如果原子要从低能态跃迁到高能态,则要吸收一个光子能量。对于这种辐射来说,频率和所发射的能量之间的关系式如下。
hν=|E2-E1|
式中,h为普朗克常量;ν为频率;hν为发射出的光子的能量;E1、E2是原子辐射前、后的能量。
如果E1<E2,原子是发射辐射,反之吸收辐射。上式是玻尔提出的频率公式,又称辐射公式。
(3)角动量量子化条件对原子的任一定态,每一电子绕其轨道中心的角动量L等于h/2π的整数倍,即角动量只能取分立值,是量子化的。
2.玻尔理论对氢原子光谱的解释
玻尔由三条基本假设出发,计算出氢原子的轨道半径和能量公式如下。氢原子的轨道半径为
![]()
氢原子能量公式为
![]()
式中,h为普朗克常数;m为电子的质量;e为电子的电量;ε0为真空中的介电常数;n为量子数,只能取正整数。
可见,氢原子的轨道半径和能量都是不连续的,即是量子化的。
把这种量子化的能量值称为原子能级(简称能级)。当n=1时,能量最小,原子最稳定,这种状态称为基态。量子数n大于1的各个稳定状态,其能量大于基态,称为受激状态。每一条横线代表一个能级。当氢原子由一个能级跃迁到另一能级时,就产生一条谱线。当氢原子由n≥2的能级向基态跃迁时,所得的谱线系即赖曼系,由n≥3的能级向n=2的能级跃迁时即巴耳末系……。玻尔的计算结果与实验数据符合得很好。
3.玻尔理论的巨大成功及其局限性
玻尔理论对氢原子光谱的解释获得了很大的成功。他所提出的分立定态概念、原子能级的存在和光谱线频率的假设都得到了实验的直接验证,在原子结构和分子结构的现代理论中仍然是普遍正确的。玻尔的创造性工作对现代量子力学的建立有着深远的影响。
但玻尔的量子理论对于稍为复杂一些的碱金属光谱就难以解释,而对谱线的强度、色散现象、偏振等问题更无法处理。后来,虽经索末菲等人的修改,扩充成玻尔一索末菲理论,但应用到一般原子现象时,仍有着不可克服的困难。直到1926年,薛定谔等人建立了描述微观粒子运动的一门学科——量子力学。这时,才使人们对微观粒子的运动规律有了更全面、深刻的认识。尽管如此,玻尔一索末菲理论在原子理论和量子力学的发展过程中起过很大的作用,其功绩还是不可磨灭的。玻尔获得1922年诺贝尔物理学奖。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














