分子之间也有相互作用
一个水分子的质量是2.99×10-23克,谁能观察到这么小的质点?纵使你练得孙悟空那样的火眼金睛也是枉然。我们能观察到的水,无论是飞流直下的瀑布,还是清澈见底的涓涓溪流,不论是浩瀚无垠的大海,还是大海中的一滴水,都是由许许多多的,甚至是数不清的水分子聚集而成的。只有无数的水分子聚集起来,我们才能观察到水的物理性质。水在常温常压之下,是无色透明流动的液体,加热到100℃(绝对温度373.16K)时,水会沸腾,变成水蒸气,到了冬天,气温下降到0℃(273.16K)以下,天空中的水蒸气会凝结成美丽的小雪花,飘向大地,湖面会结成一层厚厚的冰,成为我们溜冰的好场所。这就是我们常说的水的固、液、气三种聚集状态,简称三态。其实,不只是水,其他物质也都有三态变化,就连O2、N2甚至稀有气体在高压、低温之下也可以液化,甚至变成固体。比如:氦在0.23兆帕压强下,—267.8℃(绝对温度5.36K)可以液化,这温度距离绝对零度只有一步之遥,绝对零度时物质的性质会出现许多意想不到的变化。
为什么一种物质会有三种状态呢?也就是气体分子为什么会凝聚成液体或固体呢?善于透过现象看本质的人,就会想到在中性分子之间是否存在着某种相互作用力,靠着这种力的作用才能把分子凝聚在一起。这就是1877年,范德华首先提出的“分子间力”,又叫做“范德华力”。
因为分子的极性不同,使分子间的相互作用力也不尽相同,范德华力可分为三种情况:
第一种力:存在于极性分子与极性分子之间。水中有两个H—O键,由于O对电子的吸引力比H强,电子偏靠O一方,H—O键为极性键,水是折线型分子,水分子内部的正、负电荷的重心不重合。水是一个极性分子,如果两个水分子相互接近,因为同极相斥、异极相吸,分子会发生相对转动,转动的结果是出现分子之间异极相连接(一个分子的正极与另一个分子的负极相接)的排列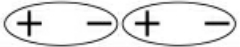 ,这时就会呈现出分子之间的相互的“静电引力”。
,这时就会呈现出分子之间的相互的“静电引力”。
第二种力:存在于极性分子与非极性分子之间,也存在于极性分子之间。比如:CO2分子中C—O键是极性键,CO2是非极性分子,也就是分子的正、负电荷的重心是重合的。当CO2遇到水分子时,水分子的正电荷重心会将CO2的负电荷重心拉向自己,而将正电荷重心推得远离自己,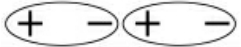 使CO2分子的电子云变了形,CO2分子在极性水分子的诱导下产生了正、负电荷重心不重合的情况,致使水和变了形的CO2分子之间也产生一种静电引力,所以CO2在水中有一定溶解度。氦、氖、氩、氪、氙这些稀有气体在水中的溶解度依次增大,也是因为从He到Xe原于体积递增,在水分子的诱导下,变形也递增,稀有气体与水分子之间的引力也依次增大。
使CO2分子的电子云变了形,CO2分子在极性水分子的诱导下产生了正、负电荷重心不重合的情况,致使水和变了形的CO2分子之间也产生一种静电引力,所以CO2在水中有一定溶解度。氦、氖、氩、氪、氙这些稀有气体在水中的溶解度依次增大,也是因为从He到Xe原于体积递增,在水分子的诱导下,变形也递增,稀有气体与水分子之间的引力也依次增大。
这种引力也发生在两个极性分子之间,分子发生相对转动之后,产生异极相连,两分子异极相吸、同极相斥,彼此都会产生正、负电荷重心不重合程度加大的情况,也就是两个分子互相诱导,都有变形产生。
第三种力:广泛存在于极性分子间、极性分子与非极性分子间及非极性分子之间。这是由于在分子中电子的运动永不停息,原子核也在不停地振动,电子云和原子核之间将会发生相对位移。本来正负电荷重心不重合的极性分子会更加不重合,本来正负电荷重心重合的非极性分子,出现了不重合的情况。尽管这种相对位移发生在一刹那或者一瞬间,但它不断重复出现,结果使得分子之间始终存在着这种由于电子云和原子核之问发生瞬间相对位移而引起的静电引力。这种作用力普遍存在于各种分子之间。正是有了这种微弱的作用力的存在,才能使CO2气体分子变成干冰。如同脱缰的野马一般又稀少、又难驯服的氦气也可以被装进钢瓶。但是因为氦原子之间像其他非极性分子一样,仅存在第三种力,而水分子之间三种力同时存在,所以氦的液化温度当然要比水低了(水的沸点高的另一个原因是分子间氢键的存在)。
还有一点需要注意,一些非极性分子的气体只是降低温度不能使它液化,必须加压,因为范德华力一般来说比化学键能小1~2个数量级,且作用范围只有300~500皮米,而分子间力与两分子间距离的6次方成反比,随着距离的增加,作用力会骤减。所以一定要在足够的压强之下,使非极性分子足够接近,才能显示出第三种力的凝聚作用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















