大自然的巧妙安排
回顾阿伏加德罗100多年前宣称氧气、氢气等单质分子分别是由两个氧原子、两个氢原子构成的时候,这一科学论断无论如何是难以被当时的人们所理解和接受的。因为设想两个氧原子中有一个失电子变成阳离子,而另一个却得电子变成阴离子,两者结合成氧气分子,的确是令人难以想象的。水、二氧化碳等无机化合物和绝大多数有机化合物不能导电,假设它们在水溶液中或熔融状态可以解离成阴、阳离子,也同样不合逻辑。事实上,这些单质和化合物是不同于离子化合物的另一大类,它们中的化学键也应作另类处理。
现在称这种类型的化合物是共价化合物,它们分子中原子间的化学键叫共价键。有关共价键的理论最早是由美国人路易斯(1875—1946)在1916年提出来的。所谓共价键就是指通过共用电子对把两个或多个原子结合在一起的化学键。
当两个非金属原子相遇时,如果原子中有成单电子但自旋方向相同时,则它们彼此没有缘分,相遇又分开。如果原子中各有一个成单电子且自旋方向相反,彼此就可以配成一对,使两原子结合在一起形成分子。例如: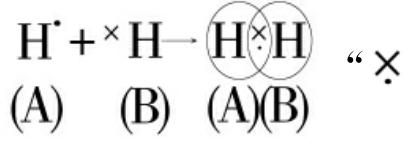
”叫做“共用电子对”在氢分子中,电子对为HA和HB所共有。这样HA有稀有气体He的电子结构,HB也是一样。这一对电子在两个H周围不停地运动,只是在两核之间出现的机会比在别处多些。由于这一对电子被两个核同时吸引,把两个原子维系在一起,这种原子间通过共用电子对所形成的化学键叫做“共价键”。电子都是一个模样,不可能辨别X或·,也分不清·属HA,X属HB,2个H原子化合之后,电子对的所有权是整个分子的。因为是同种元素的原子,原子核对共用电子对的吸引力是相等的,两原子共享电子对的机会也均等,这种化学键叫作非极性共价键。
对于两个不同种的非金属原子,如H和Cl,虽然Cl比H吸引电子的力量大些,但H顽强抗争,硬是不肯出让电子,故还是得采取共用电子对的折衷办法,只不过电子对向Cl偏移,这样就形成“极性共价键”。其中H周围有2个电子,Cl周围有8个电子,都满足稀有气体的稳定结构。共用电子对能使两原子双方都得到满足,这就应了我国化学界老前辈傅鹰教授的一句话:“和衷共济,皆大欢喜。”
可是早期的共价键理论并不能解释共价分子的所有结构问题,科学就是在不断提出问题、不断解决问题中进步。
以最简单的有机化合物甲烷CH4为例:C原子的最外层电子排布是2S2,2P2,仅2p轨道上有两个成单电子。但是光谱实验证明,CH4分子中确实存在着4个完全等同的C—H键。为什么能形成4个完全等同地指向正四面体的4个顶点的共价键,从而使分子呈现正四面体的空间构型呢?这是因为在C和H化合过程中,C原子中能量相近的1个2s和3个2p原子轨道发生了相互间的混合,相互调整成能量完全相等的4条杂化原子轨道,外层的4个电子分别占领这4条轨道,4个氢原子各提供1个自旋方向相反的电子,在C、H之间形成4对共用电子对,这就形成了4个完全等同的C-H共价键。这4对电子对在空间趋向尽可能彼此远离,分子尽可能采取对称结构,这样电子对之间的排斥力最小,分子最稳定。对于CH4来说最合理的空间排布是正四面体,键角全是109°28′(图2—3)。
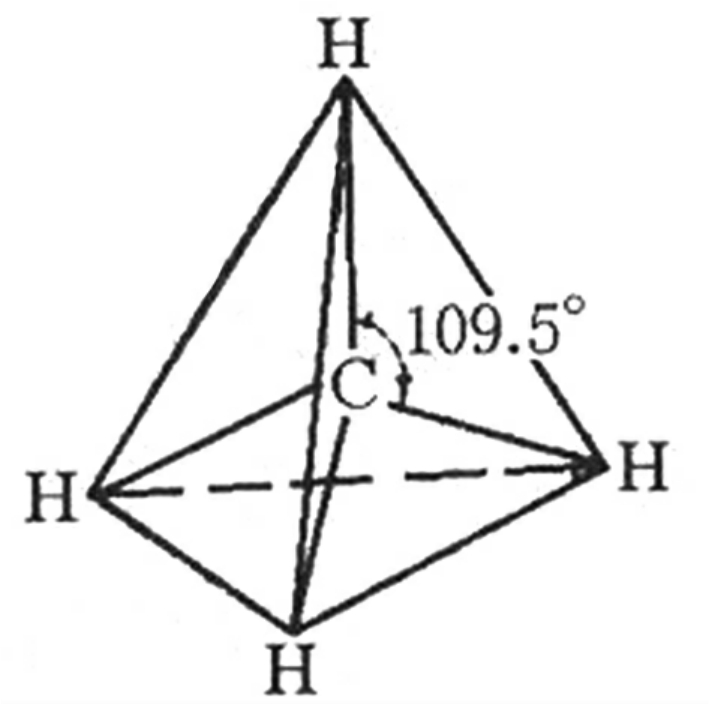
图2-3 甲烷分子空间结构示意图
我们已经知道CH4形成共价键时,C和H原子参与成键的轨道数和参与成键的电子数相等。但如果对于电子数多于轨道数原子成键之后对分子的空间构型又会有怎样的影响?例如:NH3分子中N原子的最外层有5个电子2S2、2P3,杂化之后能量完全等同的杂化轨道仍然是4个,必然是一个轨道上容纳1对自旋相反电子,不能参与成键,这样的电子叫“孤对电子”。另外3个轨道上分别有3个成单电子,与3个H原子的电子成键,N原子周围是3个N—H键和一对孤对电子,似应分别指向正四面体的顶点,可是由于孤对电子对成键电子对有较大的排斥力,使得NH3分子中,H—N—H键角被压缩,不再是109°28′,而是107°20′,因而NH3的空间构型是三角锥(图2—4)。

图2-4 氨分子空间构型示意图
H2O分子中的O原子最外层有6个电子2S22P4,4个能量完全相等的轨道中有两条已被2对孤对电子占满,不再成键,这两对孤对电子对成键的H—O键的排斥力更大,所以H—O—H键角被挤压得更小了,成为104°30′。H2O分子的空间构型是折线型,而不是直线型,与CO2的构型不同。H2O中O原子参与杂化的轨道是4个,而CO2中C原子参与杂化的轨道只是2s、2p各1个,CO2空间构型为直线型,C—O键是极性共价键,但由于结构对称,所以是非极性分子,而水是折线结构的极性分子(图2—5)。

图2-5 水分子空间构型示意图

三角双锥空间构型
在CH4、NH3、H2O分子中,C、N、O都是用1个s轨道3个p轨道形杂化原子轨道,故称之为SP3杂化。
前面所介绍的共价型分子中,原子间通过共用电子对形成共价键后,每个原子的最外层都达到稀有气体的稳定电子结构。但所有的共价化合物中各原子间成键以后,是否必须满足这一点呢?为此,让我们再多认识一些共价化合物分子的结构。比如PCl5(图2—6a)P原子最外层共有10个电子,而SF6中S原子的最外层有12个电子(图2—7a)再看BCl3,B原子最外层只有6个电子(图2—8a),以上分子都不符合稀有气体的电子结构,但也能稳定存在,这是为什么呢?因为磷有1个s轨道、3个p轨道、1个d轨道,彼此相混,重新调整成能量完全相等的5个轨道,这种情况称为sp3d杂化,每个轨道上有1个电子,所以能接纳5个Cl原子的5个成单电子,形成能量完全等同的P—C1键,它们在空间的最稳定的对称结构应该是三角双锥(图2—6b)。
SF6中的S原子则是1个s轨道、3个p轨道和2个d轨道间进行的sp3d2杂化,形成6对共用电子对,SF6的空间构型是正八面体(图2—7b)。

图2-7b 正八面体SF6分子的空间构型
BCl3中B原子参与杂化的轨道是1个s,2个p,共3条轨道,是sp2杂化,你能想象出它的空间构型吗?它是平面三角形,键角是120°(图2—8b)。

图2-8b 正三角形
通过以上这些例子说明,是否达到8电子稳定结构,不是形成共价键的必要条件。形成共价键的必要条件是成键的原子间通过共用自旋相反的电子对,使两个原子核间电子出现的机会增多,因而将两核联系起来,彼此间产生了强烈的相互作用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















