实验技术十四 乙酰苯胺的制备
【实验目的】
(1)学习实验室制备芳香族酰胺的原理和方法。
(2)训练固体有机物的过滤、溶解、洗涤、脱色、重结晶、干燥等纯化技术。
【实验原理】

芳香族酰胺通常用伯或仲芳胺与酸酐或羧酸反应制备,因为酸酐的价格较贵,所以一般选羧酸。本反应是可逆的,为提高平衡转化率,加入了过量的冰醋酸,同时不断地把生成的水移出反应体系,可以使反应接近完成。为了让生成的水蒸出,而又尽可能地让沸点接近的醋酸少蒸出来,本实验采用较长的分馏柱进行分馏。实验中加入少量的锌粉,是为了防止反应过程中苯胺被氧化。
【试剂的物理常数】
见表5-5。
表5-5 试剂的物理常数

【仪器装置】
本反应采用了带分馏柱的反应装置(见图5-11),使用分馏柱的目的在于期望将该可逆反应中沸点最低的产物之一———水,通过分馏方法移出反应体系,从而增加产物乙酰苯胺的产率。使用分馏柱不但可以使水蒸出体系,同时可以使沸点与水相差很大且定量加入的苯胺回流,再进入反应液继续参加反应。醋酸的加入量是过量的,因为其沸点与水的沸点相差不很大,在通过分馏柱时仍有少量随水一并蒸出。
【实验步骤】
1.投料
在25mL圆底烧瓶中,加入10mL苯胺、1.5mL冰醋酸及少许锌粉(约0.01g),然后装上一短的刺形分馏柱,其上端装一支温度计,支管通过支管接引管与接收瓶相连,接收瓶外部用冷水浴冷却。
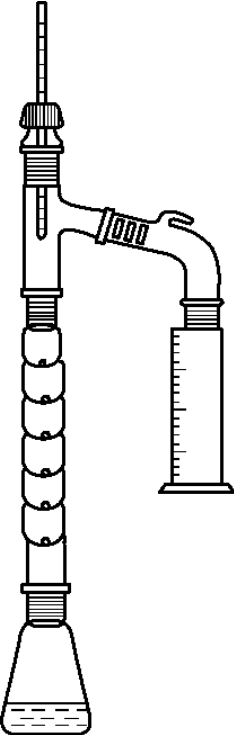
图5-11 乙酰苯胺制备实验装置
2.反应
将圆底烧瓶在石棉网上用小火加热,使反应物保持微沸约15min。然后逐渐升高温度,当温度计读数达到100℃左右时,支管即有液体流出。维持温度在100~110℃之间反应约1.5h,生成的水及大部分醋酸已被蒸出。
3.分离提纯
此时温度计读数下降,表示反应已经完成。在搅拌下趁热将反应物倒入10mL水中,冷却后抽滤析出的固体,用冷水洗涤。粗产物用水重结晶,产量0.6~0.9g,熔点113~114℃(文献值114.3℃)。
【实验注意事项及建议】
1.实验注意事项
(1)久置的苯胺色深有杂质,会影响乙酰苯胺的质量,故最好用新蒸的苯胺。另一原料乙酸酐也最好用新蒸的。
(2)加入锌粉的目的,是防止苯胺在反应过程中被氧化,生成有色的杂质。通常加入锌粉后反应液颜色会从黄色变无色。但不宜加得过多,因为被氧化的锌生成氢氧化锌,为絮状物质,会吸收产品。
(3)作为产物之一的水和原料醋酸的沸点相差很小,所以用分馏的方法分出水。可用10mL量筒作为分馏接收器,量筒置于盛有冷水的烧杯中。收集乙酸和水的总体积约2.25mL。
(4)不可以用过量的水处理乙酰苯胺。
(5)不应将活性炭加入沸腾的溶液中,否则会引起暴沸,会使溶液溢出容器。
(6)反应物冷却后,固体产物立即析出,沾在瓶壁不易处理。故须趁热在搅动下倒入冷水中,以除去过量的醋酸及未作用的苯胺(它可成为苯胺醋酸盐而溶于水)。
2.建议
(1)本实验合成部分较易操作,产品的精制特别是重结晶、热过滤操作较难。产品损失多发生在过滤一步。
(2)如果时间允许,建议安排测熔点,可以巩固已有的操作,也可以让学生亲自体会到测熔点的用处。
(3)引导学生深刻理解体会操作步骤的表述。例如:“在不断地搅拌下把反应混合物趁热以细流慢慢倒入100mL水的烧杯中。”其中“~~~~~”符号就有利于培养学生对文献资料的理解能力。
(4)学生在做操作流程图时,对产物精制操作的目的,除去什么副产物、杂质等可能不清楚,应加强辅导。
(5)引导学生正确使用科学术语,例如:饱和溶液、滤液、结晶、晶体等概念要清楚,使用要准确。
(6)计算反应的理论产率和实际产率,培养学生物料平衡的概念。
【思考题】
本反应为什么要控制分馏柱顶端温度在100~110℃?
(提示 主要由原料CH3COOH(沸点117℃)和生成物水(沸点100℃)的沸点所决定。控制在100~110℃,这样既可以保证原料CH3COOH充分反应而不被蒸出,又可以使生成的水立即被移走,促使反应向生成物方向移动,有利于提高产率。)
【操作要点和说明】
1.合成
1)反应物量的确定
本实验反应是可逆的,采用乙酸过量和从反应体系中分出水的方法来提高乙酰苯胺的产率,但随之会增加副产物(二乙酰基苯胺)的生成量。在产物精制过程中通过水洗、重结晶等操作,二乙酰基苯胺容易水解成乙酰苯胺和乙酸,经过滤可除去乙酸,不影响乙酰苯胺的产率和纯度。
苯胺极易被氧化,在空气中放置会变成红色,使用时必须重新蒸馏除去其中的杂质。反应过程中加入少许锌粉。锌粉在酸性介质中可使苯胺中的有色物质还原,防止苯胺继续氧化。在实验中可以看到,锌粉加得适量,反应混合物呈淡黄色或接近无色。但锌粉不能加得太多,一方面消耗乙酸,另一方面在精制过程中乙酸锌水解成氢氧化锌,很难从乙酰苯胺中分离出来。
2)合成反应装置的设计
水沸点为100℃,乙酸沸点为117℃,两者仅差17℃,若要分离出水而不夹带更多的乙酸,必须使用分馏反应装置,而不能用蒸馏反应装置。本实验用分馏柱。
一般有机反应用耐压、耐液体沸腾冲出的圆形瓶作反应器。由于乙酰苯胺的熔点为114℃,稍冷即固化,不易从圆形瓶中倒出,因此用锥形瓶作反应器更方便。
分出的水量很少,分馏柱可以不连接冷凝管,在分馏柱支口上直接连尾接管,兼作空气冷凝管即可,使装置更简单。
为控制反应温度,在分馏柱顶口插温度计。
3)操作条件的控制
保持分馏柱顶温度在100~110℃的稳定操作:开始缓慢加热,使反应进行一段时间,有水生成后,再调节反应温度使蒸汽缓慢进入分馏柱,只要生成水的速度大于或等于分出水的速度,即可稳定操作。要避免开始强烈加热。
反应终点可由下列参数决定:
(1)反应进行40~60min。
(2)分出水量超过理论水量(1g),但这和操作情况和分馏柱的效率有关,如果乙酸蒸出量大,分出的“水量”就应该多。
(3)反应液温度升高,瓶内出现白雾。
2.产物的分离精制
产物经洗涤、过滤等操作后,用重结晶的方法进行精制。乙酸苯胺重结晶常用的溶剂有甲苯、乙醇与水的混合溶剂、水等。本实验用水作重结晶的溶剂,其优点是价格便宜、操作简化、减少实验环境污染等。同时将用活性炭脱色与重结晶两个操作结合在一起,进一步简化了分离纯化操作过程。
根据乙酸苯胺-水的相图可知乙酸苯胺在水中的溶解度与温度的关系(见表5-6)。
表5-6 乙酸苯胺在水中的溶解度与温度的关系

乙酰苯胺在水中的含量为5.2%时,重结晶效率高,乙酰苯胺重结晶产率最大。在体系中的含量稍低于5.2%,加热到83.2℃时不会出现油相,水相又接近饱和溶液,继续加热到100℃,进行热过滤,除去不溶性杂质和脱色用的活性炭,滤液冷却,乙酰苯胺开始结晶,继续冷却至室温(20℃),过滤得到的晶体乙酰苯胺纯度很高,可溶性杂质留在母液中。
本实验乙酰苯胺的理论产量为7.4g,需150mL水才能配制含量为5.2%的溶液,但每个学生的实验的转化率不同,在前几步过滤、洗涤等操作中又有不同的损失,同学间的乙酰苯胺量会有很大差别,很难估计用水量。一个经验方法是按操作步骤给出的产量5 g(初做的学生很难达到),估计需水量为100mL,加热至83.2℃,如果有油珠,补加热水,直至油珠溶完为止。个别同学加水过量,可蒸发部分水,直至出现油珠,再补加少量水即可。
为使热过滤顺利进行,避免乙酰苯胺析出,必须先将漏斗预热充分,迅速取出、装配、过滤,被滤液也应加热至沸,马上过滤。
重结晶操作时,乙酰苯胺不宜长时间加热煮沸。
热过滤的滤纸要用优质滤纸。滤纸要剪好,防止穿滤。
减压抽滤时,真空度不宜太高,否则滤纸在热溶液作用下易破。
3.产品的鉴定
最简单的方法是测其熔点,有条件的可作红外光谱。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















