5.3.3 反应机理和动力学计算
综上所述,在BMC-CCSD//B3LYP水平下通过计算反应CH2CO+3CH2我们得到的可行反应通道为
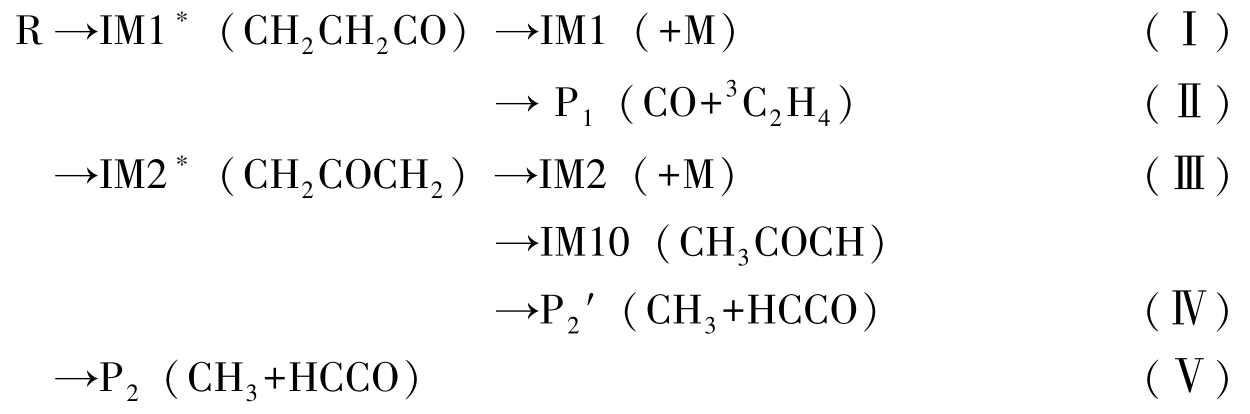
其中反应(Ⅴ)为直接氢提取通道。对于这5条反应通道,由于通道(Ⅱ)中决速步的能量最低,且随后解离过程中的过渡态TSIM1/P1能量低于反应物,因此是最可行的反应通道,对应产物P1(CO+3C2H4)。对于生成另一产物P2(CH3+HCCO)存在两条通道(Ⅳ)和(Ⅴ)(为了区别生成同一产物P2的两个通道,我们把通道(Ⅳ)中的产物标记为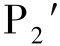 ′)。虽然通道(Ⅴ)的决速能垒为9.7 kcal/mol,稍高于通道(Ⅳ)中的决速能垒(8.3 kcal/mol),但由于反应过程简单,且通道(Ⅳ)中由于其进一步解离的能垒很高而其过渡态TSIM2/IM10位于反应物之上,与通道(Ⅳ)相比具有很强的竞争性。因此我们推测最终产物P2是由直接氢提取反应得到,这与Banyard等的实验预测相反。
′)。虽然通道(Ⅴ)的决速能垒为9.7 kcal/mol,稍高于通道(Ⅳ)中的决速能垒(8.3 kcal/mol),但由于反应过程简单,且通道(Ⅳ)中由于其进一步解离的能垒很高而其过渡态TSIM2/IM10位于反应物之上,与通道(Ⅳ)相比具有很强的竞争性。因此我们推测最终产物P2是由直接氢提取反应得到,这与Banyard等的实验预测相反。
为了更好地理解CH2CO+3CH2的反应,我们对目前的理论研究和实验结果进行了详细的比较,对此反应的以上几个通道在BMC-CCSD//B3LYP水平上,利用VTST和主方程方法进行了速率常数的计算。
(1)直接氢提取反应通道。
对通道(Ⅴ)的过程如下:
R(CH2CO+3CH2)→P2(CH3+HCCO)
利用以上得到的势能面信息,采用变分过渡态理论结合小曲率效应校正的方法计算了在195 K~2200 K温度范围内的速率常数。图5.3给出了这个温度区间的速率常数随温度的依赖关系。从图中可以看出,氢提取反应通道的TST和CVT曲线在整个温度区间重合在一起,说明变分效应对直接氢提取反应的速率常数计算没有影响。此外,对比CVT和CVT/SCT曲线可以看到,小曲率隧道效应校正(SCT)在低温区间对直接氢提取反应的速率常数计算起到重要作用。在195 K时,氢提取反应通道的速率常数值为1.68×10-20cm3molecule-1s-1,远小于测得的实验值1.0×10-17cm3molecule-1s-1。当温度为298 K和2200 K温度时,直接氢提取反应的速率常数值分别为3.31×10-18cm3molecule-1s-1和4.91×10-12cm3molecule-1s-1。随着温度的升高速率常数呈现正温度依赖性。
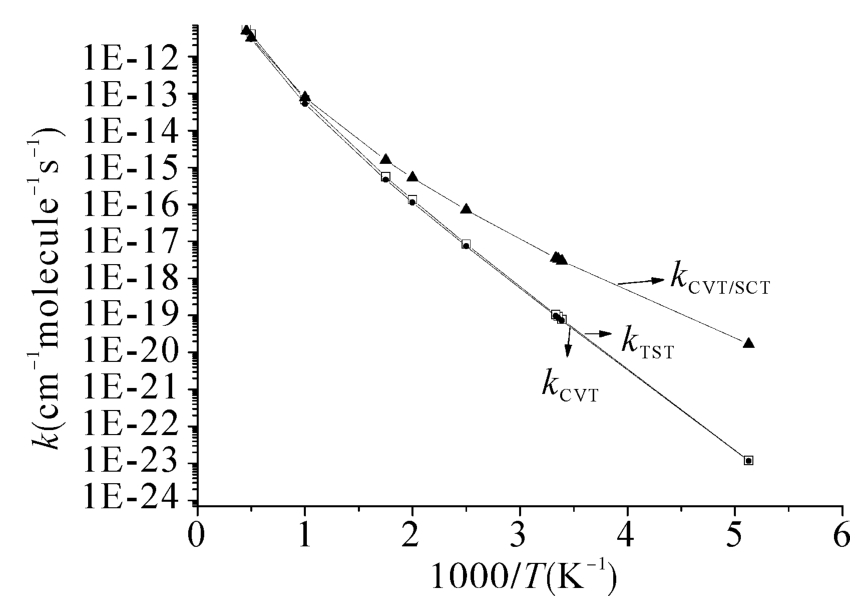
图5.3 在BMC-CCSD//B3LYP/6-311G(d,p)水平下,直接氢提取反应在195 K~2200 K温度区间内计算获得的TST、CVT和CVT/SCT速率常数随温度的变化曲线
(2)加成反应通道。
为了深入地理解和比较上述讨论中可行的通道(1)~(4)的竞争关系,我们在较宽的温度范围(195 K~2200 K)和压力范围(0 bar~1.63×105bar)内基于BMC-CCSD//B3LYP/6-311G(d,p)水平下计算了CH2CO+3CH2加成反应的主方程速率常数。表5.2列出了生成产物P1的速率常数随温度和压力的变化曲线。对于生成产物P1的通道,Chanmugam等在300 K~571 K温度区间和4800 bar压力下测得反应速率常数为6.06×10-17cm3molecule-1s-1~3.0×10-17cm3molecule-1s-1,并得出在这个温度区间生成产物P1的通道具有负的温度依赖性,我们的计算结果与Chanmugam等在低温下的实验值接近,随着温度的升高反而高于实验值;而Wilson等在298 K温度和8399 bar~2.88×104bar的压力区间测得的值为1.25×10-17cm3molecule-1s-1,与Powell-Wilffen等的结果(1.5±0.19)×10-17cm3molecule-1s-1相近。可以看出,在室温下,我们的计算结果与Wilson等的实验结果比较符合,但却比Frank等在2200 K温度和1.63×105bar的压力下测得该反应通道的速率常数的上限为1.66×10-12cm3molecule-1s-1时高近10倍。另一方面,从表中可以看出,对于加成反应通道(2),在整个温度区间和压力区间,速率常数呈现正温度依赖性和负压力依赖性。
对于CH2CO与3CH2的反应,Darwin D.C.和Moore C.B.在295 K温度和133 bar压力下测定了该反应的总反应速率常数值的上限为3.5×10-13cm3molecule-1s-1。由于该反应的过渡态位于反应物之上,因此我们计算的速率常数很低,不会超过David等给出的实验值。
图5.3(a)和(b)显示了在低压极限和高压下5条反应通道的分支比。如图5.3(a)所示,在低压极限下的整个温度区间生成产物P1的通道都占据着主要地位,是其主要产物。产物P2是次要产物通道,由于该产物可以经由两个反应通道获得,在低温区间这两个通道相互竞争,而在高温区间直接氢提取反应获得的产物是该产物的主要来源。如图5.3(b)所示,在1500 K以下的温度区间,中间体IM1都是占绝对优势的产物,随着温度的升高,产物P1的分支比超过IM1而成为最主要的产物。另外,在约600 K以下的温度区间,产物P2(CH3+HCCO)是CH2CO+3CH2反应的主要产物,当温度超过600 K时,产物P1的产量超过P2。形成中间体IM2的通道在整个温度区间与中间体IM1相比都不具竞争性。当温度高于2000 K时,中间体IM1的产量小于两个产物的产量,变成次要产物。图5.4(a)和图5.4(b)分别显示了5条反应通道在298 K和2200 K的分支比随压力的变化关系。如图5.4(a)所示,IM1的分支比随着压力的升高而增加,当压力达到2.88×104时,中间体的产量不受压力影响。而P1的速率变化趋势正相反,即随着压力的升高而降低。其他中间体和产物不受压力影响,即不具有压力依赖性。在我们考虑的压力范围(0 bar~1.63×105bar)内,当温度升高到2200 K时,P1是主要产物,经过直接氢提取反应得到的产物P2是第二主要的产物,而通过加成得到的产物P2的贡献很小。在2200 K的高温条件下3个中间体的产率也很小。
我们结合势能面和主方程速率常数计算的研究表明,CH2CO+3CH2的反应在整个温度区间加成反应通道都是主反应通道,但对连接低压和高压的中间下降区的总反应速率常数的几乎不受压力影响。我们的计算结合了反应在0 bar~1.63×105bar压力和195 K~2200 K温度区间,总反应速率常数具有正温度依赖性。
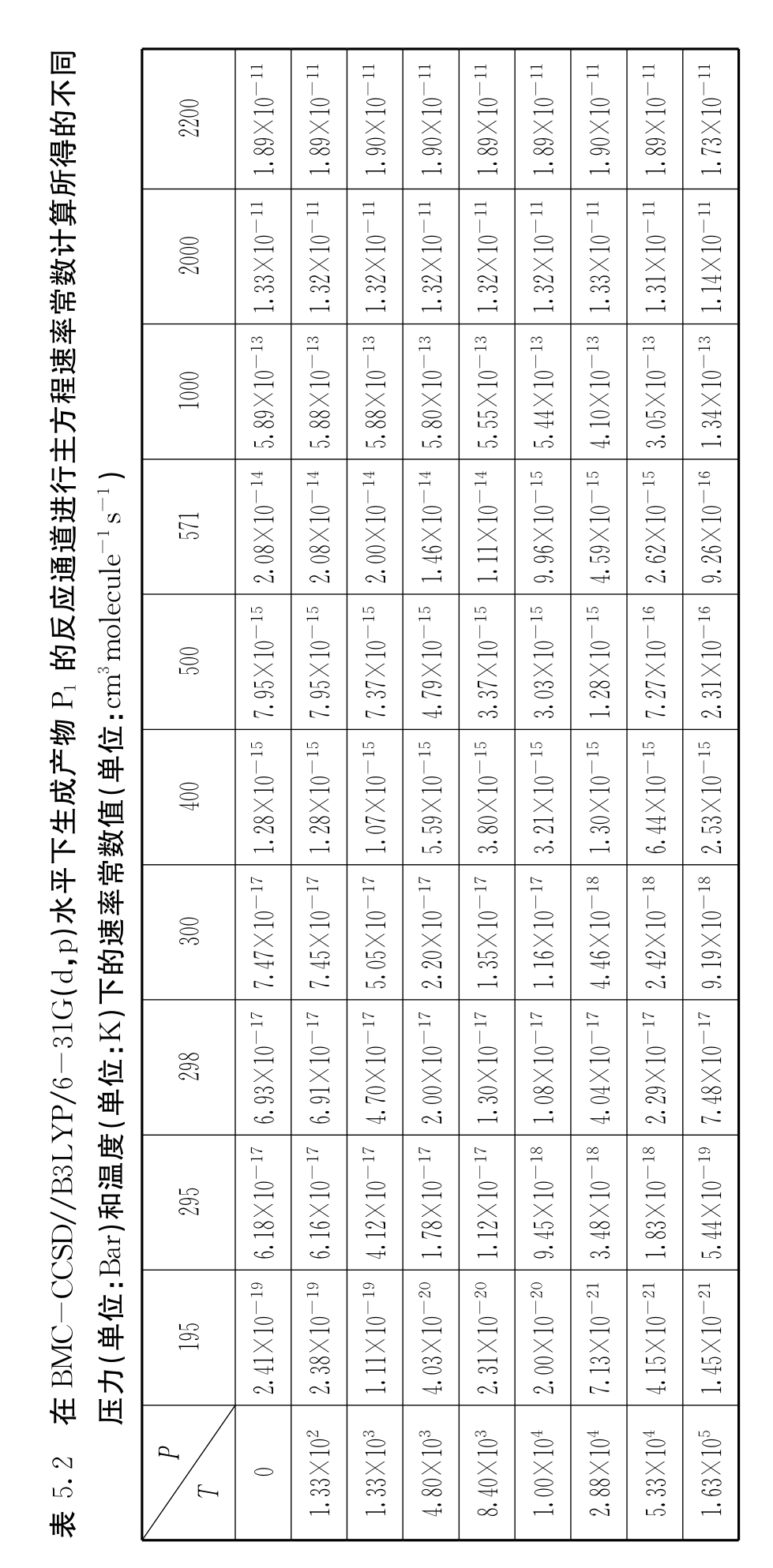
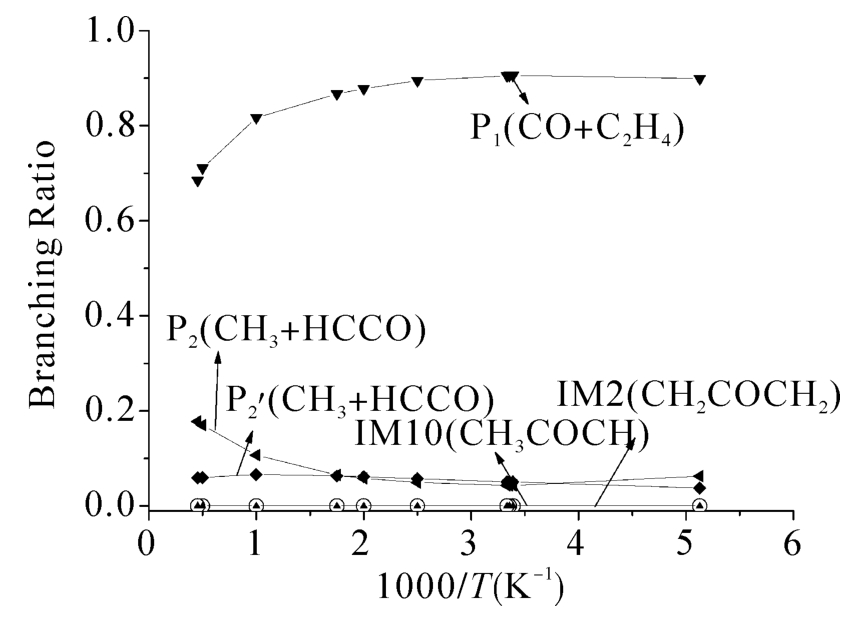
图5.3(a) 各个反应通道在低压极限下的速率常数占总反应速率常数的百分比
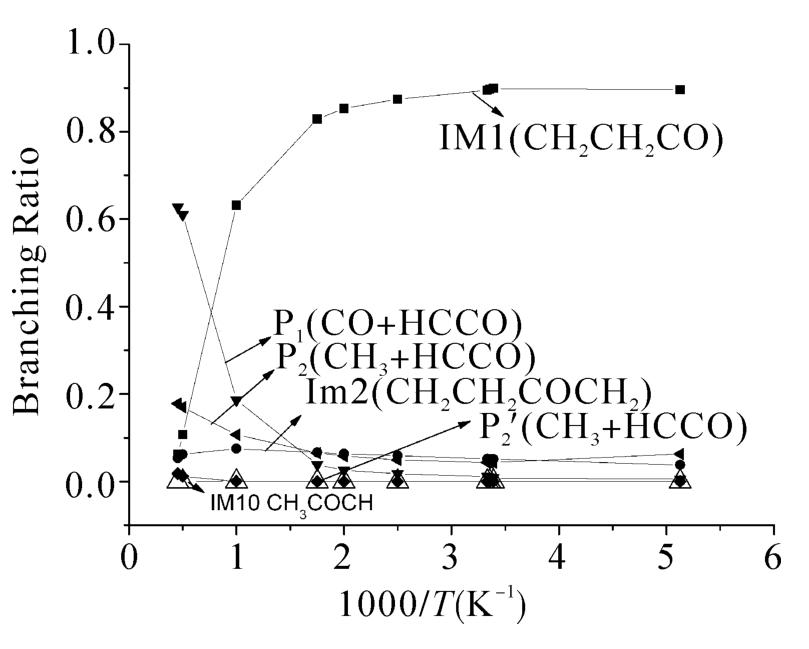
图5.3(b) 各个反应通道在高压下的速率常数占总反应速率常数的百分比
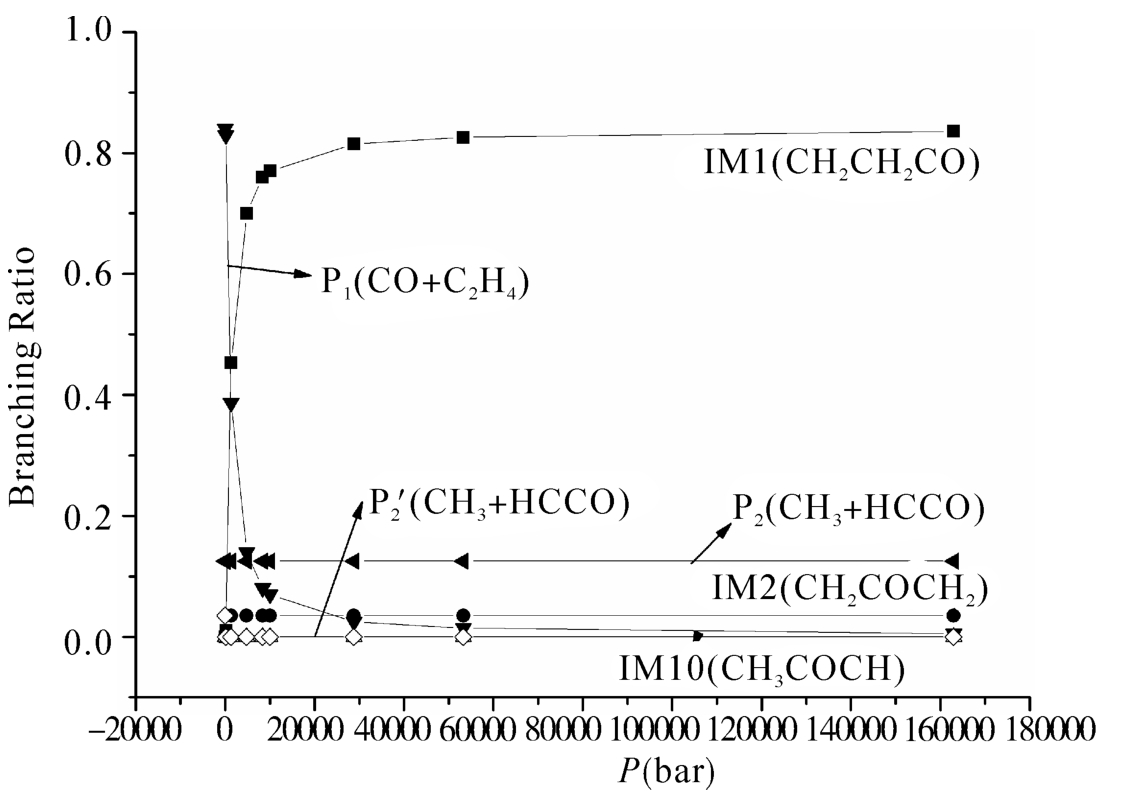
图5.4(a) 在298 K温度下,各个反应通道的速率常数在总反应中所占的分支比随压力的变化
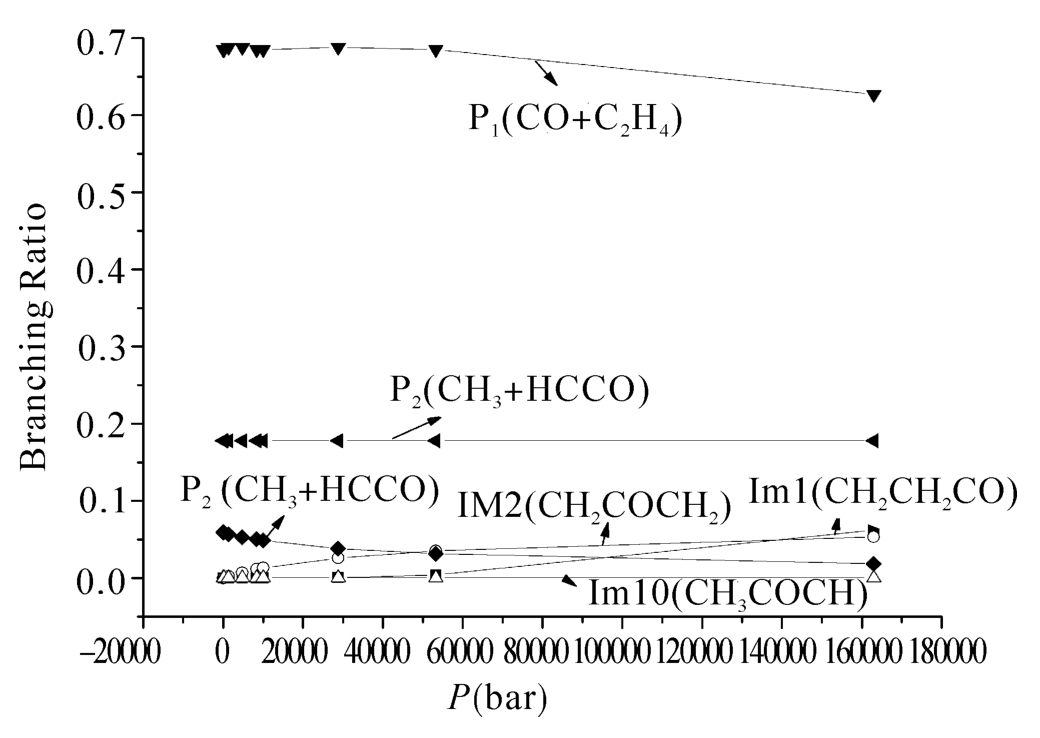
图5.4(b) 在2200 K温度下,各个反应通道的速率常数在总反应中所占的分支比随压力的变化
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















