4.2.2 结果与讨论
对O(1D)与CH3OCF3反应,优化的稳定点的结构以及相应的实验值列在图4.1中。谐振动频率及相应的实验值列在表4.1中。计算的几何结构、频率与实验值符合得很好,最大偏差不超过7%,因此我们的计算基本上是可靠的。图4.2和4.3分别绘出了可行反应通道和不可行反应通道的势能面。为了使讨论更简便,反应物设为零点,符号TSmn表示过渡态所连接的两个异构体m和n。
表4.1 在B3LYP/6-311G(d,p)水平上计算的反应物、产物、中间体和过渡态的频率,括号中的数值为实验值(单位为cm-1)

续表4.1

a实验值引自文献。
b实验值引自文献。
c实验值引自文献。
d实验值引自文献。

图4.1 在B3LYP/6-311G(d,p)水平上优化的反应物、产物、中间体和过渡态的几何结构,其中键长单位为Å,键角单位为°,括号内是相应的实验值(a实验值引自文献47;b实验值引自文献49;c实验值引自文献)

续图4.1

续图4.1
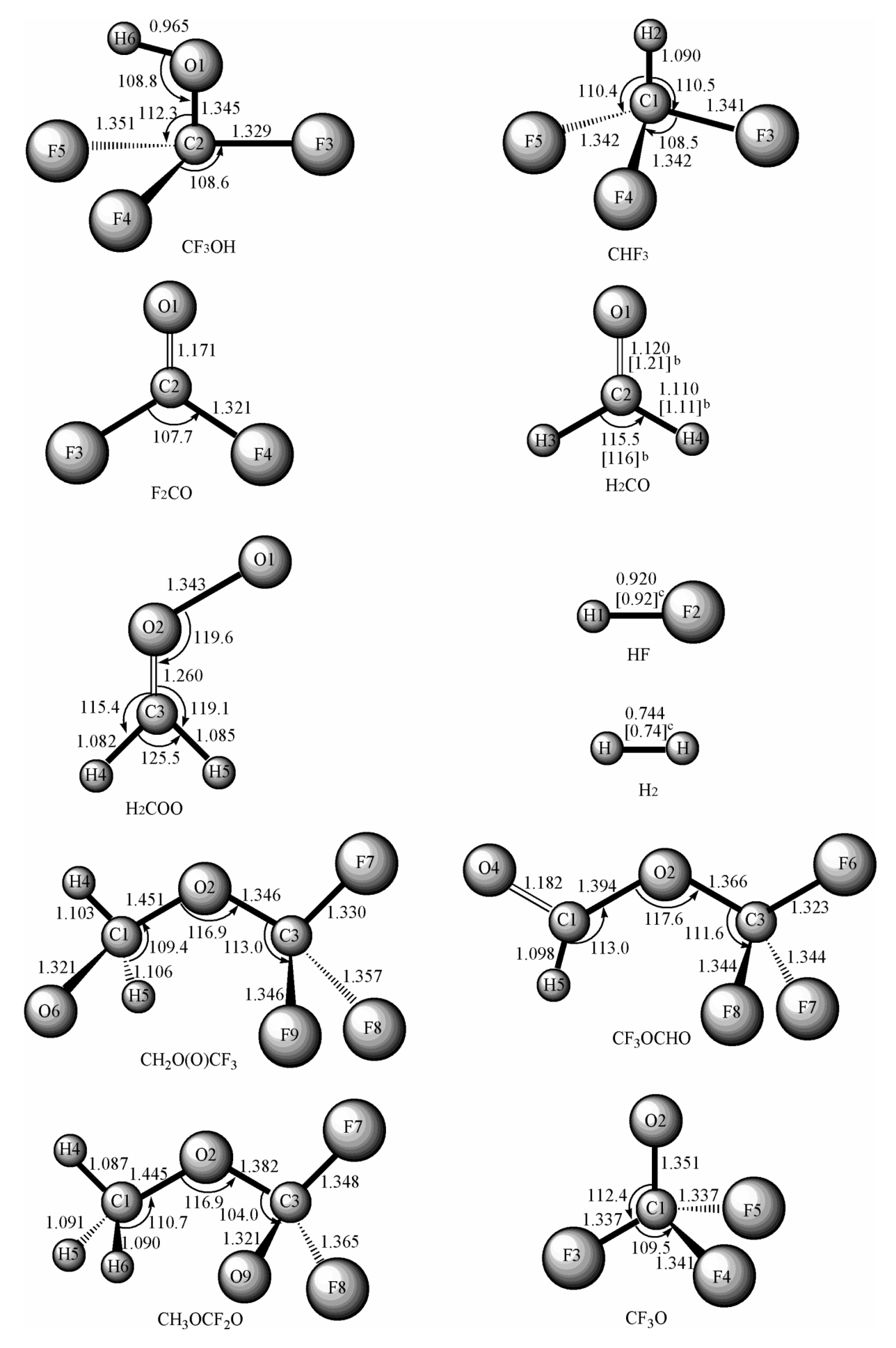
续图4.1

续图4.1

图4.2 在BMC-CCSD//B3LYP/6-311G(d,p)+ZPE水平下计算的O(1D)+CH3OCF3反应可行反应通道的势能面,Erel是相对能(kcal/mol)

图4.3 在BMC-CCSD//B3LYP/6-311G(d,p)+ZPE水平下计算的O(1D)+CH3OCF3反应不可行反应通道的势能面,Erel是相对能(kcal/mol)
4.2.2.1 初始化连接
O(1D)与CH3OCF3分子的初始化主要存在3种可能的插入方式,即O(1D)插入到C-H和C-O键中,以及连接到F原子上。O(1D)插入到C-H键中可以形成中间体CH2(OH)OCF3a(a1,a2)(-151.5 kcal/mol,-152.1 kcal/mol),这是个无能垒的过程,其中a1和a2是a的两个异构体,相应于O-H键分别位于C1-O2-C3面的内外两侧。由于这个过程提供了高能量的富能中间体a,使进一步的异构化和解离能够发生。另外,O(1D)还可以无能垒地插入到C-O键中形成富能中间体b(CH3OOCF3,-87.4 kcal/mol)。第三个入口通道是O(1D)与CH3OCF3的F原子相连形成加成中间体c(CH3OCF3O),这个中间体的能量仅比反应物低4.2 kcal/mol。比较形成的入口中间体的能量,可以看到插入通道比加和通道更可行,而对于两个插入通道,从热力学角度看,a比b具有更好的热力学稳定性。
4.2.2.2 异构化和解离路径
如图4.2所示,从最可能的中间体a出发,有5条解离通道
Path 1:R→a(a1,a2)→P1(CH2(O)OCF3+H)
Path 2:R→a2→h→P2(H2CO+F2CO+HF)
Path 3:R→a1→g→P3(H2CO+CF3OH)
Path 4:R→a2→g→P3(H2CO+CF3OH)
Path 5:R→a2→i→P4(CF3OCHO+H2)
Path 1发生的是O-H键上H原子经直接离去无能垒的生成产物P1(CH2(O)OCF3+H,-45.2 kcal/mol)。Path 2为a经过一个六圆环的过渡态TSa2h发生1,4-HF的消去而形成产物P2(H2CO+F2CO+HF),这个过程需要克服35.9 kcal/mol的反应能垒。过渡态TSa2h中虚频的振动模式相应于C1-O2、C3-F9、O6-H10和F9-H10的伸缩振动。随后,氢键络合物h(-147.2 kcal/mol)直接解离为产物P2(H2CO+F2CO+HF,-136.1 kcal/mol)。Path 3和Path 4代表了a1和a2分别形成氢键络合物g进而分离生成共同的产物P3(H2CO+CF3OH,-141.7 kcal/mol)。这两个过程的过渡态是具有非平面的四圆环结构。然而Path 3中的转换过渡态TSa1g(-103.0 kcal/mol)的能垒要比Path 4中的转换过渡态TSa2g(-53.7 kcal/mol)能垒低49.3 kcal/mol,因此通道Path 3在动力学上更可行。Path 5经过过渡态TSa2i(-65.7 kcal/mol)发生1,2-H2消去反应经过中间体i(-141.7 kcal/mol)直接解离生成产物P4(CF3OCHO+H2)。这个过程需要克服的能垒为86.4 kcal/mol,因此这条反应通道在动力学上较难发生。
值得注意的是,尽管通道Path1~Path5中的所有中间体、过渡态、产物都位于反应物之下,但是由于Path 2和Path 3中包含的过渡态TSa2h(-116.2 kcal/mol)和TSa1g(-103.0 kcal/mol)的能量远低于(约40 kcal/mol)其他3个反应通道,因此,从中间体a开始的解离通道Path 1、Path 4~Path 5与Path 2~Path 3相比不具有竞争性,对总反应的贡献几乎可以忽略。
从插入中间体b开始有两条解离通道。b经过直接的O-O键的断裂无能垒地形成产物P6(CF3O+CH3O,-39.9 kcal/mol)。另外,b也可经过五圆环的过渡态TSbe(3.2 kcal/mol)发生C-O键的断裂协同发生1,4-H迁移形成弱键络合物e(-41.9 kcal/mol),直接生成最终的产物P7(CF3H+H2COO,-37.3 kcal/mol)。在过渡态TSbe中,迁移的H7原子远离C1原子0.174Å,而即将断裂的O3-C4键键长伸长了0.856Å。对应过渡态TSbe的虚频为1093i cm-1,相应于C1-H7、O3-C4和C4-H7键的伸缩振动。这两个过程可以描述为
Path 6:R→b→P6(CF3O+CH3O)
Path 7:R→b→e→P7(CF3H+H2COO)
需要指出的是,从b到e转化是非常困难的,因为这个过程需要克服91.2 kcal/mol的能垒,且过渡态TSbe位于反应物之上,因此,在室温下b→e→P7这个过程是动力学上不可行的。而b→P6这个过程中包含的中间体和过渡态都处于反应物之下,是可行的反应通道。
最后,讨论由加成中间体c开始的异构化及解离路径。如图4.3所示,c经过1,2-O迁移协同发生C-F键的断裂形成中间体d(d1,d2)(CH3OCF2OF,-64.6 kcal/mol,-63.6 kcal/mol)。从异构体d1和d2开始,有三条反应路径:(1)F原子的离去,无能垒地生成产物P5(CH3OCF2O+F,-19.0 kcal/mol);(2)经过三圆环的过渡态TSd1b(-7.8 kcal/mol)发生O原子的迁移,形成中间体b;正如上一部分所述,从中间体b开始,一条路径生成P6,而另一条路径生成P7;(3)经过过渡态TSd2f(-7.3 kcal/mol)协同发生C1-O2和C3-F9键的断裂和F9-H10键的生成,进而形成中间体f(-145.4 kcal/mol),最终直接生成产物P2(H2CO+F2CO+HF)。
这些过程可以描述如下:
Path 8:R→c→d(d1,d2)→P5(CH3OCF2O+F)
Path 9:R→c→d1→b→P6(CF3O+CH3O)
Path 10:R→c→d1→b→e→P7(CF3H+H2COO)
Path 11:R→c→d2→f→P2(H2CO+F2CO+HF)
可以看到,有中间体c开始的解离通道由于其转化过渡态TScd比反应物高13.6 kcal/mol,因此对总反应来说,这个转化过程是不重要的,可以忽略。
4.2.2.3 反应机理
根据前面分析可知,对于O(1D)+CH3OCF3反应,我们可以得到以下在动力学上和热力学上都可行的重要反应通道。为了便于比较,这是重新列出:

O(1D)插入C-H键形成的中间体a1、a2及插入C-O键形成的中间体b具有相当好的热力学稳定性,结合能分别为-151.5 kcal/mol、-152.1 kcal/mol和-87.4 kcal/mol。这样,富能分子可以进一步发生解离反应得到产物碎片,也可以经由第三体碰撞,主要以A∗→A的形式去活化得到稳定的中间体。可以看到a2、a1和b随后解离为产物P2,P3和P6的能垒分别为35.9 kcal/mol、48.5 kcal/mol和47.5 kcal/mol,由此可以预测在高压或低温情况下,中间体a2、a1和b具有很好的热力学和动力学稳定性。对比3个解离成产物碎片的通道,通道(2)是动力学上最可行的,在通道(2)中的能垒比通道(4)和通道(6)中的能垒分别低13.2 kcal/mol和11.6 kcal/mol,由于能垒上相差10 kcal/mol以上,它们的竞争性就会相差很大,因此通道(2)是动力学上最可行的反应通道,产物P2是最主要的产物。但是从热力学角度考虑,生成产物P3所放出的热量比P6多101.8 kcal/mol,因此通道(6)在热力学上的竞争性较通道(4)差。我们预测最主要的产物是P2,次要产物是P3,而P6的产量最低。随着温度的升高,产物P6的产量逐渐增加,可以与产物P3竞争。但这个反应在不同温度和压力下的产物需要进行进一步的动力学计算。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。


















