二、不饱和度法
(一)不饱和度的概念
衡量化合物不饱和程度的指数,就是不饱和度,通常用U表示。所谓不饱和度就是分子中的环加双键数,亦称为缺氢指数、双键等价值,可估计分子结构中是否有双键、三键及环(脂肪环和芳香环)等不饱和情况。
(二)不饱和度公式的数学推导
1.假设分子中有i种价态原子个数分别为n1,n2,n3,…ni。
2.孤立原子的理论成键数分别为n1,2n2,3n3,…ini,实际上分子中原子两两成键,因此,分子中成键数为所有孤立原子的理论成键数的总和的一半,即为(n1+2n2+3n3+…+ini)/2。
3.分子中成键数应包括分子中成σ键数和分子中成σ环或双键数。分子中成σ键数为原子个数减1。分子中成σ环或双键数即为不饱和度U。

公式(5)中U为不饱和度;n1,n3,n4分别为一价,三价,四价原子的数目,不分正负价。(IA,VIIA元素为n1;IIIA,VA元素为n3;IVA元素为n4)
(三)不饱和度的意义
有机分子中每增加一个π键,即减少两个H原子,不饱和度为1。分子中每成一个环,减少两个H原子,不饱和度为1。若不饱和度大于等于4,一般考虑苯环的存在。
不饱和度是极其重要的隐含条件,完全类似于分子量,元素百分含量,密度等物理量。只要给定了化学式或分子式,就能计算出该物质的不饱和度。物质一定,不饱和度存在且固定不变。根据不饱和度与分子结构的关系,从而不饱和度可广泛应用于无机化学、有机化学、仪器分析等学科。
(四)不饱和度的应用
1.由分子的“不饱和度”判断中心原子的杂化类型(具体见附图5)。

讨论:
(1)该方法适用的范围:无机小分子的中心原子只有一个;不讨论d-pπ键和离域π键,只是讨论定域p-pπ键;中心原子的杂化类型为整数。
(2)对于计算离子的不饱和度时,几个负电荷加几个氢,几个正电荷加几个。
(3)若U=x.5时,去掉0.5(单电子作为孤对电子看待参与杂化)。
(4)Be和Hg是IIA和IIB元素,H=2-U(原因是达到二电子稳定的结构);B和Al是IIIA元素,H=3-U(原因有待于进一步探究);稀有气体是VIIIA元素,H=5-U(原因有待于进一步探究);其它元素,一律H=4-U(原因是达到八电子的稳定结构)。
(5)根据m=H-S公式,当m=0时,杂化是等性杂化;当m≠0时,杂化是不等性杂化,有m个孤电子对。
(6)当U=0时,没有p轨道剩余;U=1时,有1个p轨道剩余;U= 2时,有2个p轨道剩余,等等。总之,剩余几个p轨道,就有几个ppπ键。
(7)若H=2,3,4,5,6,7…时,对应的杂化为sp,sp2,sp3,sp3d,sp3d2,sp3d3…。若为等性杂化,其杂化轨道在空间取向分别为直线,三角形,四面体,三角双锥,八面体,五角双锥…,否则由价层电子对互斥理论确定。
2.构造异构体的推写。
例1:写出分子式C5H8的构造异构体。

例2:写出分子式C4H8O的所有合理的开链构造异构体。
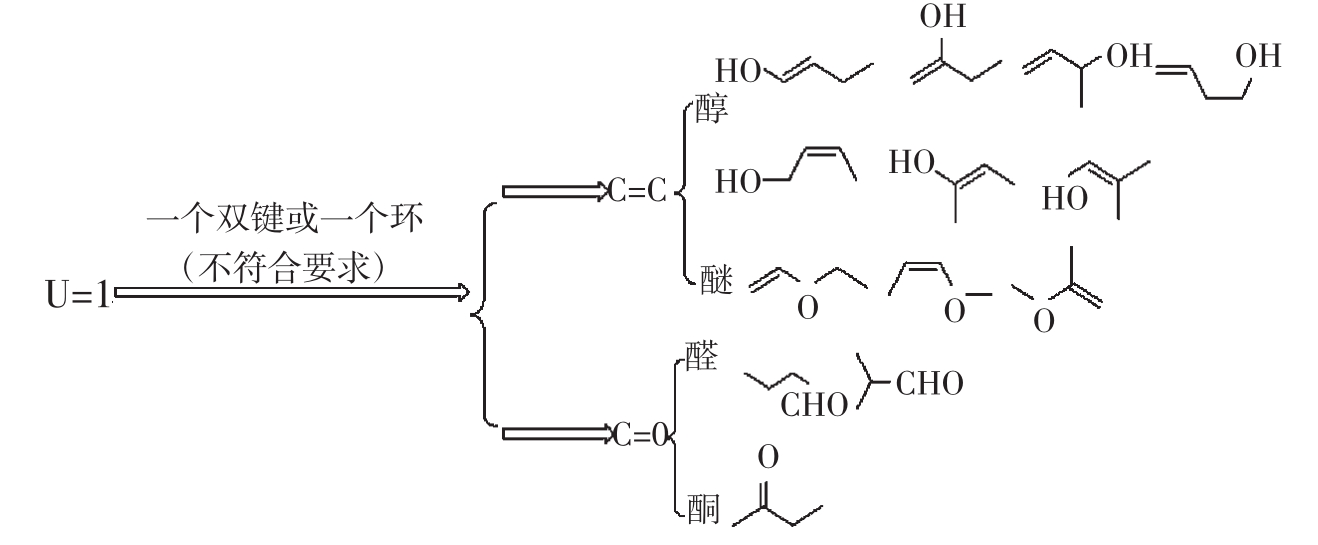
3.桥环烃的环个数的判断。
两个环共用两个或两个以上碳原子的烃叫桥环烃。在命名时,须注明环数,若该化合物由两个环构成,故在前加上“二环”。判断环数的办法有断键法(若断键n次后,变成一个环,那么该化合物的环数为n+1),这个方法对平面结构比较好用,对立体结构就有点费劲。若用不饱和度,勿须看结构的具体情况,只求化学式算它的不饱和度,不饱和度等于几,环数就是几。(注:若环里有不饱和键,应减去不饱和键数才是环数)

4.有机化合物推断题。
例1:A、B、C、D、E、F、G、H、I、J均为有机化合物。根据以下框图,回答问题:
(1)B和C均为有支链的有机化合物,B的结构简式为;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为_______
;
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为_______;
(3)⑤的化学方程式是_______;⑨的化学方程式是_______;
(4)①的反应类型是_______,④的反应类型是,⑦的反应类型是_______;
(5)与H具有相同官能团的H的同分异构体的结构简式为_______
。

1.计算不饱和度

2.规律推理。
①跟碱氢氧化钠反应的情况:酸、酚、卤代烃、酯。
②跟浓硫酸反应的情况:醇、生成酯、水解酯。
③跟氢氧化铜反应的情况:醛。
④跟卤素光照反应的情况:双键的邻位碳原子。
3.从不饱和度为零开始推理。

4.H的同分异结构体推理。

根据上图回答问题:
(1)D的化学名称是_______。
(2)反应③的化学方程式是_______。(用结构简式表示)
(3)B的分子式是_______。A的结构简式是_______。反应①的反应类型是_______。
(4)符合下列3个条件的B的同分异构体的数目有_______个。
i)含有邻二取代苯环结构;ii)与B有相同官能团;iii)不与FeCl3溶液发生显色反应。写出其中任意一个同分异构体的结构简式_______。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途_______。

例3:化合物C8H17Br(A)在乙醇中用乙醇钠处理,生成烯烃C8H16(B),B用臭氧处理后水解生成C。当催化剂氢化时C吸收1molH2生成醇D(C4H10O),用浓硫酸处理D生成两种烯烃异构体E、F,其分子式为C4H8。写出从A到F的构造式。
分析:C8H17Br(A)U=1+8-18/2=0,说明化合物A是直链氯代烃。
烯烃C8H16(B)U=1+8-16/2=1,说明化合物B是直链烯烃。B臭氧化的产物只有一种,说明B的结构是对称的。
醇C4H10O(D)U=1+4-10/2=0,说明化合物D是直链醇。
烯烃C4H8(E、F)U=1+4-8/2=1,说明化合物E、F是直链烯烃。

例4:化合物C6H12O(A),能与羟胺作用,但与饱和亚硫酸氢钠不作用。将A催化加氢,得化合物B(C6H14O),B去水的化合物C(C6H12),C经臭氧化及还原水解得到两个化合物D和E。D能发生碘仿反应,但不与托伦试剂反应,E不与碘仿反应,但能与托伦试剂反应。试推断所有化合物的结构。
解:C6H12O(A)U=1+6-12/2=1,说明有双键(C=C,C=O)或环;能与羟胺作用,但不与饱和亚硫酸氢钠反应,说明化合物A里有羰基,并且是酮羰基(除去甲基酮)。
C6H14O(B)U=1+6-14/2=0,说明化合物B是饱和醇。
C6H12(C)U=1+6-12/2=1,说明化合物C里含有双键或环;但能发生臭氧化反应,进一步说明化合物C是单烯烃。臭氧化的产物,化合物D能发生碘仿反应,不与托伦试剂反应,说明D是甲基酮。化合物E不能发生碘仿反应,能与托伦试剂反应,说明是醛,而不是甲基醛。

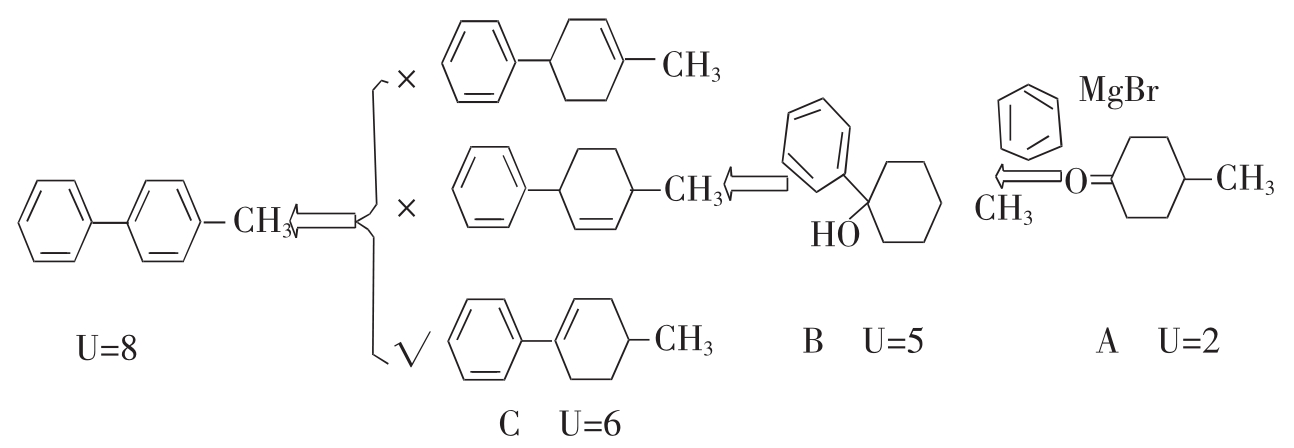
例5:某化合物分子式为C7H12O(A),与2,4-二硝基苯肼作用生成黄色沉淀;与苯基溴化镁反应,然后水解得到分子式为C13H18O(B),脱水得分子式为C13H16(C),C经催化脱氢生成4-甲基联苯。试推断所有化合物的构造式。
分析:C7H12O(A)U=1+7-12/2=2,说明有两个双键(C=C,C=O)或两个环或一个双键和一个环;能与2,4-二硝基苯肼作用生成黄色沉淀,也能与苯基溴化镁反应,说明一定有一个羰基;最后的产物是4-甲基联苯,进一步说明有一个六元环不可能是双键。
C13H18O(B)U=1+13-18/2=5,说明化合物B里肯定有苯环和一个六元环。
C13H16(C)U=1+13-16/2=6,说明化合物C里肯定有苯环和含有一个双键的六元环。
化合物4-甲基联苯里有两个苯环(U=1+13-12/2=8)。
(5)IR部分(具体见附图13)

例6:一挥发性的无色液体,经元素分析结果碳占91.4%,氢占8.7%,它的IR数据如下:3030,2960,2870,1600~1450(3个峰),1375,765,700 cm-1,确定化合物的结构。
设分子式CxHy,那么

分析:C7H8的不饱和度U=1+7-8/2=4,红外数据3030,1600~1450cm-1(3个峰)两者充分说明有一个苯环。由于一个苯环用去了六个碳原子,只剩下一个碳原子因而只能是甲基。红外数据2960,2870,1375 cm-1说明有甲基。765,700cm-1说明苯环是单取代。以上数据表明该化合物为甲苯。
例7:推测化合物的结构,C9H12O,IR:3350,3070,1600,1490,830cm-1;1HNMR:σ0.9(3H)t,1.5(2H)多,2.4(2H)t,5.5(1H)s,6.8(4H),q。

分析:C9H12O的不饱和度U=1+9-12/2=4,红外数据3070,1600, 1490cm-1,两者充分说明有一个苯环。6.8(4H)说明有苯环,且是二取代的苯环。830cm-1说明苯环是对取代。由于一个苯环用去了六个碳原子,只剩下三个碳原子。0.9(3H)T,1.5(2H)多,2.4(2H)t说明该结构中有一个甲基,两个不同的CH2。红外数据3350cm-1,5.5(1H)说明有羟基。
6)1HNMR部分(具体见附图13)
例8:化合物A的化学式是C4H9Br,但1HNMR数据结果如下:其中有1.5(3H)d,1.0(3H)t,还有两组多重峰,试推测化合物A。

分析:化合物A(C4H9Br)的不饱和度U=1+4-10/2=0,说明是饱和直链溴代烃。1.5(3H)d说明CH3直接连的是CH。1.0(3H)t说明CH3直接连的是CH2。这样CH和CH2相连,CH连溴原子。
例9:化合物A、B(C9H10O),根据以下数据,推断化合物A和B的结构式。(1)化合物A:碘仿试验呈阳性,IR谱中1705cm-1处有一强吸收峰;在1HNMRδ2.0(3H)s,3.5(2H)s,7.1(5H)多重峰;(2)化合物B:碘仿试验呈阴性,IR谱中1690cm-1处有一强吸收峰;在1HNMRδ1.2(3H)t,3.0(2H)q,7.7(5H)多重峰。

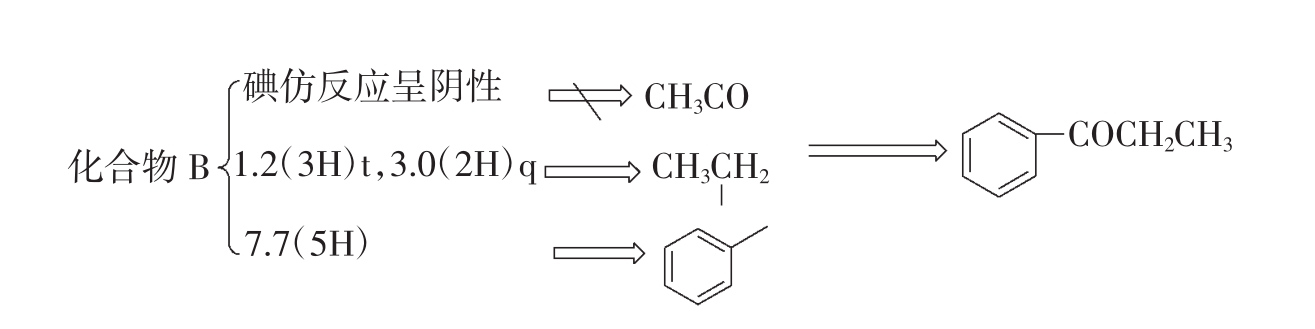
分析:化合物A和B(C9H10O)的不饱和度U=1+9-10/2=5,说明有一苯环和环或双键。1705cm-1,1690cm-1说明有羰基存在。化合物A而言:碘仿试验呈阳性说明结构里具有甲基酮;7.1(5H)多重峰说明苯环为单取代;2.0(3H)s,3.5(2H)s说明结构里具有一个甲基和一个亚甲基但不相连。化合物B而言:碘仿试验呈阴性说明结构里不具有甲基酮;7.7(5H)多重峰说明苯环为单取代;1.2(3H)t,3.0(2H)q说明结构里具有一个甲基和一个亚甲基相连。

7)MS部分
由氮律可知,有机化合物分子若含有偶数个氮原子(包括不含氮原子),则分子的相对分子量为偶数;否则为奇数。在质谱图上得到的是离子峰,不是奇电子离子,就是偶电子离子,这时离子的质荷比奇偶性如何判断。(EE+表示偶电子离子;OE+·表示奇电子离子。)由于质荷比奇偶性和离子类型(EE+或OE+·)存在密切的关系(见图表)。规律为若氮的个数和离子的奇偶性一样,质荷比奇偶性为奇数;若氮的个数和离子的奇偶性不一样,质荷比奇偶性为偶数。
表1

若要判断质荷比的奇偶性,首先得判断离子类型(EE+或OE+o),那可用不饱和度进行判断。若不饱和度为整数,离子则为OE+o;若不饱和度为小数,离子则为EE+。
表2

8)UV部分(具体见附图13)

例10:A,B,C三个化合物分子式都是C5H6,氢化时都吸收三分子H2,生成正戊烷。A不能和银氨溶液反应,但B和C能与银氨溶液反应生成沉淀。A和B的紫外光谱在230nm处有吸收,而C在> 200nm无吸收,试写出A,B,C的结构式。分析:C5H6的不饱和度U= 1+5-6/2=3,说明有环或双键或三键。氢化时都吸收三分子H2,生成正戊烷,说明具有不饱和键的直链。B和C能与银氨溶液反应生成沉淀,说明B和C有端基三键。A不能和银氨溶液反应,说明A有双键或三键在中间。A和B的紫外光谱在230 nm处有吸收,说明结构有共轭的大 。而C在>200 nm无吸收,说明结构无共轭的大
。而C在>200 nm无吸收,说明结构无共轭的大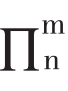 。
。

共价分子ABaHb中的所有价电子(V),完全要用来满足b个配位原子H的二电子结构和a个配位原子B的八隅体结构,剩余的价电子应以孤对电子(2m)的形式存在。若分子中的价电子总数是奇数,则把这个单电子也看作孤电子对。可用数学式表达如下:
1)当V=8a+2b+2m,若V能被8整除时,即V/8=a圯H=a(除当V/ 8=1时,H=4)
2)当V=8a+2b+2m,若V不能被8整除时,即V/8=a…2(b+m)圯H=a+b+m;
3)当V=8a+2b+2m-1圯(V+1)/8=a…2(b+m)H=a+b+m;
4)当余数等于2时,H=a+1;当余数等于4时,H=a+2;当余数等于6时,H=a+3。
V和H的关系用数轴图形表示如下:?

用“数轴法”判断中心原子的杂化类型的应用:


由“数轴法”判断中心原子的杂化类型的规律。
1)该方法适用的范围:无机小分子的中心原子只有一个;不讨论d-pπ键和离域π键,只是讨论定域p-pπ键;中心原子的杂化类型为整数。
2)价电子总数相等或奇数加1后相等时,杂化方式一样。
3)价电子总数每增加(或减小)6个电子(△V)后,与原来相比较,杂化方式不变。换句话说,原分子中增加或减少氧族元素时,杂化方式不变。
△V=6m(m=0,1,2…)
如NO=NO2,N2=N2O,CN-=OCN-,NO2=NO3-,H2O=H2O2,XeO3= XeO4,SO2=SO3=O3,H3PO3=H3PO4,CO=CO2=CS2,ClO-=ClO2-=ClO3-= ClO4-,SO32-=SO42-,XeF4=XeOF4等等。
4)价电子总数每增加(或减小)2个电子(△V)后,与原来相比较,杂化方式每增加(或减小)1。
△V=±2n(n=1,2),当n=1时,H±1,当n=2时,H±2。
如NO—N2,CO32-—SO32-,CO2—SO2,C2H2—C2H4—C2H6等等。
5)价电子总数若增加(或减小)的不是6或2个电子(△V)时,可把增加(或减小)的电子数分解为6的倍数和2的倍数。
△V=6m±2n(m=0,1,2…;n=1或n=2)当n=1时,H±1,当n=2时,H±2。
如XeF2—XeF4—XeF6,XeF3+—XeF5+等等。(说明:符号“=”表示物质间杂化数相同;符号“—”表示物质间杂化数相差1)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















