实验51 硫酸亚铁铵的制备及纯度检验
实验目的
了解复盐的一般特征和制备方法;练习常压过滤和减压过滤、蒸发、结晶等基本操作;学习用目视比色法检验产品质量。
实验原理
硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O又称莫尔氏盐,为浅蓝绿色单斜晶体。它在空气中比一般亚铁盐稳定,不易被氧化,而且价格低,制备工艺简单,容易得到较纯净的晶体,因此,其应用非常广泛,在化学上常用作还原剂,工业上常用作废水处理的混凝剂,在农业上既是农药又是肥料,在定量分析中常用作氧化还原滴定的基准物质。
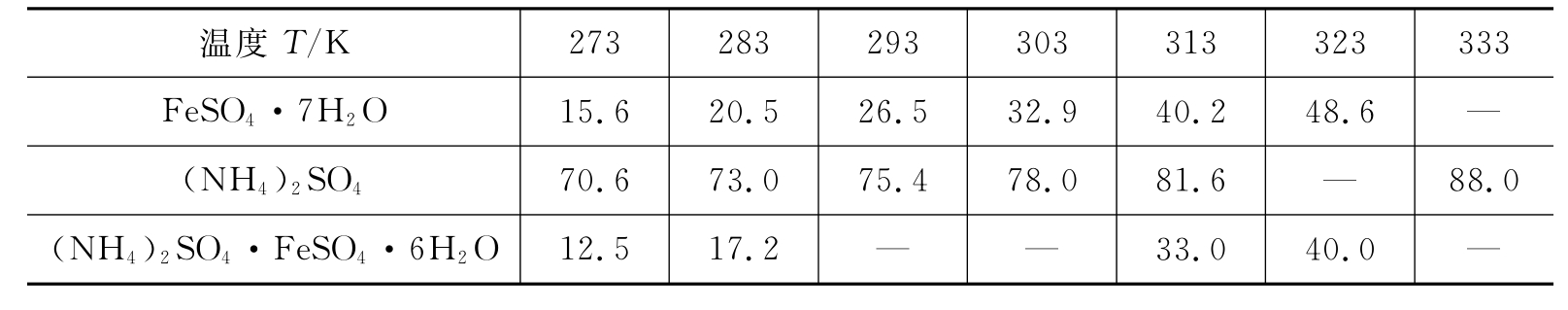
像所有的复盐一样,硫酸亚铁铵在水中的溶解度比组成它的任何一个组分FeSO4或(NH4)2SO4的溶解度都要小,因此从FeSO4和(NH4)2SO4溶于水所制得的浓混合溶液中,很容易得到结晶的莫尔氏盐。三种盐在水中的溶解度见表5-1。
表5-1 三种盐在水中的溶解度[g·(100g H2O)-1]
本实验采用过量铁与稀硫酸作用生成硫酸亚铁:
![]()
在硫酸亚铁溶液中加入硫酸铵并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶解度较小的硫酸亚铁铵盐晶体:
![]()
为防止Fe2+的水解,在制备(NH4)2SO4·FeSO4·6H2O过程中,溶液应保持足够的酸度。
硫酸亚铁和硫酸亚铁铵含量测定采用高锰酸钾滴定法。在酸性介质中,Fe2+可被KMnO4定量氧化为Fe3+,KMnO4本身的紫红色可作为滴定终点的判断。
![]()
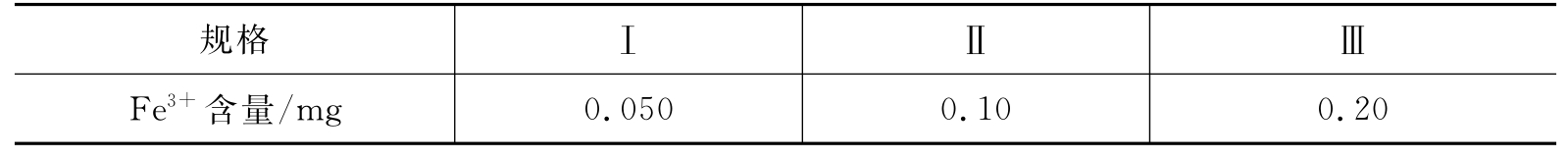
用目视比色法可估计产品中所含杂质Fe3+的量。Fe3+与SCN-能生成红色[Fe(SCN)]2+,红色深浅与Fe3+含量有关。将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定量Fe3+所配制成的标准[Fe(SCN)]2+溶液的红色进行比较,确定待测溶液中杂质Fe3+的含量范围,确定产品等级。不同等级标准溶液中Fe3+含量见表5-2。
表5-2 不同等级标准溶液中Fe3+含量
实验用品
仪器 台秤;电炉;表面皿;布氏漏斗;容量瓶;比色管;烧杯;锥形瓶;pH试纸等。
试剂 H2SO4(3mol·L-1,浓);KMnO4标准溶液(约0.10mol·L-1);Na2CO3(10%);HCl(3mol·L-1);H3PO4(85%);KSCN(25%);NH4Fe(SO4)2· 12H2O(s);(NH4)2SO4(s);铁屑;乙醇(95%)等。
实验步骤
1.铁屑的净化(除去油污)
用台秤称取2.0g铁屑,放入小烧杯中,加入15mL 10%Na2CO3溶液。缓缓加热约10min后,倾去Na2CO3碱性溶液,用自来水冲洗后,再用去离子水把铁屑冲洗干净(如果用纯净的铁屑,可省去这一步)。
2.硫酸亚铁的制备
往盛有2.0g洁净铁屑的小烧杯中,加入15mL 3mol·L-1 H2SO4溶液,盖上表面皿,放在低温(70~80℃)电炉上加热反应。在加热过程中应不时加入少量去离子水,以补充被蒸发的水分,防止FeSO4结晶出来;同时要控制溶液的pH值不大于1(为什么?如何测量和控制?),使铁屑与稀硫酸反应至不再冒出气泡为止(约25min)。趁热过滤,滤液承接于洁净的蒸发皿中。将留在小烧杯中及滤纸上的残渣取出,用滤纸片吸干后称量。根据已作用的铁屑质量,计算出溶液中FeSO4的理论产量。
3.硫酸亚铁铵的制备
根据FeSO4的理论产量,计算并称取所需固体(NH4)2SO4的用量。在室温下将称出的(NH4)2SO4加入上面所制得的FeSO4溶液中,在水浴上加热搅拌,使硫酸铵全部溶解,调节pH值为1~2,继续蒸发浓缩至溶液表面刚出现薄层的结晶时为止。自水浴锅上取出蒸发皿,放置,冷却后即有硫酸亚铁铵晶体析出。待冷至室温后用布氏漏斗减压过滤,用少量乙醇洗去晶体表面所附着的水分。将晶体取出,置于两张洁净的滤纸之间,并轻压以吸干母液,称量。计算理论产量和产率。
4.产品检验[Fe(Ⅲ)的含量分析]
1)Fe(Ⅲ)标准溶液的配制
称取0.8634g NH4Fe(SO4)2·12H2O,溶于少量水中,加2.5mL浓H2SO4,移入1000mL容量瓶中,用水稀释至刻度。此溶液含0.1000g·L-1 Fe3+。
2)标准色阶的配制
取0.50mL Fe(Ⅲ)标准溶液于25mL比色管中,加2mL 3mol·L-1 HCl溶液和1mL 25%KSCN溶液,用蒸馏水稀释至刻度,摇匀,配制成Fe标准溶液(含Fe3+0.05mg·g-1)。
同样,分别取1.00mL Fe(Ⅲ)和2.00mL Fe(Ⅲ)标准溶液,配制成Fe标准溶液(分别含Fe3+0.10mg·g-1、0.20mg·g-1)。
3)产品级别的确定
称取1.0g产品于25mL比色管中,用15mL去离子水溶解,再加入2mL 3mol·L-1 HCl溶液和1mL 25%KSCN溶液,加水稀释至25mL,摇匀。与标准色阶进行目视比色,确定产品级别。
此产品分析方法是将成品配制成溶液,与各标准溶液进行比色,以确定杂质的含量范围。如果成品溶液的颜色不深于标准溶液,则认为杂质含量低于某一规定限度,所以这种分析方法称为限量分析。
5.(NH4)2SO4·FeSO4·6H2O含量的测定
0.02mol·L-1 KMnO4标准溶液的配制与标定参见实验24。
称取0.8~0.9g(准确至0.0001g)产品于250mL锥形瓶中,加入50mL不含氧的去离子水(怎么处理?),加入15mL 3mol·L-1 H2SO4溶液和2mL 85% H3PO4溶液,使试样溶解。滴加3~5滴硫酸锰溶液,用KMnO4标准溶液滴定至溶液刚刚出现微红色(30s内不消失)即为终点。(NH4)2SO4·FeSO4·6H2O含量计算公式如下:
![]()
注意事项
(1)若所用铁屑不纯,与酸反应时可能产生有毒的氢化物,最好在通风橱中进行。不必将所有铁屑溶解完,实验时溶解大部分铁屑即可。
(2)制备硫酸亚铁铵时,用3mol·L-1 H2SO4溶液调节pH值为1~2,以保持溶液的酸度,反应过程中,应适当补加少量去离子水,以防硫酸亚铁结晶析出,但要注意加水量。
(3)注意计算(NH4)2SO4的用量。
(4)硫酸亚铁铵的制备:加入硫酸铵后,应搅拌使其溶解后再进行后面的操作。在水浴上加热时,要防止失去其失去结晶水。
(5)蒸发浓缩初期要不停搅拌,但要注意观察晶膜,一旦发现晶膜出现即停止搅拌。
(6)趁热过滤并以少量热水洗涤。最后一次抽滤时,注意将滤饼压实,不能用蒸馏水或母液洗涤晶体。
思考题
(1)为什么制备硫酸亚铁铵时要保持溶液有较强的酸性?
(2)减压过滤的操作步骤有哪些?
(3)如何计算FeSO4的理论产量和反应所需(NH4)2SO4的质量?
(4)在检验产品中Fe3+含量时,为什么要用不含氧的去离子水?如何制备不含氧的去离子水?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















