6.2.1H2SO4质量分数对H2SO4沉钙过程的影响
试验条件及操作方法:常温下,将100 mL HNO3浸出液加入烧杯中,在搅拌速度为250 r/min下,将浓度为20%的H2SO4一次性地加入到HNO3浸出液中,反应时间为30 min;然后用100 mL水洗涤CaSO4,在(250±5)℃下烘干。
H2SO4沉钙后所得的HNO3浸出液(滤液)的体积、洗液的体积以及CaSO4洗涤干燥后的总质量见表6-1。
表6-1 H2SO4质量分数对沉钙工艺的影响

由表6-1可以看出,随着H2SO4质量分数的增加,所得到的CaSO4产品的质量也随之增加。当H2SO4质量分数由5%增加到20%时,CaSO4产品的质量由3.66 g增加到9.27 g;之后随着H2 SO4质量分数由20%继续增加到30%时,CaSO4产品的质量仅增加了0.44 g;当H2SO4质量分数增至50%时,CaSO4产品的质量仅增加至10.14 g。试验研究表明,当H2SO4质量分数大于20%时,增加H2SO4的质量分数,析出的CaSO4产品的质量增加已相对较少。由表6-1还可看出,在加入的初始反应液的量相同的条件下,随着加入的H2SO4质量分数的增加,所得到的沉钙后滤液体积逐渐减少,由H2SO4质量分数为5%时的148 mL减少到H2 SO4质量分数为40%时的122 mL,这主要是CaSO4以二水物的形式沉淀析出时,带走一部分水所致。
图6-1为H2SO4质量分数对CaSO4产品收率及含量的影响试验研究结果。

图6-1 H2SO4质量分数对CaSO4产品收率及含量的影响
由图6-1可以看出,随着H2SO4质量分数的增加,CaSO4产品的收率随之增大,当H2SO4质量分数由5%增加到10%和20%时,CaSO4产品的收率由39%增加到76.68%和91.02%,之后随着H2SO4质量分数由20%继续增加到50%时,CaSO4产品的收率变化较小,仅增加4%左右;而CaSO4产品中CaSO4的含量呈先增加后减小的趋势变化,当H2SO4质量分数由5%增大到10%和20%时,CaSO4产品的含量由95.73%增加到96.64%和98.48%,继续增加H2SO4质量分数至40%时,CaSO4产品的含量仅增加到98.95%,达到最大值,进一步增加H2SO4质量分数,CaSO4产品的含量反而降低到96.25%。
由表6-1和图6-1进一步表明,当H2SO4质量分数由10%增加到20%时,CaSO4产品的收率增长了14.34%,含量增加了1.84%,收率和含量增幅都达到最大。而H2SO4质量分数从20%增加到30%时,CaSO4产品的收率仅仅增长了2.93%,其含量增幅也非常有限;同时随着H2SO4的质量分数增加,CaSO4沉淀时的pH值相应地减小,所得到的CaSO4产品黏度增大,不仅给后续操作(洗涤、烘干)带来难度,而且对CaSO4产品的含量也有影响,其含量由98.95%降到了96.25%就证明了这一点。
综合考虑以上研究结果,本试验选择H2SO4质量分数20%作为最佳制备工艺条件。
表6-2为不同H2SO4质量分数下沉淀HNO3浸出液中的钙时,钙、镁等元素进入不同物相中的分布研究结果。
表6-2 H2SO4质量分数对沉钙过程中杂质分布的影响

续表6-2

由表6-2中数据可以看出,采用H2SO4沉淀HNO3浸出液中的钙,经固液分离、洗涤后,固相中的CaO占HNO3浸出液带入CaO总量的34.34%~96.34%,且随着H2SO4质量分数的增加,进入固相的CaO的比例增加,进入滤液中的CaO占HNO3浸出液带入CaO总量的1.27%~55.70%,进入洗涤液中的CaO占HNO3浸出液带入CaO总量的2.48%~5.28%;残留在固相中的MgO占HNO3浸出液带入MgO总量的19.27%~27.83%,进入滤液中的MgO占HNO3浸出液带入MgO总量的58%~70%,进入洗涤液中的MgO占HNO3浸出液带入MgO总量的7%~14%;残留在固相中的Al2O3占HNO3浸出液带入Al2O3总量的0.73%~6.23%,且随着H2SO4质量分数的增大而增大,滤液中的Al2O3占HNO3浸出液带入Al2O3总量的82%~90%,进入洗涤液中的Al2O3占HNO3浸出液带入Al2O3总量的10%左右;铁在固相中的分布占HNO3浸出液带入Fe总量的6%~15%,且随着H2SO4质量分数的增加而增加,留在滤液中的Fe占HNO3浸出液带入Fe总量的70%~89%,进入洗涤液中的Fe占HNO3浸出液带入Fe总量的3%~13%;氟在固相中的分布占HNO3浸出液带入F总量的0.43%~1.11%,且随着H2SO4质量分数的增加而增加,但是由于残留量比较小,因此基本可忽略,留在滤液中的F占HNO3浸出液带入F总量的87%~94%,进入洗涤液中的F占HNO3浸出液带入F总量的5%~8%。
综上所述,随着H2SO4质量分数的增加,对沉淀浸出液中的CaO是有利的,对固相中MgO、Al2O3、Fe、F等杂质的除去是不利的。因为H2SO4质量分数越大,固体物质的酸度越大,黏度就越大,固相中残留的杂质也会相应地增多;MgO的88%以上、Al2O3的94%左右、Fe的82%~93%和F的90%左右均进入了液相中,这些元素在洗涤液中的含量是不可忽略的,所以不能仅仅从CaSO4产品的收率方面考虑硫酸质量分数的取舍问题,还要考虑CaSO4产品的纯度。而水洗效果直接影响硫CaSO4产品的含量,因而水洗涤固体滤渣是必要的。
6.2.2H2SO4与HNO3浸出液体积比对H2SO4沉钙过程的影响
试验条件及操作方法:常温下,将100 mL HNO3浸出液加入到烧杯中,再一次性加入20%H2SO4于HNO3浸出液中,搅拌速度为250 r/min,反应时间为30 min,水洗CaSO4,在(250±5)℃下烘干。
在不同的H2SO4与HNO3浸出液体积比下,H2SO4沉钙后所得HNO3浸出液(滤液)的体积、洗液的体积、CaSO4洗涤干燥后的总质量见表6-3。
表6-3 H2SO4与HNO3浸出液体积比对沉钙工艺的影响

续表6-3

从表6-3可以看出,CaSO4产品的质量随着H2SO4与HNO3浸出液体积比的增加而增大。当体积比由0.2增加到0.5时,CaSO4产品的质量由6.62 g增加到8.98 g,之后随着体积比由0.5到0.6,CaSO4产品的质量由8.98 g增加到9.10 g,初始反应液体积相差10 mL,质量相差0.12 g;当体积比由0.6增加到0.8时,CaSO4产品的质量由9.10 g增加到9.27 g,两者初始反应液体积相差20 mL,质量相差0.17 g。
图6-2为H2SO4与HNO3浸出液体积比对CaSO4产品收率及含量的影响试验研究结果。

图6-2 H2SO4与HNO3浸出液体积比对CaSO4产品收率及含量的影响
由图6-2可以看出,随着H2SO4与HNO3浸出液体积比的不断增大,CaSO4产品的收率随之增大;当H2SO4与HNO3浸出液体积比由0.2增加到0.5和0.6时,CaSO4产品的收率由74.14%增加到92.05%和93.26%,之后随着H2SO4与HNO3浸出液体积比由0.6增大到0.8时,CaSO4产品的收率仅变化了0.7%,变化较小,而CaSO4产品的含量却是先增大后减小;当H2SO4与HNO3浸出液体积比由0.2增加到0.5和0.6时,CaSO4产品的含量由96.56%增加到99.81%和99.86%,继续增加H2SO4与HNO3浸出液体积比,CaSO4产品的含量反而降低至98.27%。
综合表6-3和图6-2的信息进一步表明,当H2SO4与HNO3浸出液体积比由0.4增加到0.6时,CaSO4产品的收率增长了3.07%,含量增长了3.3%,收率和含量的增幅都达到最大。继续增加H2SO4与HNO3浸出液体积比时,收率在继续增加,但是CaSO4产品的含量在减小,反应液的pH值在减小。这不仅需要提高反应釜的抗腐蚀性能,而且增加了不必要的原料成本投入,同H2SO4与HNO3浸出液体积比为0.6时相比,其经济效益明显不及前者。所以,本试验选择H2SO4与HNO3浸出液体积比为0.6作为最佳工艺条件。
表6-4为在不同的H2SO4(20%)与HNO3浸出液体积比下沉淀HNO3浸出液中的钙时,钙、镁等元素进入不同物相中的分布研究结果。
表6-4 H2SO4(20%)与HNO3浸出液体积比对沉钙过程中杂质分布的影响

由表6-4中的数据可以看出,采用H2SO4沉淀HNO3浸出液中的钙,经固液分离、洗涤后,固相中的CaO含量随着体积比的增加而增大,滤液中的CaO含量随之减小。固相中CaO占HNO3浸出液带入CaO总量的65%~95%,进入滤液中的CaO占HNO3浸出液带入CaO总量的3%~20%,进入洗涤液中的CaO占HNO3浸出液带入CaO总量的2%~5%;残留在固相中的MgO约占HNO3浸出液带入MgO总量的22%,进入滤液中的MgO占HNO3浸出液带入MgO总量的59.83%~71.03%,进入洗涤液中的MgO占HNO3浸出液带入MgO总量的7%~18%;残留在固相中的Al2O3占HNO3浸出液带入Al2O3总量的4.57%~6.68%,进入滤液中的Al2O3占HNO3浸出液带入Al2O3总量的81%~90%,进入洗涤液中的Al2O3占HNO3浸出液带入Al2O3总量的3%~7%;铁在固相中的分布占HNO3浸出液带入Fe总量的5%~11%,进入滤液中的Fe占HNO3浸出液带入Fe总量的77%~84%,进入洗涤液中的Fe占HNO3浸出液带入Fe总量的5%~11%;氟在固相中的分布占HNO3浸出液带入F总量的1%左右,进入滤液中的F占HNO3浸出液带入F总量的81%~86%,进入洗涤液中的F占HNO3浸出液带入F总量的15%左右。
综上所述,增加H2SO4与HNO3浸出液体积比,有利于沉淀HNO3浸出液中的钙。过滤洗涤后,当H2SO4与HNO3浸出液体积比≥0.4时,有90%以上的CaO进入固相,虽然在固相中MgO、Fe、Al2O3、F含量占CaSO4总量的比例是很微小的,但是其在固相中的残留量则是不可忽略的。MgO的73%以上、Al2O3的94%左右、Fe的88%~94%和F的95%以上进入到液相中,并且洗涤液中这些物质所占的比例是不可忽略的,所以从研究结果来看,对固相的水洗量是不够的。另外,酸度对CaSO4产品的纯度有一定的影响。
6.2.3温度对H2SO4沉钙过程的影响
试验条件及操作方法:20%H2SO4,H2SO4与HNO3浸出液体积比为0.6∶1;H2SO4一次性加入硝酸浸出液中,搅拌速度控制在250 r/min,反应时间为30 min,过滤水洗后在(250±5)℃下烘干。
不同的温度下,H2SO4沉钙后所得HNO3浸出液的体积、洗液的体积、CaSO4洗涤干燥后的总质量见表6-5。
表6-5 反应温度对沉钙工艺的影响

从表6-5中可以看出,随着反应温度的升高,所得到的CaSO4产品的质量呈先增大后减小的波动趋势。当反应温度由10℃升至20℃(即为室温)时,所得CaSO4产品的质量由9.19 g增加至9.42 g,即达到最大值。随着反应温度的继续升高,CaSO4产品的质量有所下降,均在9.25 g左右波动,当反应温度升至90℃时,产品的质量升至9.41 g,与最大值仅相差0.01 g。试验研究表明,当反应温度大于20℃时,反而不利于CaSO4产品的析出。从表6-5中还可以看出,在加入初始反应液量相同的条件下,沉钙后滤液的体积随着反应温度的升高而降低,由反应温度为20℃时的139 mL减少到反应温度为90℃的115 mL。其原因首先是CaSO4以二水物的形式沉淀析出时,带走一部分水分;其次是在反应温度升高的过程中,由于没有密封反应器,致使一部分水蒸发所致。
图6-3为不同的反应温度对CaSO4产品收率及含量的影响试验研究结果。
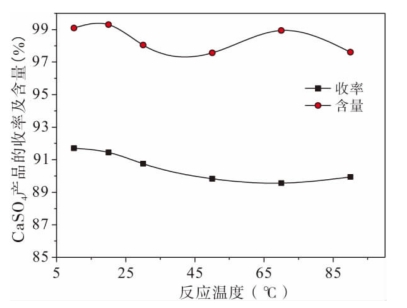
图6-3 不同反应温度对CaSO4产品收率及含量的影响
从图6-3可以看出,随着反应温度的升高,CaSO4产品的收率总体呈减小趋势。当反应温度由10℃升高至20℃时,CaSO4产品的收率由最大值91.71%降低至91.45%,两者收率仅仅相差0.26%;当反应温度升至70℃时,CaSO4产品的收率降低至最小值89.56%;当反应温度升至90℃时,CaSO4产品的收率回升至89.94%。而CaSO4产品的含量呈波浪形变化,当反应温度由10℃升高至20℃时,CaSO4产品的含量由99.01%升至99.03%,在这一条件下得到的CaSO4产品均可用作药剂辅料。继续升高反应温度至50℃,得到的CaSO4产品的含量达到了最低值,仅有97.57%;当反应温度由70℃升至90℃时,CaSO4产品的含量却从98.43%降至97.61%。
综合表6-5和图6-3的信息进一步证明,当反应温度为20℃时,CaSO4产品的含量为最大值,收率比最大值低0.26%,且大于99%,已达到作为药品辅料标准,因此综合考虑后宜选择20℃作为最佳的工艺条件。
表6-6为在不同的反应温度下沉淀HNO3浸出液中的钙时,钙、镁等元素进入不同物相中的分布研究结果。
表6-6 反应温度对HNO3浸出液沉钙过程中杂质分布的影响

由表6-6中的数据可以看出,采用H2SO4沉淀HNO3浸出液中的钙,经固液分离、洗涤后,随着反应温度的升高,固相中的CaO含量呈先增大后减小的趋势变化,但整体变化不大,都在HNO3浸出液带入CaO总量的89%左右,当反应温度为20℃时达到最高含量90.61%,进入滤液中的CaO占HNO3浸出液带入CaO总量的5%左右,进入洗涤液中的CaO占HNO3浸出液带入总量的3.3%左右;残留在固相中的MgO占HNO3浸出液带入MgO总量的10%~15.6%,进入滤液中的MgO占HNO3浸出液带入MgO总量的75%左右,进入洗涤液中的MgO占HNO3浸出液带入MgO总量的8%~13.4%;残留在固相中的Al2O3占HNO3浸出液带入Al2O3总量的2.73%~3.40%,进入滤液中的Al2O3占HNO3浸出液带入Al2O3总量的约84%,进入洗涤液中的Al2O3占HNO3浸出液带入Al2O3总量的约12%左右;铁在固相中的分布占HNO3浸出液带入Fe总量的2%~5%,进入滤液中的Fe占HNO3浸出液带入Fe总量的80%~87%,进入洗涤液中的Fe占HNO3浸出液带入Fe总量的10%~13%;氟在固相中的分布占HNO3浸出液带入F总量的1%左右,进入滤液中的F占HNO3浸出液带入F总量的85%~91%,进入洗涤液中的F占HNO3浸出液带入F总量的6%左右。
根据试验研究结果可知,沉钙过滤洗涤后,当反应温度为20℃(室温)时,有90.61%的CaO进入固相,随着温度的升高,约有88%以上的CaO进入固相,并且基本维持在88%~89%这一范围内。HNO3浸出液总量中MgO的80%以上、Al2O3约95%以上、Fe的94%以上和F的95%以上均进入了液相中。
6.2.4反应时间对H2SO4沉钙过程的影响
试验条件及操作方法:H2SO4质量分数为20%,H2SO4与HNO3浸出液体积比为0.6∶1;H2SO4一次性加入硝酸浸出液中,常温下搅拌速度为250 r/min,过滤水洗后在(250±5)℃下烘干。
在不同的反应时间下,H2SO4沉钙后所得HNO3浸出液的体积、洗液的体积、CaSO4洗涤干燥后的总质量见表6-7。
表6-7 反应时间对沉钙工艺的影响

从表6-7中可以看出,随着反应时间的延长,HNO3浸出液沉钙后得到的CaSO4质量随之增大,当反应时间由15 min增加至45 min时,CaSO4产品的质量由9.02 g增加至9.43 g,之后随着反应时间继续延长至60 min,CaSO4产品的质量只增加了0.025 g,到反应时间为90 min时,CaSO4产品的质量仅有9.57 g。试验研究结果表明,当反应时间>45 min后,CaSO4产品的质量增加比较平缓。
从表6-7还可以看出,在加入的初始反应液体积相同的情况下,随着反应时间的延长,所得到的滤液体积在小范围内波动,最高滤液量与最低滤液量仅相差6 mL。其原因是随着反应时间的延长,析出的CaSO4·2H2O越多,带出额外的水分就越多。
图6-4为反应时间对CaSO4产品收率及含量的影响试验研究结果。

图6-4 反应时间对CaSO4产品收率及含量的影响
由图6-4可以看出,随着反应时间的加长,CaSO4产品的收率基本上呈现了递增趋势,当反应时间由15 min增加到45 min时,CaSO4产品的收率由91.05%增加到91.31%;之后继续增加反应时间,CaSO4产品的收率几乎保持不变,维持在91.30%左右。而CaSO4产品的含量随着时间的延长呈现“N”型变化,当反应时间从15 min增加到60 min时,CaSO4产品的含量由99.05%增至99.67%,达到最大值;当反应时间延长至75 min时,CaSO4产品的含量降至最小值98.66%。
表6-7和图6-4的结果进一步表明,当反应时间由15 min增加到45 min时,CaSO4产品的收率增长了0.26%,含量增加了0.61%,收率和含量增幅都达到最大。而反应时间由45 min增加至60 min时,CaSO4产品的收率仅仅增长了0.2%,其含量反而降低;同时随着反应时间的增加,CaSO4在溶液中的溶解量会逐渐增加,其收率的曲线走势就证明了这一点。
综合考虑以上研究结果,本试验选择反应时间为45 min作为最佳制备工艺条件。
表6-8为在不同的反应时间下沉淀HNO3浸出液中的钙时,钙、镁等元素进入不同物相中的分布研究结果。
表6-8 反应时间对HNO3浸出液沉钙过程中杂质分布的影响

由表6-8中的数据可以看出,采用H2SO4沉淀HNO3浸出液中的钙,经固液分离、洗涤后,随着反应时间的增加,固相中的CaO占HNO3浸出液带入CaO总量的87.37%~91.72%,进入滤液中的CaO占HNO3浸出液带入CaO总量的5%左右,进入洗涤液中的CaO约占HNO3浸出液带入CaO总量的3%;残留在固相中的MgO占HNO3浸出液带入MgO总量的0.53%~3.68%,进入滤液中的MgO占HNO3浸出液带入MgO总量的66.35%~75.50%,进入洗涤液中的MgO占HNO3浸出液带入MgO总量的23.34%~33.37%;残留在固相中的Al2O3占HNO3浸出液带入Al2O3总量的0.90%~2.76%,进入滤液中的Al2O3占HNO3浸出液带入Al2O3总量的89%左右,进入洗涤液中的Al2O3占HNO3浸出液带入Al2O3总量的8%左右;铁在固相中的分布占HNO3浸出液带入Fe总量的5.29%~8.85%,进入滤液中的Fe占HNO3浸出液带入Fe总量的74.03%~81.56%,进入洗涤液中的Fe占HNO3浸出液带入Fe总量的10.63%~14.17%;氟在固相中的分布占HNO3浸出液带入F总量的0.68%~1.13%,进入滤液中的F占HNO3浸出液带入F总量的84.21%~86.79%,进入洗涤液中的F占HNO3浸出液带入F总量的12.48%~15.33%。
根据试验研究结果可知,沉钙、过滤、洗涤后,当反应时间为45 min,有91.31%的CaO进入固相,随着反应时间的延长,进入固相的CaO的含量变化不大。HNO3浸出液总量中MgO的98%以上、Al2O3的96%以上、Fe的91%以上和F的98%以上均进入了液相中。
6.2.5搅拌速度对H2SO4沉钙过程的影响
试验条件及操作方法:H2SO4质量分数为20%,H2SO4与HNO3浸出液体积比为0.6∶1;H2SO4一次性加入硝酸浸出液中,常温下,反应时间为45 min,过滤水洗后在(250±5)℃下烘干。
在不同搅拌速度下,H2SO4沉钙后所得HNO3浸出液的体积、洗液的体积、CaSO4洗涤干燥后的总质量见表6-9。
表6-9 搅拌速度对沉钙工艺的影响

从表6-9中可以看出,随着搅拌速度的增加,所得到的CaSO4产品的质量呈先增大后减少再增大的变化趋势。当搅拌速度由200 r/min增加到250 r/min时,CaSO4产品的质量由9.09 g增加到9.48 g;之后随着搅拌速度由250 r/min继续增加到350 r/min时,CaSO4产品的质量减少0.23 g;当搅拌速度增为400 r/min时,CaSO4产品的质量又增加到9.39 g。试验研究结果表明,当搅拌速度大于250 r/min时,增加搅拌速度,析出的CaSO4产品的质量反而减少。
由表6-9还可看出,在加入的初始反应液的量相同的条件下,随着搅拌速度的增加,所得到的沉钙滤液体积变化无规律。
图6-5为搅拌速度对CaSO4产品收率及含量的影响试验研究结果。
由图6-5可以看出,随着搅拌速度的增加,CaSO4产品的收率呈先增加后减小的趋势变化,但变化很小,说明搅拌速度对CaSO4产品的收率影响不大。当搅拌速度由200 r/min提至250 r/min时,CaSO4产品的收率由91.11%增加至91.51%;继续增加搅拌速度至300 r/min,CaSO4产品的收率增加了0.4%;当继续增加搅拌速度时,CaSO4产品的收率反而减小;当搅拌速度为400 r/min时,CaSO4产品的收率达到最小值90.76%。随着搅拌速度的增加,CaSO4产品的含量呈波浪形变化,当搅拌速度为200 r/min时,CaSO4含量达到最大值99.45%,随着搅拌速度的继续增加,CaSO4产品的含量反而下降,含量约为98.6%,当搅拌速度增加至350 r/min时,CaSO4产品的含量达到最小值97.76%。

图6-5 搅拌速度对CaSO4产品收率及含量的影响
表6-9和图6-5的结果进一步表明,当搅拌速度为250 r/min时,得到的CaSO4产品含量和收率仅次于最大值。虽然不是最大收率和最大含量,但是从搅拌速度由200 r/min提升到250 r/min的数据看,收率仅增加了0.4%,而当搅拌速度为250 r/min时,CaSO4产品的含量为98.64%,已达到工业一级品标准。
综合考虑以上研究结果,本试验选择反应时间为250 r/min作为最佳制备工艺条件。
表6-10为在不同的搅拌速度下沉淀HNO3浸出液中的钙时,钙、镁等元素进入不同物相中的分布研究结果。
表6-10 搅拌速度对HNO3浸出液沉钙过程中杂质分布的影响

由表6-10中的数据可以看出,采用H2SO4沉淀HNO3浸出液中的钙,经固液分离、洗涤后,随着搅拌速度的增加,固相中的CaO占HNO3浸出液带入CaO总量的87.82%~90.83%,进入滤液中的CaO占HNO3浸出液带入CaO总量的5%左右,进入洗涤液中的CaO约占HNO3浸出液带入CaO总量的4%;残留在固相中的MgO占HNO3浸出液带入MgO总量的1.96%~5.58%,进入滤液中的MgO占HNO3浸出液带入MgO总量的75.79%~86.28%,进入洗涤液中的MgO占HNO3浸出液带入MgO总量的11.59%~21.09%;残留在固相中的Al2O3占HNO3浸出液带入Al2O3总量的0.02%~2.45%,进入滤液中的Al2O3占HNO3浸出液带入Al2O3总量的81.36%~85.18%,进入洗涤液中的Al2O3占HNO3浸出液带入Al2O3总量11.86%~16.84%;铁在固相中的分布占HNO3浸出液带入Fe总量的2.84%~5.32%,进入滤液中的Fe占HNO3浸出液带入Fe总量的82.08%~85.33%,进入洗涤液中的Fe占HNO3浸出液带入Fe总量的10.97%~14.93%;氟在固相中的分布占HNO3浸出液带入F总量的0.54%~0.76%,进入滤液中的F占HNO3浸出液带入F总量的84.34%~88.48%,进入洗涤液中的F占HNO3浸出液带入F总量的12.94%~15.37%。
根据试验研究结果可知,沉钙、过滤、洗涤后,搅拌速度的变化对钙、镁等元素进入不同物相中的分布有一定的影响,但是影响不大。
6.2.6H2SO4加入方式对H2SO4沉钙过程的影响
试验条件及操作方法:反应时间为45 min,H2SO4质量分数为20%,搅拌速度为250 r/min,反应温度为室温,H2SO4与HNO3浸出液体积比为0.6∶1;水洗,在(250±5)℃下烘干。
加料方式如下:
A:将H2SO4一次性加入HNO3浸出液中。
B:将H2SO4分两批加入HNO3浸出液中,每隔15 min加入30 mL。
C:将H2SO4分三批加入HNO3浸出液中,每隔10 min加入20 mL。
D:将H2SO4与HNO3浸出液同时倒入烧杯中。
E:将HNO3浸出液分三批加入H2SO4中,每隔15 min加入50 mL。
F:将HNO3浸出液一次性加入H2SO4中。
表6-11为加料方式对CaSO4产品收率及含量的影响试验研究结果。
表6-11 加料方式对CaSO4产品收率及含量的影响

从表6-11可以看出,本试验是采用了三类不同的加料方式:
(1)将H2SO4分批次加入HNO3浸出液中。
(2)将HNO3浸出液分批次加入H2SO4中。
(3)将H2SO4与HNO3浸出液同时倒入烧杯中。
试验研究结果表明,除了加料方式D以外,其余5种加料方式生产的CaSO4产品,CaSO4含量均在99%以上。说明这5种加料方式对CaSO4产品中CaSO4含量基本没有影响。同时加料方式的改变,对CaSO4产品的收率影响也比较小,其收率基本维持在93%左右。
综合试验研究结果,本试验选择第一类加料方式,即将H2SO4分批次加入到HNO3浸出液当中。
6.2.7重现性试验
试验条件及操作方法:常温,H2SO4与HNO3浸出液的体积比为0.6∶1,反应时间为45 min,搅拌速度为250 r/min;将浓度为20%的H2SO4一次性加入HNO3浸出液中,过滤洗涤,在(250±5)℃下烘干。
做3次重复试验,试验研究结果见表6-12。
由表6-12可以看出,CaSO4产品含量和收率的误差均小于1%,试验结果重现性良好,表明试验得到的工艺条件可靠。3次重复试验CaSO4产品收率分别为92.33%、92.57%、92.65%,含量分别为99.16%、99.17%、98.94%,取平均值后,收率为92.52%,纯度为99.09%。
表6-12 重现性试验结果

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














