一、 实验目的
1. 学习用热量计测定物质生成焓的简单方法。
2. 加深对有关热化学知识 (盖斯定律) 的理解。
二、 实验原理
本实验用热量计分别测定NH4Cl(s)的溶解热和NH3(aq)与HCl(aq)反应的中和热,再利用NH3(aq)和HCl(aq)的标准摩尔生成焓数据,通过盖斯定律计算NH4Cl(s)的标准摩尔生成焓。
热量计是用来测定反应热的装置。 本实验采用保温杯式简易量热计测定反应热。 化学反应在热量计中进行时, 放出 (或吸收) 的热量会引起热量计和反应物质的温度升高 (或降低)。
式中, ——中和热,J/mol;
——中和热,J/mol;
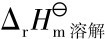 ——溶解热,J/mol;
——溶解热,J/mol;
m——物质的质量, g;
c——物质的比热容,J·g-1·K-1;
ΔT——反应终了温度与起始温度之差, K;
cp——热量计的热容,J·K-1;
n——反应物质的摩尔数, mol。
由于反应后的温度需要一段时间才能升到最高值, 而实验所用简易热量计不是严格的绝热系统, 因此, 在这段时间热量计不可避免地会与周围环境发生热交换。 为了校正由此带来的温度偏差, 需用图解法 (如图2.2所示) 确定系统温度变化的最大值, 即以测得的温度为纵坐标、 时间为横坐标绘图, 按虚线外推到开始混合的时间 (t=0), 求出温度变化最大值 (ΔT)。 这个外推的ΔT值能较客观地反映出由反应热所引起的真实温度变化。
图2.2 燃烧热测定数据的图解法处理示意图
热量计的热容是使热量计温度升高1K所需要的热量。 确定热量计热容的方法是: 在热量计中加入一定质量m(如50g)、温度为T1的冷水,再加入相同质量的温度为T2的热水,测定混合后水的最高温度T3。已知水的比热容为4.184J·g-1·K-1,设热量计的热容为cp,则
热水失热=4.184m(T2→T3)
冷水得热=4.184m(T3→T1)
量热计得热=cp(T3→T1)
热水失热=冷水得热+量热计得热
cp=4.184m[(T2→T3)-(T3→T1)]/(T3-T1)
三、 仪器、 药品及材料
仪器: 保温杯、1/10℃温度计、 台秤、 秒表、 烧杯 (100m L)、 量筒 (100m L)。
药品:HCl溶液(1.5mol·L-1)、NH3H2O溶液(1.5mol·L-1)、NH4Cl(s)。
四、 实验内容
1. 量热计热容的测定
1) 用量筒量取50.0m L去离子水, 倒入量热计中, 盖好后适当摇动, 待系统达到热平衡后(5~10min),记录温度T1(精确到0.1℃)。
2) 在100m L烧杯中加入50.0m L去离子水,加热到高于T130℃左右,静置1~2min;待热水系统温度均匀时,迅速测量温度T2(精确到0.1℃),尽快将热水倒入热量计中, 盖好后不断地摇荡保温杯, 并立即计时和记录水温; 每隔30s记录一次温度, 直至温度上升到最高点, 再继续测定3min。
将上述实验重复一次, 取两次实验所得结果, 作温度-时间图, 用外推法求最高温度T3,并计算热量计热容Cp的平均值。
2. 盐酸与氨水的中和热及氯化铵溶解热的测定
1) 用量筒量取50.0m L的1.5mol·L-1HCl溶液,倒入烧杯中备用;洗净量筒,再量取50.0m L的1.5mol·L-1NH3·H2O,倒入热量计中,在酸碱混合前,先记录氨水的温度5min (间隔30s, 温度精确到0.1℃, 以下相同); 将烧杯中的盐酸加入热量计, 立刻盖上保温杯顶盖, 测量并记录温度-时间数据, 并不断地摇荡保温杯, 直至温度上升到最高点,再继续测量3min; 依据温度-时间数据作图, 用外推法求ΔT。
2) 称取4.0g NH4Cl(s)备用,量取100m L去离子水,倒入热量计中,测量并记录水温5min;然后加入NH4Cl(s)并立刻盖上保温杯顶盖,测量温度-时间数据,不断地摇荡保温杯, 促使固体溶解, 直至温度下降到最低点, 再继续测量3 min; 最后作图, 用外推法求ΔT。
简而言之, 需要做以下三项操作:
①分别列表记录有关实验的时间-温度数据。
②作温度-时间图, 用外推法求ΔT。
③计算量热计热容量、中和热、溶解热和NH4Cl(s)生成热。
五、 数据记录与处理
1. 中和焓的测定数据表 (表2.4)
表2.4 数据记录
2. 溶解焓的测定 (表2.5)
表2.5 数据记录
3. 数据处理
实验中的NH4Cl溶液浓度很小,作为近似处理可以假定:①溶液的体积为100m L;②中和反应热只能使水和热量计的温度升高;③NH4Cl(s)溶解时吸热,只能使水和热量计的温度下降。
由相应的温差(ΔT) 和水的质量(m)、比热容(c) 及热量计的热容(cp),即可分别计算出中和反应热和溶解热。
已知NH3(aq)和HCl(aq)的标准摩尔生成焓分别为-80.29k J·mol-1和-167.159k J·mol-1,根据盖斯定律计算NH4Cl(s) 的标准摩尔生成焓,并对照查得的数据计算实验误差(如操作与计算正确, 所得结果的误差可小于3%)。
六、 思考题
1. 为什么放热反应的温度-时间曲线的后半段逐渐下降, 而吸热反应则相反?
2.NH3(aq)和HCl(aq)反应的中和热和NH4Cl(s)的溶解热之差,是哪一个反应的热效应?
3. 实验产生误差的可能原因是什么?
4.如果实验中有少量HCl溶液或NH4Cl固体黏附在量热计器壁上,对实验结果产生怎样影响?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














