第二节 核酸杂交探针
核酸探针(probe)是指能与特定核酸序列发生特异性互补的带有标记物(示踪物)的序列已知的核酸片段,用来探测待测核酸样品中特定基因顺序。基因探针根据标记物不同可粗分为放射性探针和非放射性探针两大类,根据探针的核酸性质不同又可分为基因组DNA探针、cDNA探针、RNA探针、cRNA探针及寡核苷酸探针等几类,DNA探针还有单链和双链之分。
一、探针种类
1.基因组DNA探针 是最常用的核酸探针,指长度在几百碱基对以上的双链DNA或单链DNA探针。现已获得DNA探针数量很多,有细菌、病毒、原虫、真菌、动物和人类细胞基因组DNA探针。这类探针多为某一基因的全部或部分序列,或某一非编码序列。要获得某特异的核酸探针,通常要采取建立基因组DNA文库的办法,即将基因组DNA切成小片段后分别克隆得到包含基因组的全信息的克隆库。然后从文库中筛选出含有目的基因的阳性克隆,经扩增、提取和标记而得到基因组DNA探针。真核基因组DNA探针(包括cDNA探针)的主要有3个优点:①这类探针多克隆在质粒载体中,可以无限繁殖,取之不尽,制备方法简便;②DNA探针不易降解(相对RNA而言),一般能有效抑制DNA酶活性;③DNA探针的标记方法较成熟,有多种方法可供选择,如缺口平移、随机引物法、PCR标记法等,能用于放射性核素和非放射性核素标记。在选择此类探针时,要尽可能使用基因的编码序列(外显子)作为探针,而避免使用内含子及其他非编码序列,否则探针中可能因高度重复序列的存在引起非特异性杂交而出现假阳性结果。另外没有通过特殊制备的基因组DNA探针一般为双链探针,在杂交过程会产生自身退火,称为无效杂交,降低了探针的杂交效率。
2.cDNA探针 是指互补于mRNA的DNA分子。cDNA是由mRNA经一种称为反转录酶(reverse transcriptase)的DNA聚合酶催化产生的,这种反转录酶是Temin等在20世纪70年代初研究致癌RNA病毒时发现的。该酶以RNA为模板,根据碱基配对原则,按照RNA的核苷酸顺序合成DNA(其中U与A配对)。这一途径与一般遗传信息流的方向相反,故称反向转录或反转录。反转录酶的作用是以dNTP为底物,RNA为模板,tRNA(主要是色氨酸tRNA)为引物,在tRNA3′-OH末端上,按5′→3′方向,合成与RNA互补的DNA单链,称为互补DNA(cDNA),单链cDNA与模板RNA形成RNA-DNA杂交体。随后在反转录酶的RNA酶(RNase)H活性作用下,将RNA链水解成小片段。cDNA单链的3′末端回折形成一个小引物末端,反转录酶又以第一条cDNA链为模板再合成第二条cDNA链,至此,完成反转录全过程,合成双链cDNA。
所得到的双链cDNA分子经S1核酸酶切平两端后接一个有限制酶切点的接头,再经特定的限制酶消化产生黏性末端,即可与含互补末端的载体进行连接。常用的克隆载体是λ噬菌体DNA,如λgt,EMBL和Charon系列等。用这类载体可以得到包含104以上的转化子的文库,再筛选出特定基因克隆。用这种技术获得的DNA探针不含有内含子序列,比基因组DNA探针特异高,但其中的poly(dT)产生的非特异性杂交问题也应值得注意。而且还是双链探针,同样具有无效杂交问题。
3.RNA探针 是一类很有前途的核酸探针,由于RNA是单链分子,所以它与靶序列的杂交反应效率极高。早期采用的RNA探针是细胞mRNA探针和病毒RNA探针,这些RNA是在细胞基因转录或病毒复制过程中得到标记的,标记效率往往不高,且受到多种因素的制约。这类RNA探针主要用于研究目的,而不是用于检测。
近几年体外转录技术不断完善,已相继建立了单向和双向体外转录系统,可获得高标记的RNA探针。RNA探针除可用于检测DNA和mRNA外,还有一个重要用途,在研究基因表达时,常需要观察该基因的转录状况。
RNA作为核酸分子杂交的探针是较为理想的。这是因为:①RNA/RNA和RNA/DNA杂交体的稳定性较DNA/DNA杂交体的稳定性高,因此杂交反应可以在更为严格的条件下进行(杂交温度可提高10℃左右);②单链RNA分子由于不存在互补双链的竞争性结合(无效杂交),其与待测核酸顺序杂交的效率较高;③由cDNA转录而来的RNA中不存在高度重复序列,因此非特异性杂交也较少;④杂交后可用RNase将未杂交的游离探针消化掉,从而使本底降低。但是RNA极易被环境中大量存在的核酸酶所降解,因此,操作中要特别注意防止RNase的污染。
4.寡核酸探针 前述3种探针均是可克隆的,一般情况下,只要有克隆的探针,就不用寡核苷酸探针。克隆探针一般较寡核苷酸探针特异性强,复杂度也高,从统计学角度而言,较长的序列随机碰撞互补序列的机会较短序列少;克隆探针的另一优点是,可获得较强的杂交信号,因为克隆探针较寡核苷酸探针掺入的可检测标记基因更多。但是,较长的探针对于靶序列变异的识别能力又有所降低,对于仅是单个碱基或少数碱基不同的两序列,克隆探针不能区分,往往杂交信号相当。这既是其优点,又是其缺点。优点是灵敏度高,缺点则是不能用于点突变的检测。这种情况下,通常要采用化学合成的寡核苷酸探针。
合成的寡核苷酸探针具有一些独特的优点:①可以根据需要进行设计和人工合成,在核酸序列未知情况下,可根据蛋白质序列进行设计;②由于链短,其序列复杂度低,相对分子质量小,所以和等量靶位点完全杂交的时间比克隆探针短;③寡核苷酸探针可识别靶序列内1个碱基的变化,适合于点突变研究,因为短探针中碱基的错配能大幅度地降低杂交体的Tm值;④一次可大量合成寡核苷酸探针(1~10mg),使得这种探针价格低廉,与克隆探针一样,寡核苷酸探针能够用酶学或化学方法修饰以进行非放射性标记物的标记。缺点是特异性和灵敏度较低。但可通过细心筛选序列和(或)选择相对长的序列(>30nt)设计出特异的寡核苷酸探针。
在采用寡核苷酸探针进行点突变检测杂交的反应时,洗膜条件和温度的选择往往更为重要。所选漂洗条件必须使野生型靶DNA与探针产生强的杂交信号而突变型靶DNA则不产生杂交信号,这可以通过逐渐提高洗膜温度来完成。
5.单链DNA探针 性质可以是基因组DNA或cDNA,只是通过特别的制备方法,将原来的双链探针制成单链,从而避免了双链探针的无效杂交,提高了杂交效率。特别是对于那些同源性较低的交叉杂交优为有用。此外,在S1核酸酶图谱分析内含子和外显子实验时,使用单链DNA探针,就不必采用特殊的杂交条件来抑制不需要的DNA/DNA自身杂交体的形成,更有利于图谱分析的完成。单链DNA探针的制备将在下面介绍。
二、探针的制备
1.双链DNA探针 包括基因组DNA探针和cDNA探针,它们的制备过程相似,首先从基因文库或cDNA文库中筛选出所需的基因重组体,再将基因片段重组到适当的质粒载体上。该重组质粒经大量扩增、提取、纯化、酶切、电泳分离得到大量基因片段,再经放射性核素或非放射性标记,即可作为杂交探针(图4-4)。
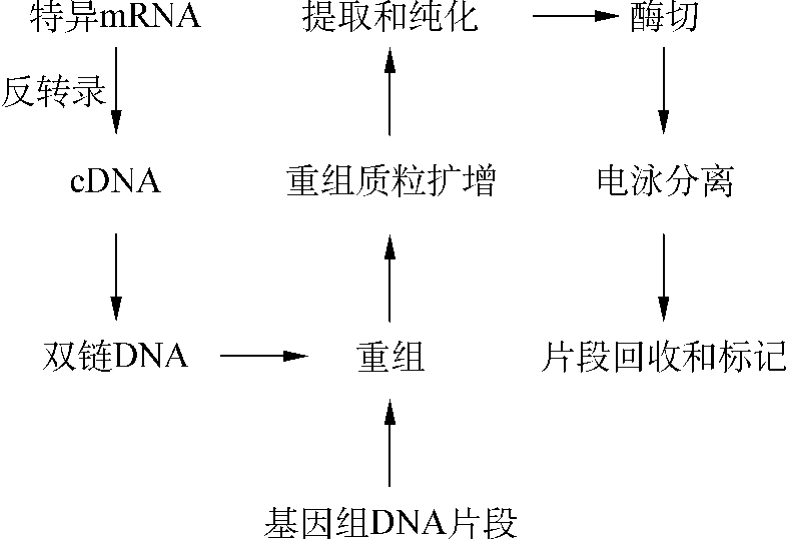
图4-4 双链DNA探针的制备
以大肠埃希菌作为宿主的重组质粒的提取方法主要有SDS裂解法和碱裂解法。SDS裂解法较温和,可用于较大重组质粒(>15kb)的提取,但得率较低。而碱裂解法则是最常用的方法,在碱性条件下(pH=12),SDS的裂解效率大大提高,细菌蛋白质和染色体DNA变性完全,重组质粒的得率提高。经裂解得到的重组质粒为粗纯物,必须进一步纯化才能用于标记和作为探针使用。
重组质粒DNA的纯化方法有层析法、离心法、电泳法和沉淀法。层析法是目前科研中较常用的方法,可直接购买层析管,方法简单易行;氯化铯等密度离心法是经典的质粒提纯方法,方法可靠,纯度高,可用于大量的高纯度的重组质粒的制备,但需要配备超速离心机。
纯化后的重组质粒可直接用于探针的标记,但为了避免载体可能带来的非特异杂交和提高标记及杂交效率,常将重组质粒进行酶切,然后回收特异的目的基因片段来做探针。酶切后首先经凝胶电泳将载体与基因片段分开,然后从凝胶中回收目的基因片段。凝胶中DNA片段的回收方法有电泳洗脱法、低熔点凝胶挖块法、插片法、SDS浸出法、NaI/DNA结合物法、冷冻压榨法等。其中较常用的有低熔点凝胶挖块法和插片法。低熔点琼脂糖凝胶因导入羟乙基修饰后凝固点降为30℃,熔化温度为65℃,这一温度低于绝大多数双链DNA的变性温度。因此,通过电泳分离,切下目的基因所在凝胶条带,65℃熔化,酚抽提后,即可得到所要的目的基因DNA片段。传统的插片法是使用DEAE纤维素纸片插入,对于<5kb的DNA片段回收率可达50%,对于>20kb DNA片段回收率降为20%左右。后来许多实验室改用透析袋包裹回收DNA片段,取得了良好效果,该方法简单快速,回收率高。此外。现已有回收试剂盒可直接使用。回收得到的探针片段的标记将在下列内容中描述。
2.单链DNA探针 为了提高杂交效率和应用于液相杂交,常将基因组DNA或cDNA探针克隆于M13噬菌体的单链DNA上,再与人工合成的寡核苷酸退火,并以此为引物合成与探针片段互补的DNA链。引物通常与M13噬菌体载体上靠近多克隆位点3′端的LacZ基因的一个区域互补,称为通用引物,序列为CACAATTTCACACAAC。可用于制备克隆于M13载体的任意目的基因探针片段。所用的聚合酶为大肠埃希菌DNA聚合酶的Klenow片段,底物为4种三磷酸核苷酸(dNTP)和一种带标记的核苷酸,在酶的作用下合成放射性或非放射性标记的与目的基因片段互补的链。一般说来,反应产物是不均匀的,有长有短,然后用限制性内切酶在克隆化序列内部或在其下游切割,产生一段部分双链DNA,一条是放射性标记的探针,另一条是未标记的模板,最后用变性凝胶电泳将探针与模板链以及3′端小片段分开(图4-5)。
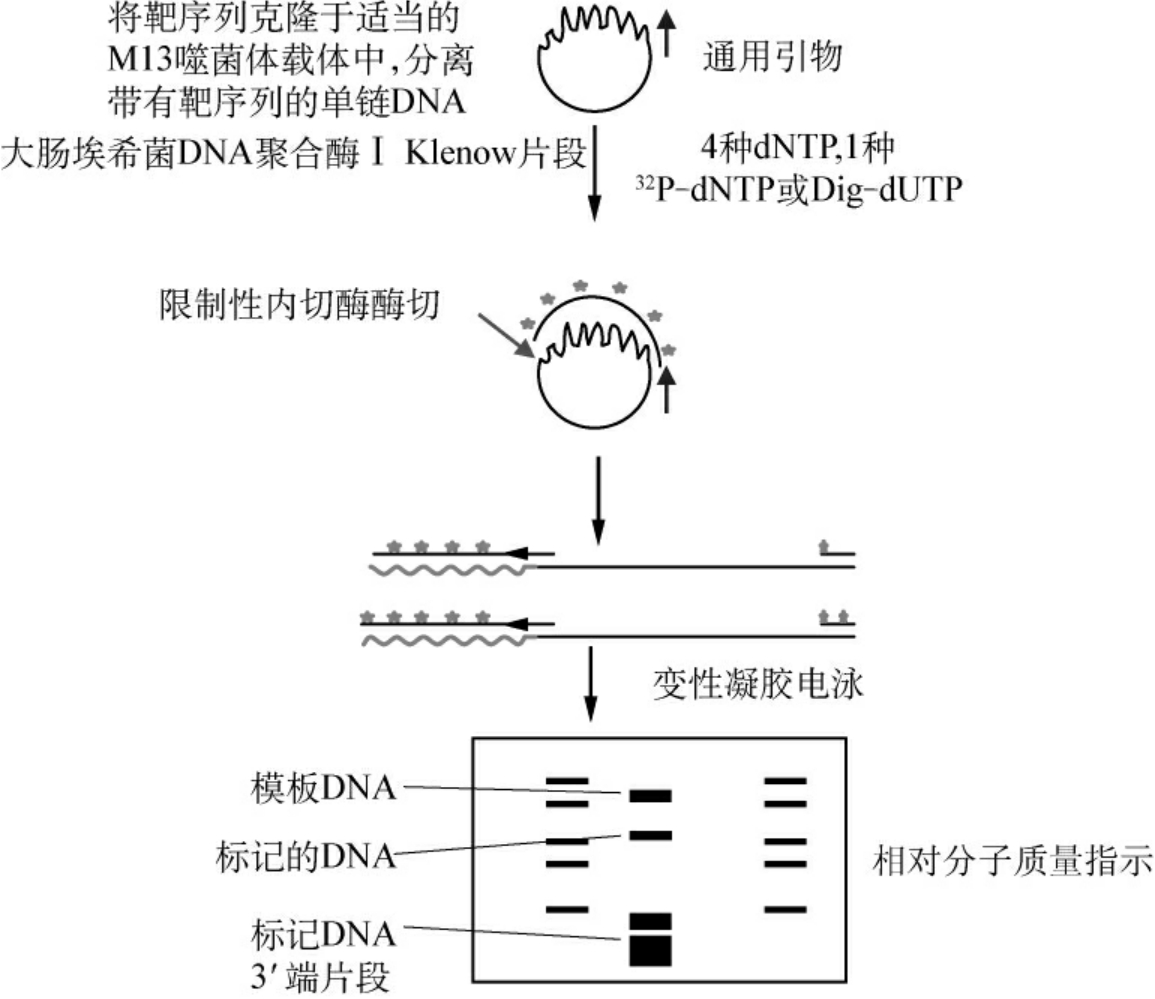
图4-5 单链DNA探针的制备
合成链的长短、比活度和得率受到引物、模板和dNTP相对浓度的影响,减少模板量可以提高产物的长度。如何调整引物、模板和dNTP的相对量,往往取决于所制备探针的最终用途,如果用于Southern印迹或Northern印迹杂交,则模板量保持最小,而标记的dNTP的浓度应尽可能大。若用于S1核酸酶分析,获得全长探针更为重要,这时可用同种未标记的dNTP补充标记的dNTP的量,如用dATP补充32P-dATP,使两者之和接近Km值。
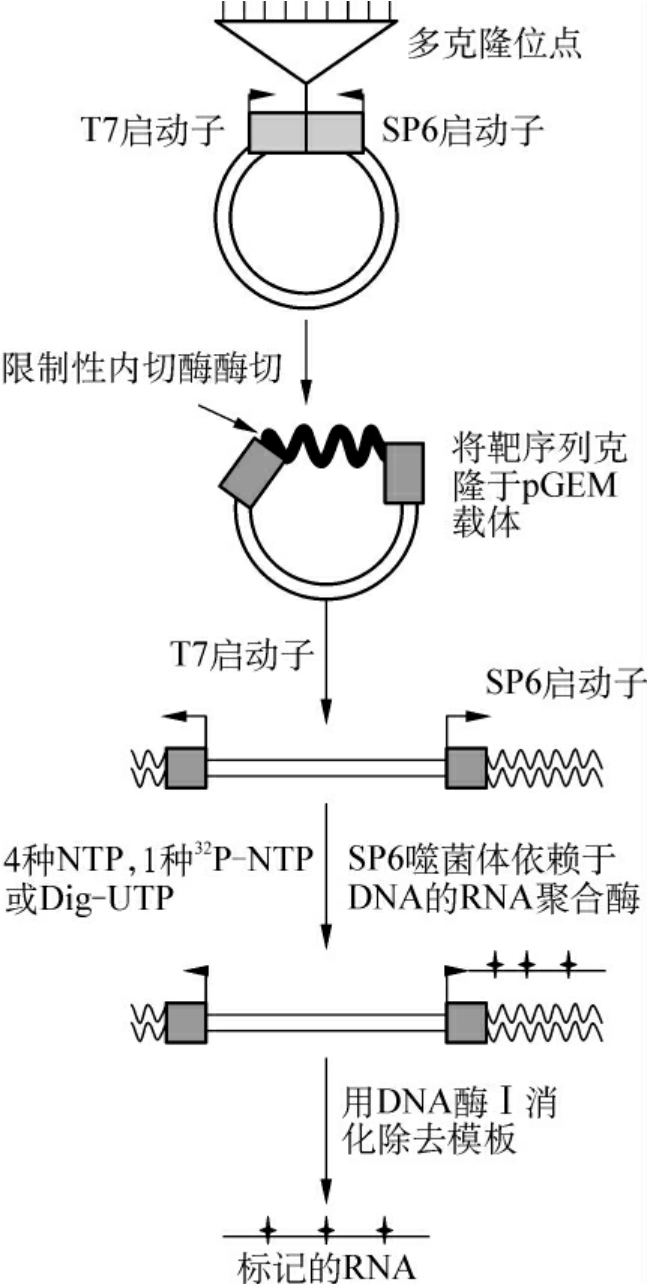
图4-6 RNA探针的制备
3.RNA探针 近几年体外转录技术不断完善,已相继建立了单向和双向体外转录系统,该系统主要基于一类新型载体pSP和pGEM,这类载体在多克隆位点两侧分别带有鼠伤寒杆菌SP6启动子和大肠埃希菌噬菌体T7启动子,在SP6RNA聚合酶或T7RNA聚合酶作用下可以进行RNA转录,如果在多克隆位点接头中插入了外源DNA片段,则可以此DNA两条链中的一条为模板转录生成RNA。这种体外转录的模板可以反复使用,反应效率很高,在1小时内可合成近10μg的RNA,只要在底物中加入适量的放射性或地高产标记的NTP,则所合成的RNA可得到高效标记。该方法能有效地控制探针的长度并可提高标记物的利用率。合成过程见图4-6。
值得一提的是,通过改变外源基因的插入方向或选用不同的RNA聚合酶,可以控制RNA的转录方向,即以哪条DNA链为模板转录RNA。这种可以得到同义RNA探针(与mRNA同序列)和反义RNA探针(与mRNA互补),反义RNA又称cRNA,除可用于反义核酸研究外,还可用于检测mRNA的表达水平。在这种情况下,因为探针和靶序列均为单链,所以杂交的效率要比DNA-DNA杂交高几个数量级。RNA探针除可用于检测DNA和mRNA外,还有一个重要用途,在研究基因表达时,常常需要观察该基因的转录状况。在真核生物中某些基因存在反向转录,产生反义RNA,参与自身表达的调控。在这些情况下,要准确测定正向和反向转录水平就不能用双链DNA探针,而只能用RNA探针或单链DNA探针。
4.寡核苷酸探针 核酸分子杂交所使用的探针可以来源于自身或其他物种的同源序列,也可以是人工合成的寡核苷酸序列,后者尤其适用于只知道特定目的DNA片段的部分序列时。寡核苷酸的人工合成方法有化学合成法和酶合成法。化学合成法可以由高度自动化的机器来完成,为目前人工合成的主要方法。人工合成的寡核苷酸探针一般为20~50bp,这些寡核苷酸可以经DNA连接酶合成更长的探针。
对于一些尚未克隆的基因,序列未知,可根据其蛋白质氨基酸序列合成相应的寡核苷酸序列作为探针进行检测。由于氨基酸密码的简并性,同一氨基酸可由多种密码子编码,使得我们根据蛋白质的氨基酸序列来推测其基因的碱基顺序的工作变得甚为困难,因此寡核苷酸探针的设计是一个极为重要而又复杂的工作。有两种方法可采用:①设计比较短的寡核苷酸探针(对于真核生物至少17个核苷酸),将所有密码子的可能性都考虑进去,合成一整套寡核苷酸探针,称为简并性高的成套寡核苷酸探针;②设计比较长的寡核苷酸探针,这时根据可能密码子推测出来的寡核苷酸序列数量会很多,不可能合成那么多的探针,只能挑选一些可能性较高的序列,称为猜测体,这些探针称为较长简并性较低的成套寡核苷酸探针。对猜测体的选择有以下几个原则可供参考。
(1)要尽量选择那些含只有一种编码的氨基酸(如色氨酸和甲硫氨酸)的多肽作为合成寡核苷酸探针的参照。
(2)尽管同一氨基酸可由多种密码子编码,但其使用频率是不一样的,因此应优先考虑使用频率较高的密码子。
(3)前一种氨基酸的密码子也会影响下一种氨基酸密码子的使用,这是因为在真核基因中,极少有5′-CpG-3′序列的出现,因此在设计寡核苷酸探针时,当两个相邻的氨基酸的最高频密码子相连会导致CG顺序的出现时,则应将其中一种氨基酸的密码子换为次高频密码子。
(4)避免单一碱基的重复出现(不能多于4个),如—CCCCC—。
(5)一旦选定某一序列更符合上述标准,最好将该序列与核酸库中核酸序列比较,探针序列应与含靶序列的核酸杂交,而与非靶区域的同源性不能超过70%或有连续8个或更多的碱基的同源,否则该探针不能用。
三、探针标记
核酸探针必须加以标记,带有示踪物,与靶基因杂交后产生的杂交信号才能显示出来。对于体外制备的单链DNA探针和RNA探针,在制备时已进行了标记外,大多数探针需要另外进行标记才能使用。进行探针标记的标记物分为两大类:放射性和非放射性。常用的放射性标记物有32P、33P、3H和35S等;非放射性标记物有下述几类:金属如Hg,荧光物质如FITC、GFP,半抗原如地高辛、生物素,酶类如辣根过氧化物酶(HRP)、半乳糖苷酶或碱性磷酸酶(AP)等。不同的标记物,所用的标记方法及检测方法也各异。核酸探针的常用酶促标记方法有:缺口平移、末端标记、随机引物延伸、聚合酶链反应(PCR),这些方法既可用于放射性标记物,可用于非放射性标记物。
(一)标记物
一种理想的探针标记物,应具备以下几种特性:①高度灵敏性;②标记物与核酸探针分子的结合,应绝对不能影响其碱基配对特异性;③应不影响探针分子的主要理化特性,特别是杂交特异性和杂交稳定性,杂交体的解链温度(Tm)应无较大的改变;④当用酶促方法进行标记时,应对酶促活性Km值无较大的影响以保证标记反应的效率和标记产物的比活性,当标记探针还继续作为下一步酶促反应的底物(如用于DNA序列测定)时,应不能影响此步骤的酶活性;⑤检测方法除要求高度灵敏性外,还应具有高度特异性,尽量减低假阳性率。如果要求更严一些,它还应具有较高的化学稳定性,保存时间较长,标记及检测方法简单;对环境无污染,对人体无损伤;价格低廉等。
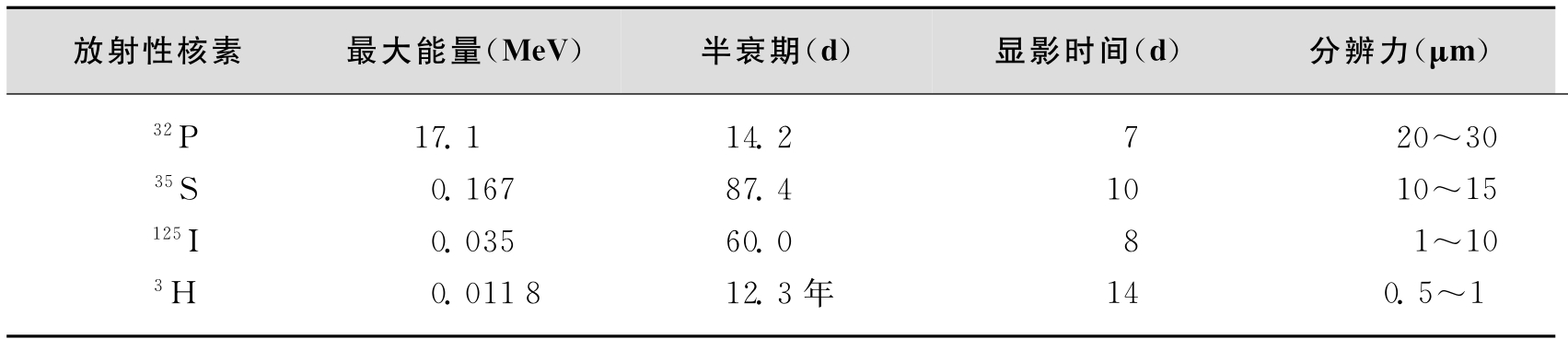
1.放射性标记物 放射性核素是目前应用最多的一类探针标记物。放射性标记物的灵敏度极高,可以检测到10-14~10-18g的物质,在最适条件下,可以测出样品中少于1000个分子的核酸含量。其最大的优点是,放射性核素与相应的元素具有完全相同的化学性质,因为两者之间的差别只在中子数目上,质子和电子数完全一致,而元素的化学性质是由其核外电子决定的,因此对各种酶促反应无任何影响,也不会影响碱基配对的特异性与稳定性和杂交性质。放射性核素的检测具有极高的特异性,按严格规程操作则假阳性率极低。其主要缺点是易造成放射性污染。另外,当标记活性极高时,放射线可以造成核酸分子结构的破坏。此外,多数放射性核素的半衰期都较短,因此必须随用随标,标记后立即使用,不能长期存放(3H和14C除外)。常用于标记核酸探针的放射性核素有32P、3H和35S,另外亦有人使用14C、125I以及131I等。32P因其能量高,信号强,所以最常用,33P能量较弱,分辨率较高,用于DNA芯片;3H的半衰期长达12.3年,但它所释放β线的能量太低,只能用于组织原位杂交;125I和35S用于蛋白质标记,几种常用放射性核素性质见表4-1。
表4-1 用于探针标记的放射性核素
2.非放射性标记物 放射性核素标记固然十分灵敏,但存在着放射性污染及放射性核素发生衰变所产生的不稳定性两大缺点。因此,多年以来科学家们致力于寻找一些安全可靠、灵敏度高的物质以替代放射性核素用于核酸分子杂交,并取得了一定的进展,部分非放射性标记物已开始在国内外逐步推广使用。特别是近年来,由于高灵敏度的碱性磷酸酶和过氧化物酶的底物——化学发光剂的出现,使非放射性标记的灵敏度与放射性标记相当。因此,非放射性标记越来越受到重视。其优点是无放射性污染,稳定性较好,可以较长时间存放,从而更便于临床诊断等方面的应用。非放射性标记物有生物素、地高辛、荧光素、金属和酶。
(1)生物素:是一种相对分子质量小的水溶性维生素。在核苷酸上,如尿嘧啶环的C-5位上共价连接一个生物素分子,就形成生物素-UTP或生物素-dUTP,可以作为标记物前体掺入核酸,而且不改变核酸探针杂交特性。探针中生物素分子具有抗原性质,可与抗生物素抗体结合。生物素有一天然配体——亲和素(avidin),或称卵白素、生物素结合蛋白或抗生物素蛋白,现多采用链霉亲和素(streptavidin)来取代亲和素。生物素结合蛋白与酶或荧光素偶联,即可通过酶催化底物来进行条带显色,或荧光显色。
生物素标记可通过缺口平移法或随机引物法进行外,还可采用直接化学反应法。光敏生物素是一种化学合成的生物素衍生物,它可以在光的照射下直接与核酸反应,生成生物素标记的核酸探针,但通过该方法标记的核酸探针要高度纯化。
(2)地高辛:又称异羟基洋地黄毒苷配基,是一种类固醇,来源于植物的花和叶。其他生物中不含有抗地高辛的抗体,不像生物素标记存在着干扰。地高辛连接于UTP或dUTP上,可通过随机引物法、缺口平移法、末端标记法以及PCR合成直接掺入法进行标记。地高辛标记的探针与靶核酸杂交后,用带有荧光素、碱性磷酸酶或过氧化物酶的抗地高辛抗体进行免疫结合反应,带荧光的,可直接在荧光显微镜下观察;带酶的通过酶底物的化学呈色来显示。
应用地高辛标记的核酸探针比较稳定,据报道在-20℃贮存可达2年,可随时取用,不像放射性标记探针有半衰期所致的时间限制。为节省核酸探针的用量,凡使用过的含有探针的杂交液也可反复多次使用,特别是对于已知的重复性实验。对于细胞或组织内未知mRNA的检测,仍宜采用未使用过的探针杂交液为佳。
与放射性标记相比,地高辛标记探针具有非放射性探针的优点,对人体无害,不受半衰期限制,探针可长期保存。与生物素标记探针相比,地高辛探针不受组织、细胞中内源性生物素的干扰,敏感性高。由于地高辛具有灵敏度及分辨率高,反应产物颜色鲜艳,反差好,背景染色低,制备探针可较长期保存,对人体无害等优点,已日益显示出它的优越性和广泛的应用前景。它不仅可应用于原位杂交细胞化学,还可应用于Southern印迹杂交法检测特定基因组序列,进行RFLP分析用于基因诊断,菌落原位杂交,噬菌斑原位杂交,固定细胞及中期染色体原位杂交以及生物体液中和组织中病毒DNA序列的检测。
(3)非放射性核素探针的检测:非放射性标记无放射性污染,可在组织上直接显色,具有稳定、安全、经济及实验周期短等特点,特别是近年来,随着化学发光剂的使用,非放射性标记的灵敏度大大地提高了,它的应用也越来越广泛。根据其检测方法,非放射性标记物可分为以下几类。
1)半抗原:目前使用得较多的非放射性标记物是生物素和地高辛,它们都是半抗原,可以利用这些抗原的抗体进行免疫检测。一般经两步反应:第一步称为偶联反应,根据偶联反应的不同,可分为直接法、间接免疫法、直接亲和法、间接亲和法和间接免疫-亲和法。第二步称为显色反应,通过连接在抗体或抗生物素蛋白上的显色物质(如酶、荧光素等)进行杂交信号的检测。常用的检测物质与方法有以下几类:①酶促化学显色:这是最常用的检测方法,但灵敏度较低。通过酶促反应使其底物形成有色反应产物。最常用的酶是碱性磷酸酶和辣根过氧化酶,也偶见有使用酸性磷酸酶和半乳糖苷酶。②化学发光法:一些化学物质在酶催化的化学反应过程中伴随着发光作用,可在胶片上感光显影。化学发光灵敏度高,可适用于Southern、Northern及斑点杂交。
2)配体:生物素还是一种抗生物素蛋白和链霉菌类抗生物素蛋白,可以利用亲和法进行检测。
3)荧光素:如绿色荧光蛋白(GFP)、FITC、罗丹明类等,可以被紫外线激发出荧光进行观察,主要适用于细胞原位杂交和染色体杂交。
4)以光密度或电子密度标记物:如金、银等,适用于细胞原位杂交,可以在光镜下或电镜下进行观察。
(二)探针的标记方法
除了一些非放射性标记物,如荧光素、酶和生物素可直接与核酸进行化学反应,将标记物连接于核酸上,或由化学合成和PCR扩增的探针以及M13载体制备单链探针和体外转录RNA探针可采用直接掺入法外。较常用的方法是预先将放射性核素或非放射性标记物连接于NTP或dNTP上,然后采用酶促反应将标记物掺入到核酸探针中,酶促反应包括缺口平移、随机引物延伸和各种末端标记方法。
1.切口平移法(nick translation) 该方法依赖于大肠埃希菌DNA聚合酶Ⅰ(E.coli DNA polymeraseⅠ)同时兼备5′→3′聚合酶活性和5′→3′及3′→5′外切酶活性的特点。首先极微量DNA内切酶(DNaseⅠ)在DNA的两条链上随机地产生切口。接着,DNA聚合酶Ⅰ在切口部位表达外切酶活性,将核苷酸自5′→3′方向切去。同时,以切口部位末端核苷酸的3′-羟基为引物,利用聚合酶Ⅰ的聚合活性,将DNA链延长。5′-端核苷酸的去除与3′-端核苷酸的加入同时进行,导致切口沿着DNA链移动。因为反应体系中含有放射性核素标记的dNTP,通常为[α32P]-dCTP,切口平移的结果使带放射性核素的核苷酸取代了原无标记的同种核苷酸,使新合成的DNA链带上了放射性核素标记(图4-7)。
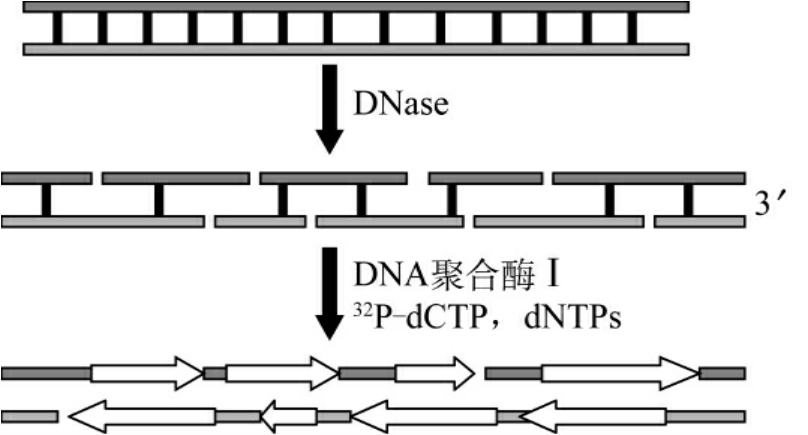
图4-7 切口平移法标记探针
标记片段的大小和标记效率取决于DNaseⅠ的浓度和聚合酶Ⅰ的用量。用切口平移法可以对双链线性DNA或环状DNA作比放射性高达108cpm/μg的标记。
切口平移法所用DNA聚合酶必须是E.coli DNA聚合酶全酶,由于此聚合酶的Klenow片段(大片段聚合酶)不具有5′→3′外切酶活性,所以不能用大片段酶代替进行。DNaseⅠ的浓度一定要适当。DNaseⅠ浓度过大,则将导致DNA链上形成的切口过多,从而使探针长度过短,影响下一步杂交反应的效率;如DNaseⅠ用量过小,则不足以形成足量的缺口,将会使标记效率下降。由不同厂家、不同批号的DNaseⅠ的活性各不相同,因此每当换用另一批号的DNaseⅠ时,都应进行预试验,摸索出适当DNaseⅠ用量。理想的结果应使30%~60%的核苷酸接到DNA中最后形成的单链DNA。探针的理想长度为400~800bp,此长度范围的探针能在以后的杂交反应中获得较理想的杂交信号与噪音比。反应温度一定要控制在14~16℃。温度过高则会使DNaseⅠ的活性增强,导致切口过多,从而使探针的长度变短;同时还会导致链延伸至末端后自身回折形成发夹状结构,影响标记和杂交的效率。温度过低,则使DNA聚合酶活性降低,标记效率下降。
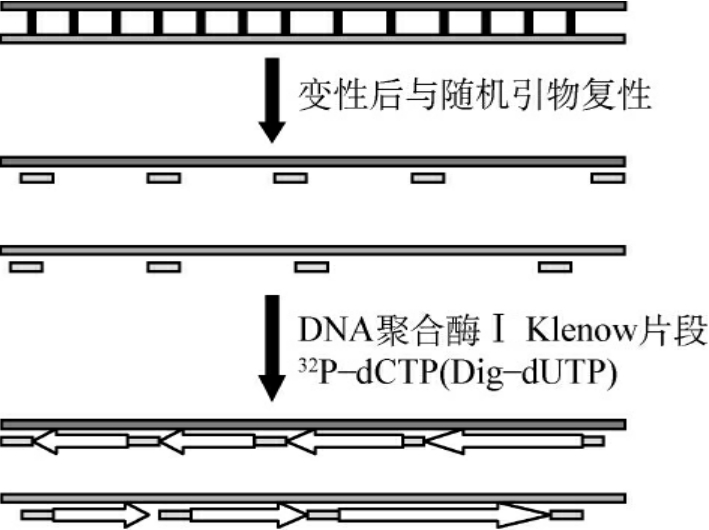
图4-8 随机引物延伸法标记探针
2.随机引物延伸法(random priming)DNA聚合酶Ⅰ的Klenow片段具有5′→3′聚合酶活性和3′→5′外切酶活性,但不具有5′→3′外切酶活性,它以单链DNA为模板,以寡核苷酸为引物,合成第2条链,反应底物中有放射性核素或其他标记的dNTP就可以掺入到新合成的链中去了(图4-8)。引物的寡核苷酸顺序是随机的,寡核苷酸片段长度为6个核苷酸,含有4096(46)种排列顺序,使它有可能作为任何DNA链的引物。所以,用这种方法对100bp大小的DNA片段进行标记也可以获得满意的结果。产物的比活度与模板的量有关,产物的长度与寡核苷酸引物的量成反比,产物的产量与反应时间呈正相关。
与切口平移法相比,随机引物法具有以下几个优点:①除能进行双链DNA标记外,也可用于单链DNA和RNA探针的标记。当以RNA为模板时,操作方法同上,但必须采用反转录酶,得到的产物是标记的单链cDNA探针。而切口平移法只适用于双链DNA的标记。②操作简单方便,避免了因DNaseⅠ处理浓度掌握不当所带来的一系列问题。③采用本法标记探针的活性除取决于标记核苷酸的比放射活性及加入量外,还取决于DNA的拷贝数。用加大寡核苷酸引物的方法使拷贝数增加,从而提高DNA探针的放射活性。④可直接在低熔点琼脂糖溶液中进行标记。⑤反应产物即新形成的标记DNA单链的长度与加入寡核苷酸引物的量成反比,因为DNA合成是从多个起点开始的,加入寡核苷酸数量越多,合成起点也越多,得到片段的长度也越短。按标准方法得到的标记产物长度一般为200~400bp,足以满足Southern、Northern、原位杂交以及克隆筛选的需要。当需要较长片段探针,可适当减少随机引物的加入量。
3.末端标记法 就是将核酸片段的5′端或3′端进行部分标记,标记活性较低,一般不用于分子杂交探针的标记,多用于RNA或DNA的序列分析和核酸链末端核苷酸鉴定等。
(1)5′端标记:标记DNA的5′端采用两种反应。第1种反应为正反应,在碱性磷酸酯酶的作用下,待标记的DNA 5′端脱去磷酸,然后在多核苷酸激酶作用下,将[γ-32P]-ATP的γ-磷酸基转到5′-羟基上。第2种反应为交换反应,在过量的[γ-32P]-ATP和ADP存在下,多核苷酸激酶直接催化[γ-32P]-ATP的γ-磷酸基与5′磷酸基进行交换。
(2)3′端标记
1)Klenow酶的3′端标记:当经限制性内切酶作用产生5′端突出的片段或连上具有产生5′突出末端的限制性内切酶识别部位的接头(linker)DNA,产生5′突出末端时,可以用大肠埃希菌Klenow酶来填补互补链上失去的核苷酸。根据已知的限制性内切酶的酶切末端核苷酸顺序,选择相应的含放射性核素的dNTP为标记物。
对于单链寡核苷酸,则可预先合成一小段(如8nt)与此探针互补的寡核苷酸作为引物,然后利用Klenow DNA聚合酶的链延伸反应获得标记的寡核苷酸探针。此法的特点是模板DNA与标记的DNA探针的长度不相同。因此如果需要的话,可采用电泳方法将它们分离开来(图4-9)。
2)T4噬菌体DNA聚合酶的3′端标记:T4噬菌体DNA聚合酶也具有5′→3′聚合酶活性和3′→5′外切酶活性。在没有dNTP存在下,T4DNA聚合酶起3′外切酶活性,切除线状DNA,产生5′端突出,当加入dNTP后,T4DNA聚合酶发挥聚合酶作用,重新合成为双链DNA。因此,具有5′-突出末端的DNA采用快速填充标记法,而具有平滑或3′-突出末端的DNA则先让T4DNA聚合酶发挥外切酶活性。
3)脱氧核苷酰转移酶(TdT)催化的3′端标记:在Co2+存在下,末端转移酶可将[α32P]-dNTP逐个转移到各种DNA的3′-羟基末端上,又称为加尾法。如果以ddNTP作底物,则可得到末端只延伸一个核苷酸的均一标记DNA。
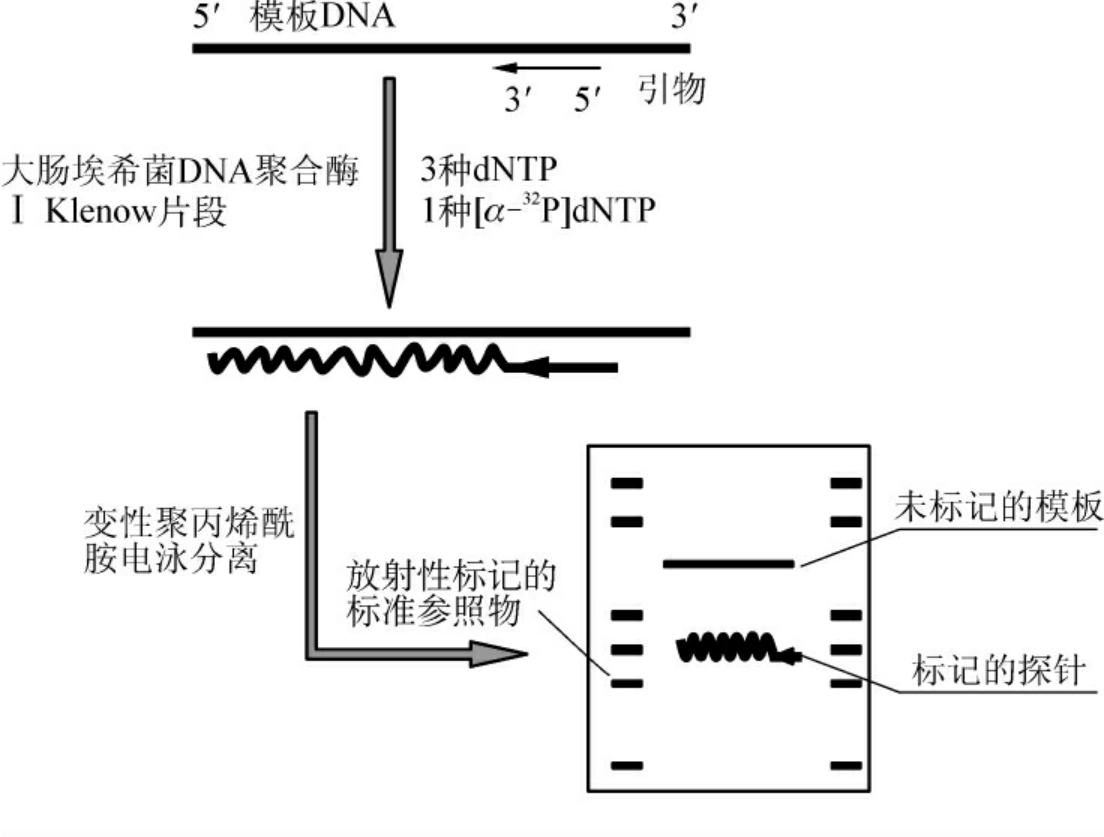
图4-9 寡核苷酸探针标记
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















