不同的杂交实验,如Southern、Northern、芯片杂交等,最适反应条件可能不尽相同,但基本的杂交动力学是一致的,尤其探针的制备和使用颇具共性。不是任意已知序列的核苷酸片段均可作为探针,理想的探针应具有如下特点:①高度特异性,只与靶核酸序列特异性杂交;②可被标记、便于杂交后检测,进行双链杂交分子的鉴定;③最好是单链核酸分子;④探针长度一般是十几个核苷酸到几千个核苷酸不等。小片段探针比大片段探针杂交速率快,特异性强,但15~30nt的寡核苷酸探针,带有的标记物少,其灵敏度较低;⑤作为探针的核苷酸序列常选取基因编码序列,避免用内含子及其他非编码序列;⑥标记后的探针应具有高灵敏度、高稳定性,且标记方法简便、安全。
一、核酸探针的种类
核酸探针有不同分类法。根据标记物的不同可分为放射性探针和非放射性探针两大类,根据探针的来源和性质不同又可分为DNA探针、RNA探针、cDNA探针、cRNA探针和寡核甘酸探针等。DNA探针还有单链DNA(single stranded,ssDNA)和双链DNA(double stranded,dsDNA)之分。
(一)DNA探针
DNA探针通常又被称为基因组DNA探针,是核酸分子杂交中最常用的探针,长度多在几百个碱基对以上。针对待测样品的特性,可制备相应的细菌、病毒、原虫、真菌动物或人类细胞DNA探针。这类探针多为某一基因的全部或部分编码序列,或某一非编码序列。这些DNA片段必须是特异的,比如细菌的毒力因子基因探针和人类Alu探针。对于较小的DNA病毒探针,常用其基因组全序列。
DNA探针有三大优点:第一,这类探针可克隆在质粒载体中,可以无限增殖,取之不尽,制备方法简便;第二,DNA探针不易降解(相对RNA而言);第三,DNA探针的标记方法较成熟,标记方法多样,能使用同位素和非同位素标记等多种标记法。
(二)cDNA探针
cDNA(complementary DNA)是指互补于mRNA的DNA分子,通常利用反转录酶由mRNA反转录生成。反转录作为一项重要的分子生物学技术,现已广泛用于基因的克隆和表达。从反转录病毒中提取的反转录酶早已商品化,比如常用的AMV和MMLV反转录酶。如果RT-PCR过程中就掺入标记物,可直接得到cDNA探针。也可以先获得未掺入标记的特定基因的cDNA分子,再通过常规分子克隆技术构建可以长期保存的克隆,此后便可按制备基因组DNA探针同样的程序制备cDNA探针。用这种技术获得的cDNA探针,与基因组DNA探针相比较,具有DNA探针的所有优点,同时cDNA探针不存在内含子及其他高度重复序列,是一种较为理想的核酸分子探针,尤其适用于基因表达的检测。
(三)RNA探针
制备RNA探针可通过SP6和T7体外转录体系。若采用SP6 RNA聚合酶体系,先将作为探针的DNA片段克隆到SP6表达载体的SP6启动子下游的克隆位点区,以适当限制性内切酶在插入序列的下游将质粒线性化,用DNA依赖性SP6 RNA聚合酶启动SP6启动子下游序列的转录,可得到高放射活性的RNA探针。应用T7RNA聚合酶体系的原理与操作方法基本与SP6 RNA聚合酶体系相同。目前已有比较成熟的单向和双向体外转录系统。该系统主要基于载体PSP和pGEM,这类载体在多克隆位点两侧分别带有SP6启动子和T7启动子,在SP6 RNA聚合酶或T7 RNA聚合酶作用下可进行RNA转录。如果在多克隆位点接头中插入了外源DNA片段,则可以以DNA两条链中的一条为模板转录生成RNA。这种体外转录反应效率很高,在1h内可合成近10μg的RNA产物。只要在底物中加入适量的放射性或生物素标记的dUTP,所合成的RNA就可得到高效标记。该方法能有效地控制探针的长度并可提高标记分子的利用率。
与cDNA探针类似,RNA中不存在高度重复序列,因此非特异性杂交较少,尤其适用于基因表达的检测;此外,因为RNA是单链,杂交时不存在互补双链的竞争性结合,杂交的效率高,杂交体较稳定,具有DNA探针所不能比拟的高杂交效率;杂交后RNase能将未杂交的探针分子消化掉,使本底降低。但RNA探针也存在易于降解和标记方法复杂等缺点。
(四)寡核苷酸探针
上述探针均为可利用克隆技术得到的核酸分子。另一类重要的探针是寡核苷酸探针,它是人工合成的DNA分子,一般长度为20~50nt,目前的合成法可有效地合成至少50个碱基的探针。可根据已知基因序列,选择一段与其精确互补的序列,用DNA合成仪人工合成这段寡核苷酸,纯化后标记,制成寡核苷酸探针。寡核苷酸探针序列可选择待测基因的有意链序列,也可选择反义链序列。
合成的寡核苷酸探针具有以下特点:第一,由于链短,其序列复杂度低,分子量小,所以和等量靶位点完全杂交的时间比克隆探针短;第二,寡核苷酸探针可识别靶序列内单个碱基的变化,因为短探针中碱基错配能大幅度降低杂交体的Tm值;第三,一次可大量合成寡核苷酸探针,使得这种探针价格低廉。与克隆探针一样,寡核苷酸探针能够用酶学或化学方法修饰以进行非放射性标记物的标记。
对于合成的寡核苷酸探针有以下要求:①长度:18~50nt,过长则杂交时间较长,合成量也低;而过短的探针特异性较差;②碱基成分:G+C含量为40%~60%,超出此范围则会增加非特异杂交;③探针分子内不应存在互补区,否则会出现抑制探针杂交的“发夹”状结构;④避免单一碱基的重复出现;⑤一旦选定某一序列符合上述标准,最好将该序列与核酸库中的核酸序列比较,探针序列应与靶序列核酸杂交,而与非靶区域的同源性不应超过70%或有连续8个或更多碱基的同源。
二、核酸探针的标记
为了便于示踪,探针必须采用一定手段加以标记,以利杂交结果的检测。目前常采用的探针标记物有生物素、荧光物质、放射性核素等。早期最常用的是放射性核素,如32P、35S、3H和131I 。放射性核素标记探针的检测灵敏度很高,但存在半衰期短和污染环境等缺点。近些年来发展迅速的非放射性标记物,如生物素、地高辛和荧光素等,已在国内外广泛应用,取得了较理想的结果。
在选择探针类型的同时,还需要选择标记方法。探针的实际灵敏度与所采用的标记方法有关,如随机引物延伸法往往得到比缺口平移法更高的比活性。选择什么标记方法主要视个人习惯和可利用条件而定,还应考虑实验的要求,如灵敏度和显示方法等。一般认为,放射性探针比非放射性探针的灵敏度高。目前,一些公司开发出化学发光检测法,采用与放射性探针类似的方法去检测,可以达到放射性探针的灵敏度。在检测单拷贝基因序列时,应选用标记效率高、显示灵敏的探针标记方法。在对灵敏度要求不高时,可采用保存时间长的生物素探针技术和比较稳定的碱性磷酸酶显示系统。
下面以地高辛、生物素或荧光染料标记探针为例阐明探针标记方法。大部分实验程序源自美国罗氏公司应用科学部的多种试剂盒。地高辛、生物素及荧光染料的标记方法基本相同。
(一)随机引物法标记双链DNA
随机引物标记法可以得到10ng ~ 3μg的DNA探针,既可以标记约200bp的较短的DNA分子,也可标记较长的DNA分子,如黏粒或λDNA。标准标记反应较快,约1h,于新合成的DNA探针上平均每20~25个核苷酸就可以掺入1个地高辛或生物素或荧光染料标记的脱氧尿苷三磷酸。这种标记密度对于间接检测来说可得到最灵敏的结果。新合成的带标记的探针的多少取决于模板DNA的量及纯度、所用标记物的类型以及标记反应的时间(表9-1)。
表9-1 模板量和标记时间对探针产量的影响
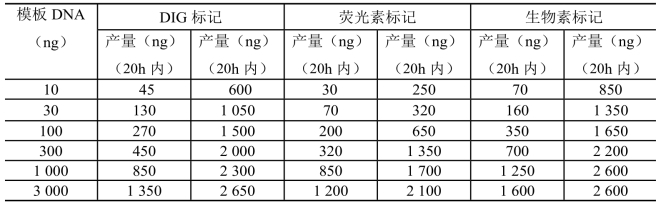
注:反应1h及20h后标记DNA的产量是通过放射性示踪物的掺入及点杂交来确定的。上述值均是10次独立标记实验结果的平均值,由于模板纯度及序列等的不同,具体实验中的结果与表中数值可能不同
本法得到的探针DNA的长度取决于模板DNA的量及长度。用线状pBR328质粒DNA作模板时,标准反应1h后得到的DNA探针长度为200~1 000bp。
线状DNA比环状或超螺旋DNA的标记效率高,无论是哪种DNA,标记前模板DNA必须充分热变性。
【材料】
(1)模板DNA(线状或超螺旋)。
(2)地高辛或生物素或荧光标记试剂盒(美国罗氏公司):标记物混合液成分包括5×反应缓冲液,50%甘油,1U/μl Klenow片段(标记级),随机引物,dATP、dGTP、dCTP各1mmol/L,0.65mmol/L dTTP,0.35mmol/L X-dUTP(X即DIG或生物素或荧光素)。
(3)0.2mol/L EDTA(pH 8.0)。
(4)4mol/L LiCl。
(5)无水乙醇、70%乙醇。
(6)TE缓冲液(10mmol/L Tris-HCl,1mmol/L EDTA,pH 8.0)。
【操作步骤】

如不急用,探针溶液可置-25~-15℃保存备用。如急用,则将其用原位杂交缓冲液稀释至常用浓度,如10~40ng/ml (由于DIG-dUTP对碱敏感,应避免DIG标记的探针接触强碱溶液,如0.2 mol/L NaOH)。
(二)PCR法标记双链DNA
这里只介绍一般PCR标记方法,具体反应条件应视具体情况而异。对每种新的引物及模板组合,应根据实验摸索出最佳的模板浓度、引物浓度、镁离子浓度、聚合酶浓度及最佳反应温度和时间。
用PCR法标记探针特别适用于模板量很少的样品,由少量模板即可得到大量探针。罗氏的该系列产品是标准化的试剂盒,包括PCR地高辛标记合成试剂盒(含有DIG-dUTP及两倍量dTTP,所得探针含标记物多,适于检测复杂基因组里的低拷贝特异序列)、PCR地高辛标记混合液(含有DIG-dUTP及19倍量dTTP,适于标记含重复序列的探针,可检测复杂基因组里的高拷贝序列)、PCR荧光素标记混合液(含有荧光素标记的dUTP及3倍量未标记的dTTP,适于直接原位杂交)。
1. 带高密度DIG探针的PCR标记法
【材料】①模板DNA;②10× PCR缓冲液(含15mmol/L MgCl2);③10× PCR DIG探针合成混合液(dATP、dCTP和dGTP各2mmol/L;1.3mmol/L dTTP,0.7mmol/L DIG-dUTP,pH 7.0);④Taq酶;⑤上下游引物。
【操作步骤】通过下述步骤最终得到50μl DIG标记的探针溶液,这足够用于设有对照的25次杂交反应。如无需制备这么多探针,可将下述反应体积按比例相应减少。

如果探针溶液不急用,则置-25~-15℃保存备用。应避免探针的反复冻融。如果立即用于杂交,则将其用原位杂交缓冲液稀释至常用浓度 。杂交时探针的用量通过经验确定,最初可尝试在20μl杂交液中加入2μl探针溶液。
2.带中等密度DIG探针的PCR标记法
【材料】 模板DNA;10 × PCR反应缓冲液,其中含15mmol/L MgCl2;10× PCR DIG标记混合液[含dTTP∶DIG-dUTP=19∶1(共2mmol/L),dATP、dCTP、dGTP各2mmol/L];Taq酶;上下游引物。
【操作步骤】 按下述操作将得到100μl DIG标记的探针,如果间接原位杂交设有对照,这100μl探针也足够做20~50次实验。如果不需要这么多探针,可同样操作,但相应减少各试剂用量。

同上,如果探针溶液不急用,则置-25~-15℃保存备用,应避免探针的反复冻融。如果立即用于杂交,则用原位杂交缓冲液稀释至常用浓度。杂交时探针的用量通过经验确定,最初可尝试在20μl杂交液中加入2~5μl探针溶液(100μl的TE缓冲液稀释探针时)。
3.PCR法标记荧光素
【材料】
(1)10 × PCR反应缓冲液:15mmol/L MgCl2、100mmol/L Tris-HCl、500mmol/L KCl,pH 8.3。
(2)10×PCR荧光素标记混合物:1.5mmol/L dTTP,0.5mmol/L 荧光素-dUTP,dATP、dCTP、dGTP各2mmol/L,pH 7.0。
(3)4 mol/L LiCl。
(4)TE缓冲液:10 mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0。
(5)无水乙醇、70%乙醇。
(6)Taq酶、上下游引物、DNA模板。
【操作步骤】 按下述操作将得到100μl荧光素标记的探针,如果间接原位杂交,设有对照,这100μl探针也足够做20~50次实验。如果不需要这么多探针,可同样操作,但相应减少各试剂用量。

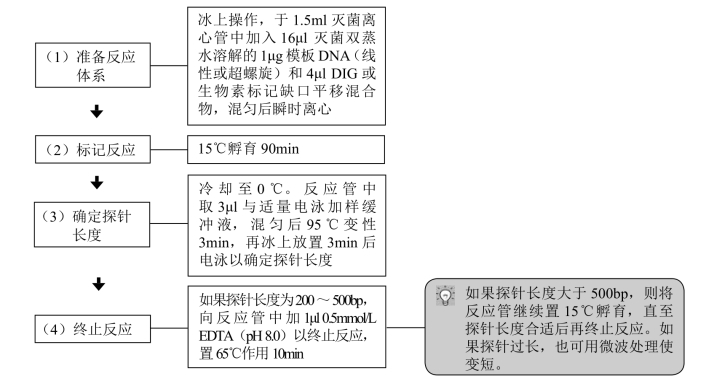
(三) 缺口平移法标记双链DNA
缺口平移法最早由Rigby等于1977年提出,1981年Langer等应用该方法在DNA分子中掺入核苷酸类似物。下面介绍用该法在新合成的DNA分子中平均每20~25个核苷酸掺入地高辛、生物素、荧光素、AMCA或四甲基罗丹明等的标记过程。这种标记密度的探针在间接检测(通过免疫化学反应)时有极高的灵敏度。对原位杂交而言,这类标记法得到的探针有效长度为200~500bp。标记过程中DNA也无需变性。
1.DIG或生物素标记
【材料】
(1)DIG或生物素标记缺口平移混合物:含5 × 反应缓冲液,50%甘油,DNA聚合酶Ⅰ,DNA酶Ⅰ,dATP、dCTP、dGTP各0.25mmol/L,0.17mmol/L dTTP,0.08mmol/L DIG或生物素标记的dUTP。
(2)0.5mmol/L EDTA(pH 8.0)。
(3)DNA模板。
【操作步骤】
2.荧光素或甲基罗丹明标记
【材料】 ① dATP、dCTP、dGTP、dTTP各2.5mmol/L,1mmol/L 荧光素或四甲基罗丹明标记的dUTP;② 4μl 缺口平移混合物(含5×反应缓冲液,50%甘油,DNA聚合酶Ⅰ,DNA酶Ⅰ);③ 0.5mmol/L EDTA(pH 8.0);④ DNA模板。
【操作步骤】

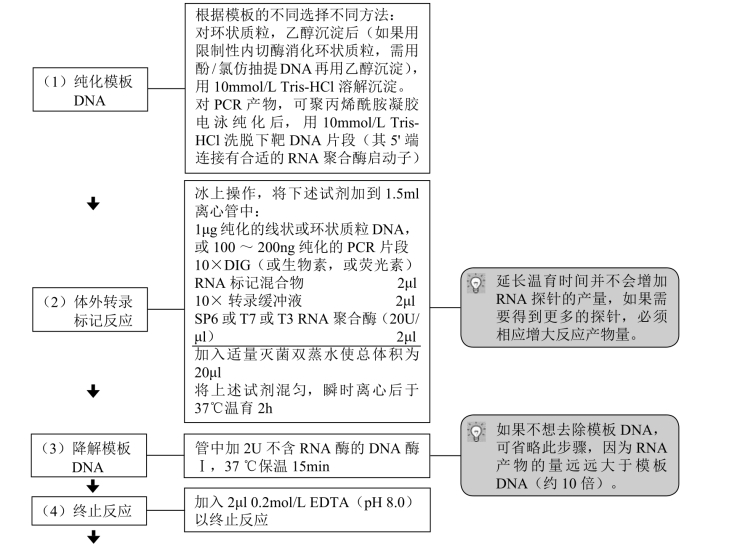
(四)体外转录法标记RNA
被转录的DNA片段需先克隆到含SP6或T7或T3 启动子的载体中,可用限制性内切酶将其线性化后作为转录的模板,也可不作处理而成为环状模板。转录产物RNA中平均每20~25个核苷酸就能掺入1个地高辛、生物素或荧光素标记的dUTP。标记反应详见下述步骤,2h的转录反应后,1μg的线状质粒模板DNA(插入的靶DNA片段约为1kb)可得到约10μg全长标记的RNA,如果需要更多的带标记的RNA,可相应增加反应体积。
【材料】
(1)10×DIG(或生物素或荧光素)RNA标记混合物: ATP、CTP、GTP各10mmol/L, 6.5mmol/L UTP,3.5mmol/L X-UTP(X即DIG或生物素或荧光素),pH 7.5
(2)10×转录缓冲液:400mmol/L Tris-HCl(pH 8.0), 60mmol/L MgCl2,100mmol/L DTT,20mmol/L精脒。
(3)10mmol/L Tris-HCl (pH 8.0),0.2mol/L EDTA(pH 8.0)。
(4)无水乙醇、酚、氯仿。
(5)SP6或T7或T3 RNA聚合酶(20U/μl),DNA酶Ⅰ。
(6)DNA模板。
【操作步骤】

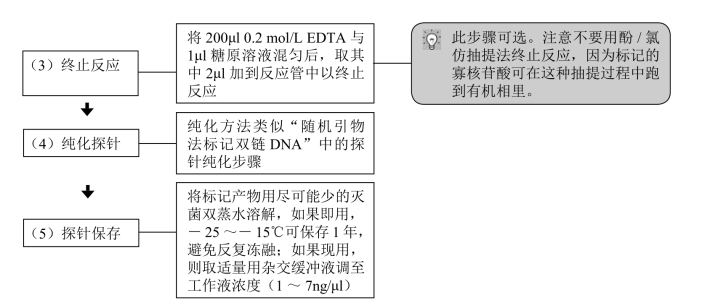
(五)寡核苷酸3'末端标记DIG-ddUTP或生物素-ddUTP
1990年Schmitz等报道了用末端转移酶在寡核苷酸的末端加上DIG-ddUTP的方法。通过高效液相色谱(HPLC)或凝胶电泳纯化的长14~100nt的寡核苷酸均可用本法标记。
【材料】
(1)5 × 缓冲液:1mol/L 二甲基胂酸钾,0.125mol/L Tris-HCl,1.25mg/ml 牛血清白蛋白,pH 6.6。
(2)25mmol/L CoCl2。
(3)待标记寡核苷酸。
(4)1mmol/L DIG-ddUTP或生物素-ddUTP。
(5)末端转移酶:保存于200mmol/L 二甲基胂酸钾,1mmol/L EDTA,200mmol/L KCl,0.2mg/ml 血清白蛋白,50% 甘油,pH 6.5(25℃)。
(6)0.2 mol/L EDTA(pH 8.0)。
(7)糖原溶液(20mg/ml,双蒸水稀释)。
【操作步骤】

标记反应的效率可通过在杂交时或直接检测时设立对照而确定,一般建议在直接法原位杂交时常规测定标记效率。通过聚丙烯酰胺凝胶电泳和银染,可分析标记的寡核苷酸与未标记的寡核苷酸:由于掺入了标记物,带DIG标记的寡核苷酸条带滞后。
(六) 化学交联法标记DNA或RNA
直接一步法掺入DIG或生物素标记是标记RNA或DNA的简便方法,平均每10个核苷酸可掺入1个DIG或生物素分子,后者直接连接到鸟嘌呤或腺嘌呤的N7上(表9-2)。这种方法可以标记不同来源的DNA(如质粒、PCR产物、cDNA)或RNA(总RNA或mRNA),也可标记寡核苷酸。
制备DNA或RNA模板需8~60min,标准标记反应需要0.2~0.5μl纯化的DNA或RNA模板,反应时间约35min。
表9-2 化学交联法掺入DIG时模板的纯度要求

【材料】① 纯化的DNA或RNA;② DIG交联物;③ 终止液(试剂盒中)。
【操作步骤】

附: 半抗原标记
1.地高辛(DIG)标记 地高辛(Digoxigenin,简写DIGo-或DIG)又称异羟基洋地黄毒苷配基,是一种从洋地黄植物中提取的类固醇化合物。标记时,DIG通过一个含17个碳原子的连接臂接到尿嘧啶的5-C上(图9-1),在DNA聚合酶、RNA聚合酶及末端转移酶等酶的作用下,标记的核苷酸以特定的浓度掺入到核酸探针中。核酸也可以通过化学法标记上DIG,标记时用到DIG-NHS酯或DIG 化学交联臂。
DIG标记试剂盒中的标记试剂一般是DIG标记的尿嘧啶核苷与dTTP呈一定比例的混合物,经标记反应后得到最适灵敏度的探针。大部分情况下,DNA探针序列上平均每隔20~25个核苷酸就会有1个DIG标记,这种标记密度使得DIG可以与抗DIG抗体有最合适的空间结合,DIG及其抗体形成的抗原抗体复合物也大到足以覆盖约20个核苷酸的序列。

图9-1 DIG-UTP/dUTP/ddUTP
UTP(R1= OH,R2=OH),dUTP(R1= OH,R2=H),ddUTP(R1= H,R2=H)
杂交体中DIG标记的探针可以用高亲和性的抗DIG抗体检测,比如用偶联有酶或荧光素的羊抗地高辛抗体Tab(抗原结合片段)结合物作为酶标或荧光标记,再分别用显色底物使杂交部位显色或产生荧光以达到检测目的,其反应过程见图9-2。
常用的免疫酶学检测方法有两类:①DIG–HRP(辣根过氧化物酶)检测体系,以DAB为底物,结果为棕色;以4-氯-1-萘酚为底物,结果为蓝色。②DIG–AKP检测体系,以BCIP/NBT为底物,结果为蓝紫色沉淀。同样是酶促化学反应,AKP灵敏度和分辨率较HRP高10倍左右,但HRP的优点为价廉、稳定。

图9-2 地高辛标记的探针检测酶联免疫反应
2.生物素标记 原则上,生物素的应用和地高辛类似,可用抗生物素抗体检测,但实验中更常用的不是抗生物素的抗体,而是用与生物素有高亲和力的链亲和素或亲和素。从卵蛋白中提取的亲和素,是一个68kD的糖蛋白(图9-3),25℃时的结合常数是10-15 M-1。
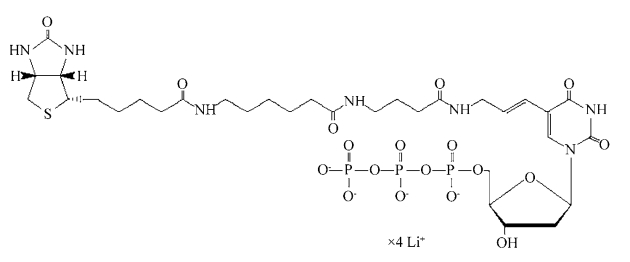
图9-3 生物素-dUTP
3.荧光素标记 荧光素标记的dUTP/UTP/ddUTP可通过酶反应掺入到核酸中(图9-4)。由于荧光素是一种直接标记物,不需要再通过免疫细胞化学方法实现可视化,所以杂交背景低。但直接法普遍的不足是敏感度不及间接法。不过,荧光素标记的核苷酸也可以用抗荧光素抗体-酶共轭物或非共轭抗体连同荧光素标记的二级抗体来检测,这就变成了间接法,其灵敏度与其他间接法类似。

图9-4 荧光素-dUTP
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















